电针联合依达拉奉对糖尿病周围神经病大鼠坐骨神经传导速度和氧化应激的影响①
邱有波,谢少华,杨拯,袁梦郎,李禹呈,江明礼,曹德琦,席丽,张晓
糖尿病周围神经病(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)主要的慢性并发症之一。DPN的发病机制是多因素共同作用的结果。线粒体电子传递链过氧化物产生过量,是高血糖导致血管损伤的共同机制,其核心是高糖引起线粒体中超氧阴离子生成过多,引发组织细胞发生氧化应激,最终导致糖尿病的各种慢性并发症[1]。大量研究证实,氧化应激在DPN中发挥重要作用,并与多种代谢途径异常相关[2]。
电针疗法是针刺与电刺激相结合的一种治疗方法,简单易行,可使神经细胞发生有效极化,使神经细胞的各种酶类活动性增加,轴突运输加强,代谢旺盛,有利于再生。电针治疗大鼠DPN可以提高血清超氧化物歧化酶(superoxidase dismutase,SOD)的活性,降低丙二醛(malonaldehyde,MDA)的含量,提高坐骨神经运动传导速度,从而有效治疗DPN[3-4]。依达拉奉不仅可有效捕捉、清除自由基,还能抑制黄嘌呤氧化酶和次黄嘌呤氧化酶的活性,降低氧自由基的浓度,并抑制迟发性神经元死亡;通过清除活性氧抑制神经细胞凋亡[5-6]。本研究观察电针联合依达拉奉对DPN坐骨神经传导速度和氧化应激的作用。
1 材料与方法
1.1 主要试剂及仪器 链脲佐菌素:SIGMA公司;依达拉奉注射液:国药集团国瑞药业有限公司;MDA试剂盒、SOD试剂盒:南京建成生物工程研究所。SDZ-IV型电针治疗仪:苏州医疗用品厂有限公司;血糖测定仪:长沙三诺生物传感技术有限公司;BL420生物机能实验系统,电热恒温水浴箱:成都泰盟科技有限公司。
1.2 方法
1.2.1 动物模型制备 清洁级健康成年SD大鼠60只,雌雄不拘,体重(230±10)g,由四川大学实验动物中心提供。适应性饲养5 d,禁食12 h后,50只腹腔注射链脲佐菌素60 mg/kg;72 h后尾静脉采血,血糖≥15 mmol/L确定为糖尿病模型;另10只大鼠腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液(正常组)。造模后继续饲养4周后,以空腹血糖≥15 mmol/L、坐骨神经神经传导速度明显减慢、摆尾温度阈值升高作为实验性DPN大鼠模型制备成功的标准。在确认实验性DPN大鼠模型成功的基础上,采用随机数字表法取出48只大鼠,分为电针组、依达拉奉组、联合组和模型组,每组12只。
1.2.2 治疗方法 ①电针组:将大鼠固定,取肾俞(双)、足三里(双)穴,针刺0.5 cm,接电针治疗仪,连续波,频率2 Hz,电流强度以刺激部位皮肌微颤为度,20 min/次,隔日1次,共12次;②依达拉奉组:每日腹腔注射依达拉奉3 mg/kg,共4周;③联合组:在电针治疗基础上每日腹腔注射依达拉奉3 mg/kg,共4周;④模型组:与电针组相同时间的固定,腹腔注射与依达拉奉组等量的生理盐水;⑤正常组:与电针组相同的固定和腹腔注射等量的生理盐水。
1.2.3 摆尾阈值检测 分别于造模前,造模后4周、8周,将大鼠固定在大鼠固定器内,露出鼠尾,尾部下1/5置于恒温加热水浴箱内。初始水温35℃,以2℃/min的速度加热。记录鼠尾抬离水面的温度即为摆尾温度阈值(TTT)。
1.2.4 神经传导速度检测 分别于造模后4周、8周,大鼠仰卧位固定,1.5%戊巴比妥钠40 mg/kg腹腔注射麻醉。沿左大腿内侧纵向切口,显露分离坐骨神经干。将刺激电极和引导电极分别置于神经近侧端和远侧端。应用BL-420生物机能实验系统测定大鼠坐骨神经动作电位,计算神经传导速度。
1.2.5 血清SOD和MDA检测 分别于造模后4周、8周经右心室采血3 ml,3000 r/min离心15 min,取上清,存于-20℃冰箱。1周内,用SOD和MDA测定试剂盒分别测定血清中SOD活性和MDA浓度。操作方法按试剂盒说明进行。
2 结果
2.1 血糖、体重、TTT 各组大鼠造模前血糖、体重、TTT之间无显著性差异(P>0.05)。造模后,各造模组血糖及TTT升高(P<0.05),体重降低(P<0.05)。电针组、依达拉奉组、联合组和模型组之间,血糖、体重无显著性差异(P>0.05)。造模8周后,联合组大鼠TTT低于电针组与依达拉奉组(P<0.05)。见表1~表3。
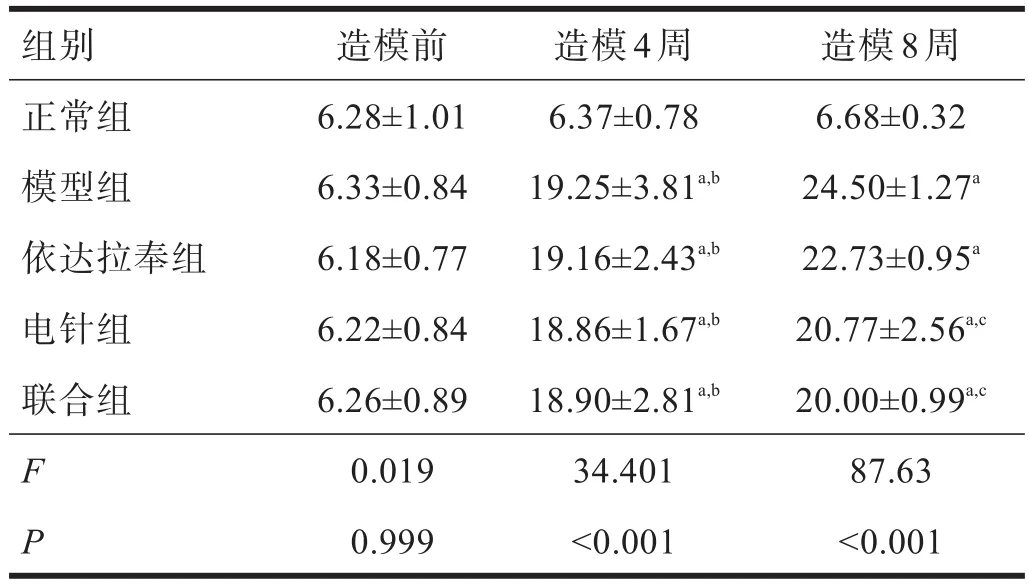
表1 各组大鼠造模前后血糖比较(mmol/L)

表2 各组大鼠造模前后体重比较(g)

表3 各组大鼠造模前后TTT比较(℃)
2.2 神经传导速度 造模4周后,电针组、依达拉奉组、联合组和模型组神经传导速度明显低于正常组(P<0.01)。造模8周后,电针组、依达拉奉组和联合组神经传导速度明显高于模型组(P<0.01);联合组神经传导速度明显高于电针组和依达拉奉组(P<0.01)。见表4。
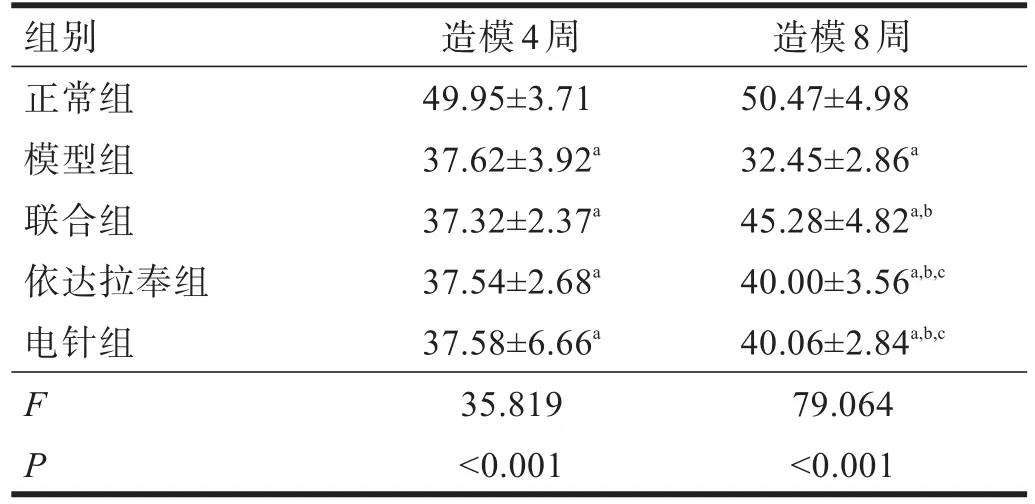
表4 各组大鼠造模前后神经传导速度比较(m/s)
2.3 血清SOD和MDA 造模后,电针组、依达拉奉组、联合组和模型组SOD活性降低(P<0.01),MDA浓度升高。造模后4周,电针组、依达拉奉组、联合组和模型组SOD活性和MDA浓度均无显著性差异(P>0.05)。造模8周后,电针组、依达拉奉组和联合组后SOD活性明显升高(P<0.01),MDA浓度明显降低(P<0.01);联合组优于电针组和依达拉奉组(P<0.01)。见表5、表6。
3 讨论
糖尿病是由遗传和环境因素相互作用而引起的一组代谢异常综合征,其患病率正在迅速升高。长期糖尿病可引起多个系统器官的慢性并发症,导致残疾和死亡。其中,约半数以上患者并发DPN,是非创伤性截肢的主要原因。
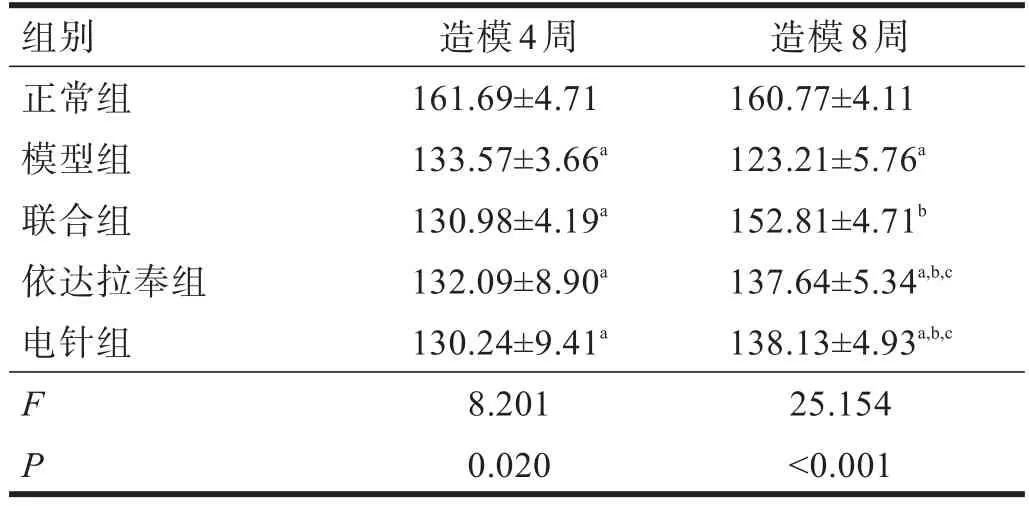
表5 各组大鼠造模前后SOD活性比较(U/ml)

表6 各组大鼠造模前后MDA浓度比较(nmol/ml)
DPN是糖尿病微血管并发症,与其他微血管并发症有着共同的发病机制。经过近半个世纪的深入研究,先后发现多元醇途径、高级糖基化终末代谢产物蓄积、蛋白激酶C激活、己糖胺途径等代谢异常在DPN的发生发展过程中发挥重要作用。近年来,一些学者提出,以上4种机制均与高血糖时,机体氧化应激水平升高密切相关。已有多项研究证实,无论体内体外,高糖均可引起氧化应激水平升高。氧化应激水平的升高可激活蛋白激酶C通路、多元醇通路、己糖胺通路及终末糖基化产物形成,并激活核因子(NF)-κB上调黏附分子及炎性因子基因表达。线粒体电子传递链产生过多活性氧簇是高血糖激活各条通路引起组织损伤的重要环节[7]。依达拉奉作为一种自由基清除剂,具有良好的抗氧化作用,可在一定程度上改善氧化应激状态,减轻周围神经的结构和功能损伤,对周围神经起到一定的保护和治疗作用;电针肾俞与足三里两穴可增加DPN大鼠坐骨神经神经营养因子(NGF)表达,促进坐骨神经的修复,提高坐骨神经传导速度。
MDA及SOD是自由基损伤和酶促、非酶促系统清除自由基作用的敏感指标[8]。MDA作为自由基攻击生物膜中不饱和脂肪酸,裂解生成的脂质过氧化反应终产物,能较好地反映脂质过氧化水平,间接反映细胞损伤程度[9]。SOD是体内氧自由基的清除剂之一,对机体的氧化与抗氧化平衡起着至关重要的作用,它通过催化消除超氧阴离子自由基,阻碍活性氧的产生,保护细胞的正常功能[10]。测定SOD活性可间接反映体内自由基的产生和毒物对细胞的损伤情况,亦可反应组织内清除自由基的能力。
故研究显示,电针和依达拉奉均能够降低DPN大鼠体内氧化应激水平,联合应用可以增强其降低氧化应激水平的疗效。
神经传导速度的测定对于病变位于脊髓后神经根、周围神经、肌肉或神经末梢的诊断具有确定意义。DPN患者运动和感觉神经传导速度减慢是其最早的特征,下肢较上肢、远端较近端更为明显。糖尿病患者发生神经病变时,神经传导速度减慢通常被作为一个灵敏的指标。在实验性DPN研究中也发现,链尿佐菌素诱导的糖尿病大鼠,在糖尿病早期坐骨神经运动和感觉神经传导速度显著减慢,随病程延长进一步减慢[11]。本研究显示,电针、依达拉奉对改善DPN的神经传导速度具有一定作用,联合使用能够增强疗效。
TTT主要代表无髓纤维和小的有髓纤维的功能[12]。糖尿病时大鼠温度刺激阈值增高。本研究显示,电针及依达拉奉能够降低DPN大鼠TTT,联合应用效果更优。
综上所述,糖尿病大鼠早期即并发神经病变,损伤程度随病程延长而加重。糖尿病4周大鼠已有明显的神经功能障碍,并存在显著的氧化应激。电针和依达拉奉均能提高糖尿病大鼠血清SOD的活性,降低MDA的含量,改善神经传导速度,具有良好的防治DPN的作用。联合应用疗效更优。
[1]Brownlee M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[2]Feldman EL.Oxidative stress and diabetic neuropathy:a new understanding of an old problem[J].J Clin Invest,2003,111(4):431-433.
[3]李永方,李尚丽,郭秀英,等.电针对糖尿病周围神经病变大鼠相关生化代谢的影响[J].中华物理医学与康复杂志,2005,27(9):574-575.
[4]张秋娟,施茵,张云云,等.电针对实验性糖尿病周围神经病变大鼠坐骨神经传导速度和超微结构的影响[J].中国组织工程研究与临床康复,2007,(16):3069-3073.
[5]Tomatsuri N,Yoshida N,Takagi T,et al.Edaravone,a newly developed radical scavenger,protects against ischemia-reperfusion injury of the small intestine in rats[J].Int J Mol Med,2004,13(1):105-109.
[6]Ohta S,Iwashita Y,Takada H,et al.Neuroprotection and enhanced recovery with edaravone after acute spinal cord injury in rats[J].Spine,2005,30(10):1154-1158.
[7]Nishikawa T,Edelstein D,Du XL.Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage[J].Nature,2000,404(6779):787-790.
[8]Nair N,Bedwal S,Prasad S,et al.Short term zinc deficiency in diet induces increased oxidative stress in testes and epididymis of rats[J].Indian J Exp Biol,2005,43(9):786-794.
[9]Gawel S,Wardas M,Niedworok E,et al.Malondialdehyde(MDA)as a lipid peroxidation marker[J].Wiad Lek,2004,57(9-10):453-455.
[10]Bailey MA,Ingram MJ,Naughton DP.A novel anti-oxidant and anti-cancer strategy:a peptoid anti-inflammatory drug conjugate with SOD mimic activity[J].Biochem Biophys Res Commun,2004,317(4):1155-1158.
[11]Lauria G,Lombardi R,Borgna M,et al.Intraepidermal nerve fiber density in rat foot pad:neuropathologic-neurophysiologic correlation[J].J Peripher Nerv Syst,2005,10(2):202-208.
[12]Apfel SC.Neurotrophic factors in the therapy of diabetic neuropathy[J].Am J Med,1999,107(2B):34S-42S.

