偏硅酸钠对氧化低密度脂蛋白刺激iNOS表达的抑制作用
黄 伟 侯建明 李丽纬 甄艳军 李志永 (河北医科大学西校区基础课教学部,河北 石家庄 05009)
我们以往的整体动物实验表明偏硅酸钠能抑制高脂血症条件下动脉粥样硬化(AS)的形成和发展,近期我们通过细胞培养证实偏硅酸钠可以下调氧化低密度脂蛋白(ox-LDL)刺激的某些炎性因子的基因表达,减少炎性因子释放,抑制细胞黏附,提示抑制炎性反应是偏硅酸钠的抗AS作用机制之一〔1〕。一氧化氮(NO)代谢异常,诱导型一氧化氮合酶(iNOS)表达增加是细胞炎性反应的又一重要标志,本文以具有内皮细胞特点的膀胱癌细胞株ECV-304为材料,观察偏硅酸钠对ox-LDL刺激的iNOS表达的抑制作用,并探讨其可能的机制,以进一步丰富偏硅酸钠抗炎、抗AS作用的基础研究。
1 材料与方法
1.1 材料 ECV304细胞株(武汉大学中国动植物细胞保藏中心,此为膀胱癌细胞株,但是具有许多内皮细胞特性),新生小牛血清(四季青公司),DMEM培养液和胰酶(GIBCO公司),NO、NOS、iNOS试剂盒(南京建成生物工程研究所),TRIzol试剂和PCR试剂盒(北京天根公司),兔抗人β-Actin抗体、兔抗人iNOS抗体、辣根酶标记羊抗兔IgG(北京博奥森生物技术有限公司),ECL(美国Santa Cruz公司),其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 ox-LDL的制备 参照文献〔2〕制备。
1.2.2 细胞培养与分组 含15%新生小牛血清的DMEM作为ECV304细胞株培养液,5%CO2培养箱中37℃培养,对数生长期细胞的培养液换成无血清DMEM培养液,6 h后分成5组。①正常对照组:无血清 DMEM培养液;②oxLDL组:无血清DMEM培养液中加入终浓度为 80 μg/ml的 ox-LDL;③68.5 mg/L组:无血清DMEM培养液中加入Na2SiO3使硅终浓度为68.5 mg/L。④34.2 mg/L组:硅终浓度为34.2 mg/L。⑤17.1 mg/L组:硅终浓度为17.1 mg/L。③④⑤组均在培养1 h后加入终浓度80 mg/L的ox-LDL。12 h后收集细胞和培养液,检测有关指标。
1.2.3 培养液中NO含量检测 各组细胞培养液收齐后,按照试剂盒说明步骤,硝酸还原酶法测NO含量。
1.2.4 细胞内NOS、iNOS活性检测 各组细胞收齐后,反复冻融细胞,使细胞破裂,按照试剂盒说明步骤,化学比色法测NOS和iNOS活性,用比活性表示。蛋白含量采用考马斯亮蓝法测定。
1.2.5 细胞iNOS mRNA、LOX-1 mRNA、NOX4 mRNA的检测采用半定量反转录聚合酶链式反应(RT-PCR)方法测定。按Trizol试剂盒说明书提取各组细胞总mRNA,RNA的反转录及扩增过程按试剂盒说明书进行。扩增时的引物和条件为iNOS上游引物:AGCGGTAACAAAGCAGATAGA,下游引物:CACAAGGTCAGGTGGGATT(扩增长度361 bp),5 min预变性后,94℃ 70 s、56℃ 45 s、72℃ 70 s循环30次。LOX-1上游引物:TGGGAAAAGAGCCAAGAGAA,下游引物:TGCAGCCAGCTAAATGACAG(229 bp),5 min 预变性后,94℃ 45 s、51.8℃ 40 s、72℃ 50 s循环30次。NOX4上游引物:CTCAGCGGAATCAATCAGCTGTG,下 游 引 物:AGAGGAACACGACAATCAGCCTTA(286 bp),5 min 预变性后,94℃ 60 s、58℃ 60 s、72℃ 60 s循环30次。GAPDH上游引物:GTGAAGGTCGGAGTCAACG,下游引物:GGTGAAGACGCCAGTGGACTC(300 bp),5 min预变性后,94℃ 30 s、57℃ 30 s、72℃ 40 s循环30次。30 个循环后72℃延伸5 min。取10 μl反应产物在1%琼脂糖凝胶电泳,EB染色,电泳图像分析系统进行检测,以各基因与GAPDH的灰度值比值代表mRNA的表达水平。
1.2.6 iNOS蛋白表达的检测 采用Western印迹检测细胞内iNOS蛋白量。按TRIzol试剂盒说明书提取细胞蛋白,步骤简述如下:TRIzol处理细胞得到匀浆,离心,分离出含蛋白的有机相,用异丙醇沉淀蛋白,分别用含0.3 mol/L盐酸胍的95%的乙醇和无水乙醇洗涤蛋白,真空干燥,1%的SDS溶解蛋白质。所得蛋白经SDS-PAGE电泳、转膜后分别与一抗(兔抗人iNOS)、二抗(羊抗兔IgG,稀释度1∶3 000)室温孵育1 h,洗膜,ECL发光法检测蛋白含量。以β-actin作为内参照,扫描灰度,计算iNOS与β-actin的比值。
1.3 统计学方法 采用SPSS10.0软件进行方差分析。
2 结果
2.1 培养液中NO含量变化 ox-LDL组培养液NO浓度较对照组明显降低,差异有统计学意义(P<0.01),只有正常水平的31.9%。加偏硅酸钠的三个组均使NO浓度显著上升(P<0.01),其中68.5 mg/L组和34.2 mg/L组的NO浓度恢复到接近正常水平,见表1。
2.2 细胞NOS、iNOS活性、iNOS mRNA、iNOS蛋白表达的变化 表1和图1显示ox-LDL组NOS活性较正常对照组明显降低,iNOS活性则明显升高。加偏硅酸钠后各组NOS活性比ox-LDL组升高,iNOS活性则下降(P<0.01)。68.5 mg/L组iNOS活性比 ox-LDL组降低 55.6%,34.2 mg/L组降低 44.4%,17.1 mg/L组降低47.2%。细胞内iNOS蛋白量和mRNA水平的变化呈现与iNOS活性相同的趋势。34.2 mg/L组的iNOS蛋白和mRNA分别比ox-LDL组降低66.5%和37.6%(P<0.01)。
2.3 细胞LOX-1 mRNA和NOX4 mRNA的变化 ox-LDL组细胞的LOX-1 mRNA和NOX4 mRNA水平显著增高,培养液中加入硅含量32.2 mg/L的偏硅酸钠后细胞LOX-1 mRNA和NOX4 mRNA均明显被下调(P<0.01),见图2,表2。
表1 Na2SiO3对ECV304细胞NO、NOS和iNOS的影响(n=5,s)
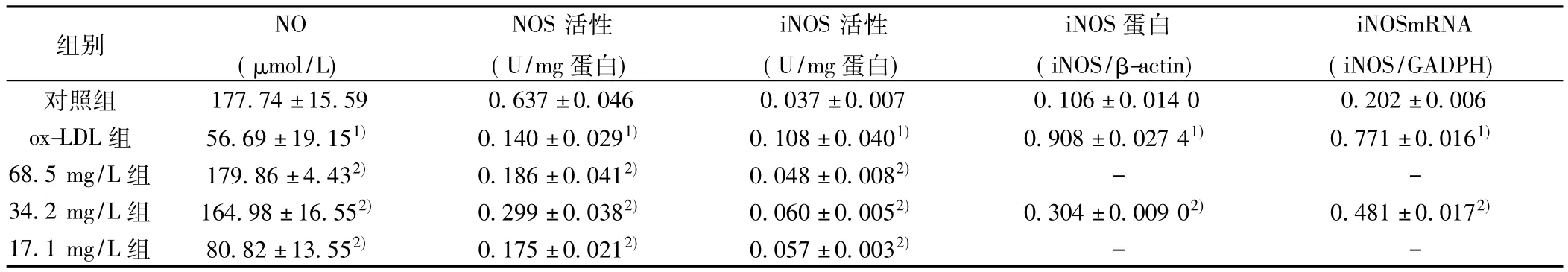
表1 Na2SiO3对ECV304细胞NO、NOS和iNOS的影响(n=5,s)
与对照组比较:1)P<0.01;与ox-LDL组比较:2)P<0.01
组别NO(μmol/L)NOS活性(U/mg蛋白)iNOS活性(U/mg蛋白)iNOS蛋白(iNOS/β-actin)iNOSmRNA(iNOS/GADPH)±0.014 0 0.202±0.006 ox-LDL组 56.69±19.151) 0.140±0.0291) 0.108±0.0401) 0.908±0.027 41) 0.771±0.0161)68.5 mg/L组 179.86±4.432) 0.186±0.0412) 0.048±0.0082) - -34.2 mg/L组 164.98±16.552) 0.299±0.0382) 0.060±0.0052) 0.304±0.009 02) 0.481±0.0172)17.1 mg/L组 80.82±13.552) 0.175±0.0212) 0.057±0.0032)对照组 177.74±15.59 0.637±0.046 0.037±0.007 0.106--

表2 细胞LOX-1 mRNA和NOX4 mRNA的变化

图1 iNOS蛋白和mRNA的表达
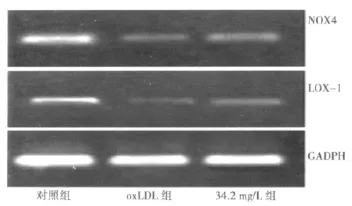
图2 偏硅酸钠对ox-LDL刺激的NOX和LOX-1 mRNA的调节作用
3 讨论
ECV304细胞株很长时间被视为人脐静脉内皮细胞株而用于有关AS的研究,2000年后进一步鉴定发现ECV304兼具膀胱癌细胞株T24和内皮细胞的特性〔3〕。本文以ox-LDL刺激ECV304细胞,观察偏硅酸钠抑制炎性反应的情况,其结果对其他细胞特别是内皮细胞有参考价值。
ox-LDL既能抑制内皮细胞的内皮型一氧化氮合酶(eNOS)活性也能抑制eNOS基因表达,同时刺激iNOS表达。酶活性的异常变化引起NO代谢异常,进而引发AS等炎症性疾病〔4,5〕。抑制前炎因子对iNOS表达的刺激作用、纠正NO代谢异常是抗炎、抗AS的重要环节〔6〕。我们曾证实偏硅酸钠能抑制ECV304细胞黏附单个核细胞,提示偏硅酸钠的抗炎作用〔1〕。本实验提示ox-LDL使ECV304细胞eNOS活性降低(总NOS活性减去iNOS活性基本代表eNOS的活性)。iNOS的mRNA和蛋白量均升高,表明ox-LDL通过上调iNOS基因表达而使ECV304细胞内iNOS活性增加。上述结果与文献报道的ox-LDL对内皮细胞的影响相吻合。培养液加入偏硅酸钠后,高、中、低三个浓度组均显示很大程度抑制了ox-LDL对NOS和iNOS的影响,这个结果为偏硅酸钠抗炎、抗AS作用提供了新的实验依据。
ox-LDL刺激内皮细胞炎性反应的机制之一是通过LOX-1激活NADPH氧化酶(NOX)。NOX有多个类型,其中NOX4主要分布在内皮细胞。正常情况下NOX4活性处于低水平状态,ox-LDL经由LOX-1介导刺激NOX4表达,NOX4催化产生大量活性氧(ROS),增多的ROS可通过激活NF-κB、AP-1等转录因子活性引起一系列炎症反应相关基因表达,其中包括iNOS基因〔7~9〕。本实验观察到 oxLDL组的 LOX-1和 NOX4 mRNA水平显著增加,这可能就是ECV304细胞iNOS基因表达增加的上游事件。用偏硅酸钠干预后,细胞内LOX-1和NOX4 mRNA水平大幅下降,提示偏硅酸钠下调iNOS mRNA表达的机制之一就在于其首先抑制ox-LDL刺激的LOX-1和NOX4表达,进而减少细胞内ROS的生成。偏硅酸钠通过何种方式抑制ox-LDL的刺激作用值得进一步探索。
1 黄 伟,李丽玮,甄艳军,等.偏硅酸钠对ECV-304细胞株与单个核细胞黏附的影响〔J〕.中国老年学杂志,2009;29(4):796-8.
2 姜远英,曾华武.改良沉淀法快速分离制备人血清低密度脂蛋白〔J〕. 第二军医大学学报,1997;18(4):390.
3 Suda K,Rothen-Rutishauser B,Günthert M,et al.Phenotypic characterization of human umbilical vein endothelial(ECV304)and urinary carcinoma(T24)cells:endothelial versus epithelial features〔J〕.In Vitro Cell Dev Biol Anim,2001;37(8):505-14.
4 Knowles JW,Reddick RL,Jennette JC,et al.Enhanced atherosclerosis and kidney dysfunction in eNOS(-/-)Apoe(-/-)mice are ameliorated by enalapril treatment1〔J〕.Clin Invest,2000;105(4):451-8.
5 Lowenstein CT,Padalko Elizaveta.iNOS(NOS2)at a glance〔J〕.J Cell Sci,2004;117(14):2865-7.
6 Tedeschi E,Menegazzi M,Yao Y,et al.Green tea inhibits human inducible nitric-oxide synthase expression by down-regulating signal transducer and activator of transcription-1α activation〔J〕.Mole Pharmacol,2004;65(1):111-20.
7 Cominacini L,Pasini AF,Garbin U,et al.Oxidized low density lipoprotein(ox-LDL)binding to ox-LDL receptor-1 in endothelial cells induces the activation of NF-kB through an increased production of intracellular reactive oxygen species〔J〕.J Biol Chem,2000;275(17):12633-8.
8 Chen JW,Liu Y,Liu HM,et al.Lectin-like oxidized low-density lipoprotein receptor-1(LOX-1)transcriptional regulation by Oct-1 in human endothelial cells:implications for atherosclerosis〔J〕.Biochem J,2006;393(1):255-65.
9 Tetsuro A,Takanari K,Hiroaki O,et al.NOX4 as the major catalytic component of an endothelial NAD(P)H oxidase〔J〕.Circulation,2004;109(2):227-33.

