甘麦大枣汤加味对抑郁症模型大鼠海马-HPA轴的调节作用
张 晟 戴薇薇 张学礼 金国琴 夏花英 (上海中医药大学基础医学院生物化学教研室,上海 201203)
边缘系统与HPA轴的关系非常密切,如海马可抑制HPA轴的活性,并参与该轴应激反应的抑制调节。本研究以孤养加慢性不可预见性中等刺激所致抑郁症大鼠为模型,以西药文拉法辛为对照,探讨甘麦大枣汤加味对模型大鼠HPA轴及海马的调节作用。
1 材料与方法
1.1 药物与试剂 甘麦大枣汤加味由甘草、淮小麦、大枣、柴胡、郁金、知母等组成,中药购于上海雷允上药业有限公司。方药制成煎剂,浓度为2.3 g生药/ml,4℃冰箱保存,临用稀释。文拉法辛为成都大西南制药股份有限公司产品(产品批号:050702)。主要试剂:Trizol试剂为Molecular Research Centre Inc.产品;RevertAidTM第一链cDNA合成试剂盒为Fermentas公司产品;促肾上腺皮质激素(ACTH)放免分析试剂盒为北京北方生物技术研究所产品;大鼠皮质酮(CORT)放免分析试剂盒为Diagnostic Systems Laboratories Inc.产品;GR引物(上游:5'-TGGACT CCA AAG AAT CCT TAG-3',下游:5'-GAT ACA ATT TCA CAC TGC CTC-3',扩增片段550 bp)、BDNF引物(上游:5'-CTT TTG TCT ATG CCC CTG CAG CCT T-3',下游:5'-AGC CTC CTC TGC TCT TTC TGC TGG A-3',扩增片段310 bp)、β-actin 引物(上游:5'-ATG GGC ACA GTG TGG GTG AC-3' ,下游:5'-TGA CGA GGC CCA GAG CAA GA-3',扩增片段为330 bp)、GAPDH引物(上游:5'-ACC ACA GTC CAT GCC ATC AC-3',下游:5'-CCA CCA CCC TGT TGC TGT AG-3',扩增片段为450 bp)均由上海生工生物工程技术服务有限公司合成。
1.2 主要仪器 γ-计数器:中科日环有限公司(型号:SN682);紫外可见分光光度计:上海精密科学仪器有限公司(型号:UV754N);高速低温离心机:Eppendorf(型号:Centrifuge 5417R);高速组织捣碎器:Misonix Incorported(型号:XL2000-010);电子天平:上海精密科学仪器有限公司(型号:JA2003N);PCR扩增仪:美国PE公司(型号:9600);凝胶扫描及分析系统:上海复日科技有限公司(型号:FR-200);电泳仪:上海生化所西巴斯生物技术开发公司(型号:DY-A);电泳槽:北京市六一仪器厂(型号:DYCP-31P)。
1.3 动物分组及给药 SPF级SD雄性大鼠,体重(225.0±10)g,由上海中医药大学医学实验动物中心提供〔使用证号:SYXK(沪):2004-0005〕。大鼠随机分为4组:①正常对照组、②孤养加慢性不可预见性温和刺激模型组(模型组)、③模型+文拉法辛组(西药组)、④模型+甘麦大枣汤加味组(中药组)。其中西药组大鼠按体重比为正常人的10倍剂量灌胃给药,中药组大鼠按体重比为正常人的20倍剂量灌胃给药,正常对照组与模型组用等量生理盐水灌胃,每日一次。
1.4 大鼠造模 参照文献〔1〕,将②、③、④组大鼠孤养,接受各种不同的应激刺激,包括冰水游泳(4℃,5 min)、热应激(42℃,5 min)、潮湿环境(12 h)、摇晃(1 次/s,15 min)、夹尾(1 min)、配对饲养(12 h)、禁水(24 h)、禁食(48 h)和昼夜颠倒等刺激,每日一种,每种刺激平均接受2次。
1.5 海马总RNA的提取 造模第21天杀鼠,分离海马。每100 mg组织加入1 ml Trizol,高速组织捣碎器充分打碎组织块制备匀浆,按试剂盒说明书提取总 RNA。紫外分光光度计测定A260和A280,甲醛变性凝胶电泳鉴定RNA质量。
1.6 RT-PCR法测定海马GR、BDNF mRNA含量 每组取4个质量合格的RNA样本,等量混合后取2.0 μg总RNA进行RT反应。GR:取4 μl RT反应产物,以 β-actin为内参,进行PCR扩增反应,扩增条件:94℃ 5 min,(94℃ 45 s,60℃ 60 s,72℃ 45 s)×30 个循环,72℃ 5 min,4℃ 终止;BDNF:取 2 μl RT 反应产物,以GAPDH为内参,进行 PCR扩增反应,扩增条件:94℃ 5 min,(94℃ 45 s,55℃ 45 s,72℃ 45 s)×30 个循环,72℃ 5 min,4℃终止。PCR产物进行琼脂糖凝胶电泳,电泳图片进行密度积分的比较。
1.7 放免法测定血浆CORT、ACTH含量 腹主动脉取血5 ml,加入含 50 μl肝素(12 500单位)的试管中,混匀,4℃,3 000 r/min离心10 min,分离血浆,取上清分装2~3份,-20℃保存。测定前,使样本置于室温或冷水中复融,再次4℃,3 000 r/min离心5 min,取上清,按照试剂盒说明书操作,测定血浆CORT、ACTH含量。
1.8 统计学处理 应用SPSS11.5软件进行单因素方差分析,实验数据以s表示。
2 结果
2.1 垂体重/体重及肾上腺重/体重结果 由表1可见,与正常组比较,模型组大鼠垂体重/体重显著增高,肾上腺重/体重降低,但无统计学差异;与模型组比较,西药组和中药组大鼠的垂体重/体重有下降趋势,肾上腺重/体重有上升的趋势,但均无统计学差异。
表1 各组大鼠垂体重/体重及肾上腺重/体重的比较(s)
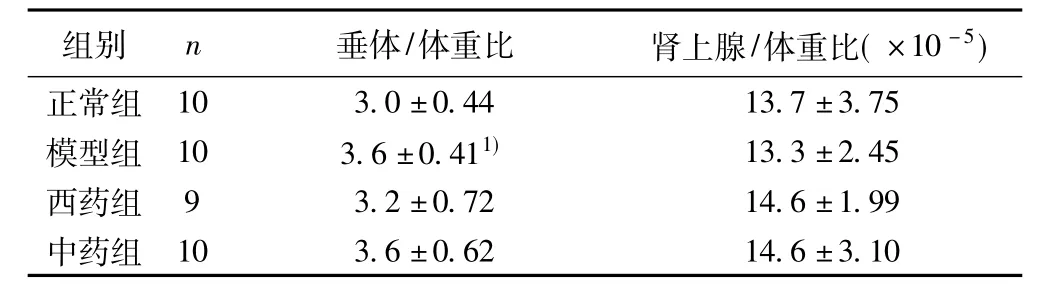
表1 各组大鼠垂体重/体重及肾上腺重/体重的比较(s)
与正常组比较:1)P<0.05;下表同
?
2.2 血浆ACTH、CORT含量检测 由表2可见,与正常组比较,模型组大鼠的血浆CORT、ACTH含量显著增高;与模型组比较,西药组与中药组大鼠的血浆CORT含量显著下降,血浆ACTH含量有下降趋势,但无统计学差异。
表2 各组大鼠血浆CORT、ACTH含量比较(s)

表2 各组大鼠血浆CORT、ACTH含量比较(s)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 n 血浆ACTH含量(pg/ml)血浆CORT含量(ng/ml)正常组9.3±1.53 222.3±45.75模型组 8 14.5±5.751) 315.9±49.031)西药组 8 11.8±3.86 239.3±57.682)中药组 8 12.9±3.66 227.8±44.442)8
2.3 海马GR、BDNF mRNA表达变化 由图1、表3可见,与正常组比较,模型组大鼠海马GR、BDNF mRNA表达降低;与模型组比较,西药组及中药组大鼠海马GR、BDNF mRNA的表达呈现不同程度的上调。

表3 各组大鼠海马GR/β-actin和BDNF/GAPDH密度积分比值比较
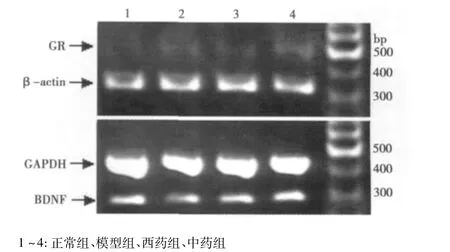
图1 大鼠海马GR、BDNF mRNA RT-PCR扩增产物凝胶电泳图
3 讨论
孤养加慢性不可预见性温和刺激所致抑郁症模型是目前广泛采用的抑郁症模型〔2〕。该模型与中医认为七情所伤导致郁证的理论也较为符合,我们以往的研究结果也显示该抑郁症模型大鼠水平运动、垂直活动及糖水消耗显著下降,表明该模型大鼠在行为学上表现为活动度、对新鲜周围环境的好奇度以及对奖赏反应均显著下降,而中药甘麦大枣汤加味与西药文拉法辛对行为学异常有较好纠正作用〔3〕。
HPA轴在机体的应激反应中发挥着重要作用。当机体受到刺激时,下丘脑室旁核(PVN)小细胞神经元分泌包括CRH在内的多种促进ACTH分泌的激素,进而刺激垂体分泌ACTH,ACTH经血循环达肾上腺,促使GC分泌增多〔4〕。本实验中,与正常组比较,模型组大鼠的垂体重/体重以及血浆ACTH、CORT浓度显著高于正常组,提示模型组大鼠HPA轴功能亢进。
作为边缘系统的重要构件,海马对情绪反应起抑制作用。GR在海马上表达最高,而海马正是通过GR抑制应激过程中亢进的HPA轴,使之恢复到基础水平。长期慢性应激刺激能够持续激活HPA轴,导致GC水平升高,过量GC极易造成富含GR的海马受损,从而减弱海马对HPA轴的抑制作用,进一步加重HPA轴的亢进〔5〕。动物实验发现抑郁症动物模型脑内的GR基因表达水平明显低于对照组〔6〕。GR mRNA表达下调、功能失敏,不能正常的负反馈抑制,从而使HPA轴的亢进得到长期维持。本实验结果显示,模型组大鼠海马GR mRNA的表达降低,与文献报道一致。脑源性神经营养因子(BDNF)与神经元的可塑性和存活有关,BDNF表达水平下降可能参与慢性应激抑郁症时海马结构和功能的改变〔7〕。本实验结果显示,模型组大鼠海马BDNF mRNA的表达降低,提示模型大鼠海马功能异常。
本实验采用选择性5-HT及NE再摄取抑制剂文拉法辛为西药对照,本研究结果显示西药组大鼠海马BDNF mRNA的表达较模型组上升,提示中枢系统5-HT及NE增高减少了海马损伤,而海马功能的维护抑制了HPA轴过度亢进,表现为西药组大鼠血浆CORT浓度较模型组大鼠显著下降,垂体重/体重及血浆ACTH浓度亦呈下降趋势。
多年临床应用表明甘麦大枣汤为基础配伍加味药治疗抑郁症疗效显著〔8〕。本研究结果显示中药组大鼠海马GR及BDNF mRNA表达较模型组升高,提示中药对海马有保护作用,从而抑制了HPA轴过度亢进,表现为中药组大鼠血浆CORT浓度较模型组大鼠显著下降,血浆ACTH浓度亦呈下降趋势。
1 Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic mild unpredictable stress and its restoration by a tricyclic antidepressant〔J〕.Psychopharmacology,1987;93(3):358-64.
2 Gronli J,Murison,Fiske E,et al.Effects of chronic mild stress on sexual behavior,locomotor activity and consumption of sucrose and saccharine solutions〔J〕.Physiol Behav,2005;84(4):571-7.
3 张学礼,金国琴,戴薇薇,等.甘麦大枣汤加味对抑郁症大鼠海马cAMP-蛋白激酶A途径的影响〔J〕.上海中医药大学学报,2006;20(4):73-5.
4 杨 权.下丘脑-垂体-肾上腺皮质轴应激反应的中枢控制〔J〕.生理科学进展,2000;31(3):222-6.
5 Hauger RL,Helat SG.Edei EE1 increased corticotrophin releasing factor receptor expression and adrenocorticotropic hormone responsiveness in anterior pituitary cells of Wistar-Kyotorats〔J〕.J Neuroendocrinol,2002;14(2):126-34.
6 Meyer U,van Kampen M,Isovich E,et al.Chronic psychosocial stress regulates the expression of both GR and MR mRNA in the hippocampal formation of tree shrews〔J〕.Hippocampus,2001;11(3):329-36.
7 Santarell IL,Saxe M,Gross C,et al.Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants〔J〕.Science,2003;301(5634):805-9.
8 袁灿兴.情志疾病心肝求甘麦大枣奇功收:胡建华运用加味甘麦大枣汤治疗神经精神疾病〔J〕.上海中医药杂志,1996;7(1):4-6.

