HBV在宫内传播途径的分子进化特点研究*
曾 毅,李 利,郭鑫武,邓国宏,李俊男,王 琳△
(第三军医大学西南医院:1.妇产科;2.传染病研究所,重庆400038)
乙型肝炎病毒(hepatitis B virus,HBV)感染是一个全球性的健康 问 题[1]。HBV表面抗原(HBV surface antigen,HBs Ag)阳性母亲的新生儿出生后立即接种乙型肝炎疫苗(Hepatitis B vaccine,HBVac)或联合应用乙型肝炎免疫球蛋白(hepatitis B immunoglobulin,HBIG)可有效阻断分娩过程感染和产后感染,但对已发生的宫内感染无阻断作用[2],通过这种途径感染的新生儿几乎终身携带病毒,是造成免疫失败的主要原因[3-5],20%~25%发展为肝硬化及肝癌,宫内感染的女性新生儿很有可能将来通过妊娠将病毒再传递给她们的下一代。HBV宫内传播的途径主要有胎盘途径、外周血单核细胞(peripheral blood monocytes,PBMCs)途径及经生殖细胞的传播。其中胎盘的渗漏和胎盘细胞的感染是主要的途径[6]。HBe Ag可以经过局部的胎盘渗漏通过胎盘[7],随着胎盘屏障的破坏,造成母亲血液进入胎儿的血液循环中,或者通过“细胞途径”促进感染经胎盘的传播[8]。母亲HBe Ag血清型阳性及高病毒载量为胎盘HBV感染明确的正相关因素[8]。本研究对HBV宫内传播的两对母子血清样本中的HBV病毒株序列建立进化关系类型,进行遗传进化分析,现将结果报道如下。
1 资料与方法
1.1 一般资料 选择2008年1月至2011年1月第三军医大学西南医院产科就诊的两对乙型肝炎母子无症状携带者。母亲均为重庆地区汉族人,年龄分别为24(M1,新生儿为N1)和25(M2,新生儿为N2)岁,孕前及孕期确诊为HBV感染(HBs Ag、HBe Ag、抗-HBc阳性),伴HBV病毒高载量(滴度均大于1×106log10 copies/mL),肝炎病毒A、C、D、E抗体阴性,生命体征及肝功能指标基本正常,均临床诊断为无症状的HBs Ag携带者,实验前均未接受乙型肝炎疫苗接种及抗病毒治疗。产后立即收集母亲的静脉血样及新生儿的股静脉血样,父母及其子女的血清样本-70℃超低温冰箱保存。两对乙型肝炎母子无症状携带者的临床资料见表1。入选标准:新生儿在出生24 h内、免疫接种前检测示HBs Ag及HBV-DNA双阳性,母亲是HBs Ag携带者,父亲非HBs Ag携带者,新生儿常规乙型肝炎疫苗预防接种及注射乙型肝炎免疫球蛋白后,产后1个月新生儿的血液样本中,HBs Ag及HBV-DNA双阳性[8]。
1.2 试剂 引物参照文献设计(上海生工生物工程公司合成),柱式液体样品总核酸抽提试剂盒(W7291)(上海华舜生物技术有限公司,中国),LATaqDNA聚合酶(Takara公司,日本),长片段TA克隆试剂盒(TOPO-XL-PCR Cloning kit)(Invitrogen公司,美国),E.Z.N.ATM质粒DNA小抽试剂盒(美国Omega公司),EcoRⅠ限制性内切酶(美国Promega公司)。

表1 两对乙型肝炎母子无症状携带者的临床资料
1.3 方法
1.3.1 血清DNA提取 采用上海华舜生物技术有限公司的柱式液体样品总核酸抽提试剂盒(W7291)提取。
1.3.2 母子HBV基因组全长序列的扩增、克隆、酶切鉴定和测序 对高病毒载量血清(>107log10 copies/mL)参考文献[9]HBV全序列基因组扩增所采用的引物及扩增方法。HBV基因组全长PCR引物为P1:5′-CCG GAA AGC TTG AGC TCT TCT TTT TCA CCT CTG CCT AAT CA-3′;P2:5′-CCG GAA AGC TTG AGC TCT TCA AAA AGT TGC ATG GTG CTG G-3′。PCR参数为预变性94℃5 min,94℃25 s、55℃30 s、72℃3 min 30 s(共35个循环),延伸72℃10 min。胶回收纯化目的基因,采用Invitrogen公司提供的TA Cloning®Kit-One-Step PCR Cloning试剂盒中的pCR®-2.1T载体快速连接5 min,重组载体转入感受态TOP10,致死基因ccdB及卡那霉素筛选阳性菌落。提取重组质粒,EcoRⅠ酶切鉴定,每个患者选33个酶切鉴定正确重组质粒的菌液,送华大生物工程公司测序,测序引物M13。
1.3 基因序列比对方法 各样本的HBV基因组全长序列为3.2 kb,采用CLUSTAL X1.83进行序列比对[10],用MEGA 5.05软件计算遗传距离[11],选择最佳替代模型,PAUP4.0 b 10和Treeview进行系统进化分析。用MEGA5.05软件建立3种数据库,第1种包括一个数据包,内有两对母子所有的45个序列,命名为MN;第2种包含2个数据包,每个数据包内为一对母子的序列,命名为M1N1、M2N2;第3种包含4个数据包,每个数据包内为单一的某一母亲或孩子的序列,命名为M1、N1、M2和N2。M1和M2的序列为C1型基因型,M2和N2的序列为B2基因型,选择标准序列B2型(AF100309)和C1型(X04615)分别作为外围序列进行比对。
采用MEGA5.05软件计算母子之间的遗传距离,根据贝叶斯标准计算的结果选择Kimura 2-parameter替代模型分析转换和易位。MN数据包的系统进化树用邻接法通过1 000次自展法重复计算建立。对第2种和第3种数据包运用最大似然法(maximumLikelihood method,ML)和最大简约法(maximum parsimony method,MP)进行系统进化分析。PAUP4.0 b 10建构ML和MP系统进化树。根据以上标准做进化树构建和分析的参数设置,构建进化树并进一步分析。
1.4 统计学处理 应用SPSS11.5软件进行统计学数据处理,计数资料比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 母子HBV L-PCR扩增及重组质粒酶切鉴定 血清DNA模板扩增出约3 200 bp的DNA片段,重组质粒经EcoRⅠ酶切,可产生3 200 bp及3 500 bp两个片段,均与预期目的基因大小相符合。见图1、2。
2.2 HBV病毒株的遗传进化 两对母子的遗传距离及遗传多态性见表3~4。
2.3 系统进化结果
2.3.1 对于所有45个病毒株 基于从2对母子中选择的3.2 kb的HBV病毒株基因组,MEGA5.05软件邻接法构建的进化树(图3)。在这个拓扑结构中,M1N1和M2N2之间没有重叠,分别聚集在一侧。M1和N1聚集后混杂分布,未形成单源群,也没形成各自的单源群;M2和N2非单一起源,虽然M2的大部分优势株聚为一枝,但少部分M2与N2聚集形成另1枝。

图1 HBV基因组全长序列PCR产物凝胶电泳图

图2 HBV L-PCR扩增及重组质粒酶切鉴定电泳图

图2 HBV 3.2 kb全长序列邻接法进化树
2.3.2 每对母子的HBV病毒株 图3A、3B为M1N1的ML、MP的进化树。M1和N1聚集后混杂分布,未形成总的单源群,也没形成各自的单源群,均没有明显的优势株,有一株新生儿的病毒株N1-01为除3条新生儿株(N1-02,N1-03,N1-04)外其余母子序列的起源。
图3C、3D为M2N2的ML、MP的进化树。大量M2的优势株聚集在一枝上,但N2却与小部分M2(M2-01,M2-02,M2-03)聚集在另一枝,两枝为姐妹群,N2可形成单源群,并有一个共同的起源M2-01和M2-03(2株的序列相同,视为同一病毒株)。
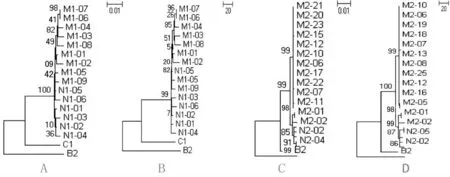
图3 M1N1、M2N2的进化树图
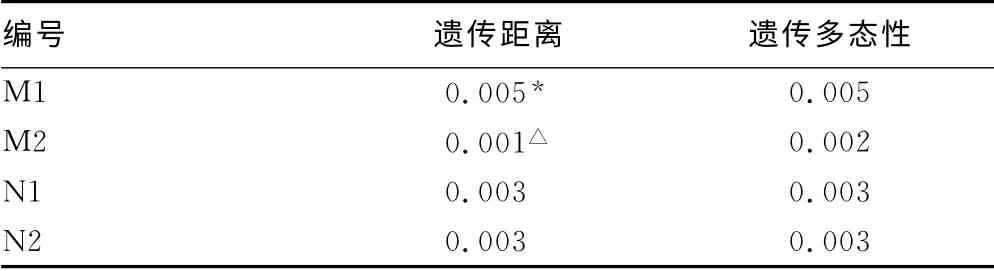
表3 M和N的遗传距离和遗传多态性

表4 每对母子的遗传距离和多样性
3 讨 论
HBV宫内传播的途径主要有胎盘途径、PBMCs途径及经生殖细胞的传播。其中胎盘的渗漏或胎盘细胞的感染是主要的途径[6]。通常认为胎盘渗漏是含有高浓度HBV的母血直接进入胎儿血循环中。这个过程中,母亲的病毒株不经受选择压力,新生儿的病毒与母亲的一致。通过宫内传播的细胞途径的新生儿感染是绒毛毛细血管内皮细胞感染的结果。在通过胎盘屏障的过程中,母亲的优势病毒株被过滤,只有那些更适应新环境的病毒株得以继续繁殖。在通过每层绒毛毛细血管巨大选择压力的作用下,许多母亲的病毒株为了适应新环境而发生突变,特别是感染发生在孕早期的病例,母子病毒株之间的遗传距离相应增大,N由M进化而来。若感染发生在妊娠晚期,M和N病毒之间的进化距离则相对缩短。
有研究根据8对发生HBV宫内感染的母子的HBV病毒株序列进行进化树分析,推测出4种可能的情况:第1种,母子的序列聚集为一枝,归因为局部胎盘渗漏;第2种,母亲和胎儿的病毒株分别聚集为2个独立的姐妹进化枝,母子病毒株之间的遗传距离相对较大,可用细胞途径加以解释;第3种,从拓扑结构看,母亲的病毒株是新生儿病毒株的起源,这种情况与传播的细胞途径相一致;第4种,母亲病毒株与一些新生儿的病毒株聚集为一枝,其余的新生儿病毒株聚集为另一单源群,可用联合传播途径加以解释[12]。
在本研究中,M2N2的进化模式符合第3种细胞途径进化模式,大量M2的优势株聚集在一枝上,但N2却与小部分M2(M2-01,M2-02,M2-03)聚集在另一枝,2枝为姐妹群,N2可形成单源群,并有一个共同的起源母亲病毒株M2-01和M2-03(2株的序列相同,视为同一病毒株)。在细胞途径中,胎盘屏障阻碍了大部分病毒株的通过,只有那些在层层选择压力下发生突变的病毒株适应了新环境后得以突破,从而感染胎儿,因此,大部分M2优势株聚集在一条进化枝上,为没能突破的株系,而少部分发生变异的病毒株通过细胞途径感染胎儿,并成为新生儿病毒株的起源,故N2为一单源群,N2的上游为少量的M2病毒株。
但在M1N1的序列进化树中,却发现了与上述4种模式不同的情况,M1和N1聚集后混杂分布,未形成总的单源群,也没形成各自的单源群,均没有明显的优势株,有一株新生儿的病毒株N1-01为除3条新生儿株(N1-02,N1-03,N1-04)外其余母子序列的起源。M1N1各序列间的遗传距离明显大于M2N2。可能原因是:在孕早期发生胎盘渗漏导致胎儿感染,但胎盘渗漏并不是一个持续的过程,可能通过修复得以终止,HBV病毒分别在胎儿和母亲两个相对独立的环境中演进。感染初期胎儿和母亲的HBV病毒株之间来源相同,序列无明显差异,为同一个基础。随着时间的推移,由于胎盘屏障的过滤和阻断功能,胎儿环境相对稳定,病毒株所经受的选择压力较小。而母亲在孕期可能面临来自内外环境的各种压力,病毒株变异速率加快,遗传距离的计算中,M1也明显比M2及N1要大,形成更多、遗传距离更远的变异株。
有研究报道,发生先兆流产和(或)早产,大部分宫内传播是因为母血中HBe Ag的胎盘渗漏[7,13]。有研究显示,HBV感染胎盘毛细管内皮细胞是宫内传播的一个主要危险因素。HBV经胎盘传播途径可能是胎盘的细胞与细胞之间的传递[14-15]。本研究结果显示,2组中M1N1通过胎盘渗漏传播的可能性大,M2N2则更有可能通过细胞途径传播。因为纳入研究的病例数目及每对母子准种数目的局限,系统进化树不能完全说明病毒株的进化过程,但从这些树中可以看出部分组间差异,并推测出可能的传播模式,并据此采取相应的预防措施及干预手段减少宫内传播的风险。
[1]Kao JH,Chen DS.Global control of hepatitis B virus infection[J].Lancet Infect Dis,2002,2(7):395-403.
[2]陈天艳,刘敏,陈云茹,等.HBV宫内传播的研究进展[J].世界华人消化杂志,2007,15(19):2138-2143.
[3]Liu SL,Dong Y,Zhang L,et al.Influence of HBV gene heterogeneity on the failure of immunization with HBV vaccines in eastern China[J].Arch Virol,2009,154(3):437-443.
[4]Shi Z,Li X,Yang Y,et al.Lamivudine in late pregnancy to interrupt in utero transmission of hepatitis B virus:a systematic review and meta-analysis[J].Obstet Gynecol,2010,116(1):147-159.
[5]Wang S,Han JQ,Hu DR.The advancement of intrauterine-transplacental transmission of hepatitis B virus[J].Chin J Gastroenterol Hepatol,2009,18(8):770-772.
[6]Xu DZ,Yan YP,Zou S,et al.Role of placental tissues in the intrauterine transmission of hepatitis B virus[J].Am J Obstet Gynecol,2001,185(4):981-987.
[7]Lin HH,Lee TY,Chen DS,et al.Transplacental leakage of HBeAg-positive maternal blood as the most likely route in causing intrauterine infection with hepatitis B virus[J].J Pediatr,1987,111(6 Pt 1):877-881.
[8]Xu DZ,Yan YP,Choi BC,et al.Risk factor and mechanism of intrauterine transmission of hepatitis B virus:a case-control study[J].J Med Virol,2002,67(1):20-26.
[9]Gunther S,Li BC,Miska S,et al.A novel method for efficient amplification of whole hepatitis B virus genomes permits rapid functional analysis and reveals deletion mutants in immunosuppressed patients[J].J Virol,1995,69(6):5437-5444.
[10]Thompson JD,Gibson TJ,Plewniak F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucl Acids Res,1997,25(24):4876-4882.
[11]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[12]HSun X,Tang B,Wang J,et al.A preliminary study on the molecular evolution of the two routes of intrauterine transmission of HBV[J].Arch Virol,2012,157(1):155-164.
[13]Lin HH.Perinatal transmission of hepatitis viruses:the possible mechanisms[J].Taiwan J Obstet Gynecol,2004,43(1):1-4.
[14]Xu DZ,Yan YP,Zou S,et al.Role of placental tissues in the intrauterine transmission of hepatitis B virus[J].Am J Obstet Gynecol,2001,185(4):981-987.
[15]Yue YF,Jiang H,Shi L,et al.Study on the mechanism of intrauterine infection of hepatitis B virus[J].Zhonghua Fu Chan Ke Za Zhi,2004,39(4):224-226.

