MALP-2对多形核中性细胞凋亡及其Bax蛋白表达的影响*
高 燕,叶迎春,袁 青,周云刚,黄 黎,刘佳佳△
(泸州医学院:1.免疫学教研室;2.病原生物与免疫学实验室,四川泸州646000)
多形核中性细胞(polymorphonuclear neutrophil,PMN,简称中性核细胞)来源于骨髓,属终末分化细胞,正常生命期限约为24~48 h,这就意味着PMN一旦分化成熟即启动其自发性凋亡[1]。现在已知有多种基因参与PMN自发性凋亡的调控,其中Bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用[2]。Bax是Bcl-2家族中促凋亡的重要成员之一。Toll样受体(toll-like receptor,TLR)是一类识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的模式识别受体,目前TLRs家族成员中人类有11种,鼠类13种[3]。TLR作为病原体的关键效应器,表达于PMN的表面或内部,在机体感染病原体后或与其相应的TLR激动剂结合后,均可导致PMN的活化,从而影响PMN自发性凋亡的发生速率,调控机体炎症反应的发生与发展进程。巨噬细胞活化脂肽(macrophage activating lipopeptide-2,MALP-2)是TLR2/TLR6的配体,对PMN功能具有直接效应,是作用于PMN的重要微生物结构识别体[4]。本研究运用TLR激动剂——MALP-2(TLR2/6的配体)刺激人PMN,观察它们对PMN凋亡和Bax蛋白表达水平的影响,探索TLR激动剂调节PMN凋亡过程中与相关的Bax蛋白表达水平关系。
1 材料与方法
1.1 材料 RPMI-1640培养液和胎牛血清购自Gibco公司,MALP-2细菌鞭毛蛋白(flagellin)购自Alexis公司,兔抗人Bax多抗(一抗)购自Thermo,羊抗兔IgG-HRP(二抗)购自Santa Cruz公司,内参3磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔多抗购自KPL公司,流式凋亡检测试剂盒购自Beckman公司。
1.2 方法
1.2.1 PMN的分离 抽取健康志愿者外周静脉血,经Ficoll密度梯度离心法分离后取PMN层,通过台盼蓝拒染实验及Wright-Giemsa染色法确保细胞活力和纯度均达96%以上方可使用。
1.2.2 细胞的培养 调整细胞浓度为2×106个/mL,分别将加入MALP-2 10 ng/mL作为实验组,加 入flagellin 100 ng/mL作为阳性对照组,未经处理的PMN作为阴性对照组,各组均设3个复孔。置37℃、湿度90%、5%CO2的孵箱中培养,按实验需要收获不同时间段细胞加以分析。
1.2.3 细胞凋亡率的检测 分别收获上述各组培养8 h PMN,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤;4℃,3%甲醛冰上固定30 min;PBS洗涤弃上清液,转入流式收集管中;加FITC-Annexin V 5μL和PI 2.5μL,混匀后避光冰浴10 min;加Binding buffer 500μL/管;流式细胞仪测细胞凋亡率,Cell Quest软件分析。
1.2.4 Western blotting分析 分别收获上述各组培养8 h的PMN,并提取其总蛋白。15μL总蛋白上样于12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,电转移至二氟化树脂(polyvinylidene fluoride,PVDF)膜,5%BSA封闭液室温封闭1 h。一抗(1∶1 000),4℃孵育过夜,二抗(1∶1 000)育膜60 min;1∶5 000辣根过氧化物酶(horseradish peroxidase,HRP)标记的GAPDH多克隆抗体(内参膜)育膜1 h。加入化学发光底物反应液5 min;于荧光化学发光图像分析仪中进行曝光,采用Quantity-one分析系统检测蛋白条带的平均密度值。
1.3 统计学处理 应用SPSS16.0统计软件进行数据分析,计量资料以±s表示,组间比较采用one-way ANOVA,检验水准为α=0.05。
2 结 果
2.1 新鲜分离PMN活性纯度鉴定 直接倒置光学显微镜下观察,细胞透明,有立体感和折光感,活性好(图1);Wright-Giemsa染色后可见细胞绝大多数为3~4叶核的PMN,纯度高(图2)。
图1 PMN(光镜×400)
图2 PMN(Wright-Giemsa染色×1 000)
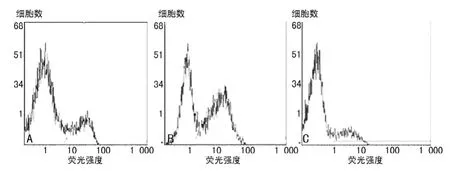
图3 流式细胞仪检测PMN凋亡率
2.2 流式细胞术检测PMN凋亡率 阴性对照组PMN自发性凋亡的发生率为22.61±3.31(图3A);阳性对照组PMN凋亡的发生率为53.78±7.00(图3B);实验组MALP-2凋亡的发生率为17.23±3.39(图3C)。3组凋亡率统计分析见表1。
2.3 Western blotting检测PMN Bax蛋白的表达 Western blotting检测PMN Bax蛋白的表达见图4。

图4 PMN Bax蛋白的表达(Western blotting)
3 讨 论
PMN除了自发性凋亡外,还存在多种外界因素(如激素、脂多糖、TNF-α)的作用下,发生凋亡的加速或延迟[5]。Fukata等[6]研究发现,PMN的激活、活化和趋化整个过程可受TLRs的调控。TLR信号可激活固有免疫、刺激抗原特异性免疫反应,并引发炎症反应;促进细胞膜表面表达相关免疫分子;促进免疫细胞的成熟和功能化;抗病毒感染;诱导氧化亚氮依赖性杀菌活性;介导全身免疫病理损伤及其家族间的协同作用影响免疫应答等。在人体内发现的TLR家族11个成员中,TLRl、TLR2、TLR4、TLR5和TLR6表达在细胞表面,专门识别细菌产物[7]。flagellin是TLR5的惟一配体,可特异识别结合TLR,介导全身炎症反应、氧化应激和器官损害[8-9]。而在所有TLRs中,TLR2识别的配体可能最多,包括肽聚糖、脂蛋白、支原体、HSP等,但在识别过程中需与TLR1或TLR6形成二聚体发挥作用。MALP-2是TLR2/TLR6的配体,在接触MALP-2后,PMN获得激活细胞状态,分泌IL-8和MIP-1β,吞噬能力增强,细胞表面CD62L表达下调。但MALP-2对休眠PMN的凋亡效应施加的只是一个短期影响,长期持久的效应发生在MALP-2跨膜转移后。用MALP-2处理后的PMN移动增强,也是由于动力效应而不是趋化作用。本研究应用流式细胞术检测了PMN凋亡率情况,结果显示实验组细胞凋亡率为17.23±3.39,与阴性对照组和阳性对照组比较细胞凋亡率明显下降,并且3组之间差异均具有统计学意义(P<0.05),说明MALP-2能明显延迟PMN凋亡的发生,延长PMN的生命期限。
Bax蛋白是1993年Oltvai等[10]从表达Bcl-2的人B细胞系RLT中鉴定分离出一种新型的蛋白质分子,它是Bcl-2家族中第一个被确认有细胞凋亡促进作用的成员。Bax蛋白可在线粒体膜上形成新的通道、改变原有的通道或者改变线粒体膜的脂质成分或分布,影响线粒体膜的通透性及线粒体膜对其他影响因子的反应性,进而引发细胞凋亡[11]。在PMN抗/促凋亡基因的平衡调节中,Bax和Bcl-2两种基因相互制约,形成细胞凋亡的正负调控。然而,Bcl-2蛋白质家族促凋亡和抗凋亡成员调控细胞凋亡作用的具体机制到目前还不清楚,它可能是一个非常复杂的相互作用的体系。随着对Bcl-2家族研究的深入,更多的与细胞凋亡相关的基因将会被发现,人们可以进一步地认识细胞编程死亡的本质及其调控机制。因此,对Bax及Bcl-2家族成员的深入了解有着非常重要的意义。本研究将MALP-2作用于PMN后,从蛋白水平运用Western blotting技术检测PMN Bax蛋白的表达是否影响。Western blotting检测结果显示,实验组和阴性对照组比较,MALP-2对PMN Bax蛋白的表达水平有下调作用,而且实验组和阳性对照组比较,Bax蛋白的表达差异有统计学意义(P<0.05),说明不同的TLR激动剂对Bax蛋白的表达可能表现出抑制作用或促进作用,这可能和TLR激动剂类型有关。因此,本研究的实验结果提示,在TLR激动剂诱发的PMN生胞凋亡或修复与再生的具体作用机制,将为脑创伤提供新的治疗靶点和手段。
[1]Cullen BR.Transcription and processing of human microRNA precursors[J].Mol Cell,2004,16(6):861-865.
[2]Doench JG,Sharp PA.Specificity of microRNA target selection in translational repression[J].Genes Dev,2004,18(5):504-511.
[3]Alvarez-Garcia I,Miska EA.MicroRNA functions in animal development and human disease[J].Development,2005,132(21):4653-4662.
[4]Taganov KD,Boldin MP,Chang KJ,et al.NF-κB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Nat Acad Sci,2006,103(33):12481-12486.
[5]洪军,崔建忠,高俊玲,等.海马区c-fos基因表达在大鼠脑创伤后认知功能障碍中的作用[J].中华创伤杂志,2009,26(11):988-991.
[6]Lu LF,Boldin MP,Chaudhry A,et al.Function of miR-146a in controlling Treg cell-mediated regulation of Th1 responses[J].Cell,2010,142(6):914-929.
[7]Bhaumik D,Scott GK,Schokrpur S,et al.Expression of microRNA-146 suppresses NF-κB activity with reduction of metastatic potential in breast cancer cells[J].Oncogene,2008,27(42):5643-5647.
[8]Nakasa T,Miyaki S,Okubo A,et al.Expression of microRNA-146 in rheumatoid arthritis synovial tissue[J].Arthritis Rheum,2008,58(5):1284-1292.
[9]Lukiw WJ,Zhao Y,Cui JG.An NF-κB-sensitive micro RNA-146a-mediated inflammatory circuit in Alzheimer disease and in stressed human brain cells[J].J Biol Chem,2008,283(46):31315-31322.
[10]Aronica E,Fluiter K,Lyer A,et al.Expression pattern of miR-146a,an inflammation-associated micro RNA,in experimental and human temporal lobe epilepsy[J].Eur J Neuro Sci,2010,1(6):1100-1107.
[11]Lin SL,Chiang A,Chang DY,et al.Loss of mir-146a function in hormone-refractory prostate cancer[J].RNA,2008,14(3):417-424.
[12]Kadhim HJ,Duchateau J,Sébire G.Cytokines and brain injury:invited review[J].J Intensive Care Med,2008,23(4):236-249.
[13]Culmsee C,Siewe J,Junker V,et al.Reciprocal inhibition of p53 and nuclear factor-κB transcriptional activities determines cell survival or death in neurons[J].J Neuro Sci,2003,23(24):8586-8595.
[14]Neubert M,Ridder DA,Bargiotas P,et al.Acute inhibition of TAK1 protects against neuronal death in cerebral ischemia[J].Cell Death Differ,2011,18(9):1521-1530.
[15]Kim HG,Hwang YP,Han EH,et al.Metallothionein-iii provides neuronal protection through activation of nuclear factor-κB via the Trk A/phosphatidylinositol-3 kinase/Akt signaling pathway[J].Toxicol Sci,2009,112(2):435-449.
[16]Imielski Y,Schwamborn JC,Lüningschrör P,et al.Regrowing the adult brain:NF-κB controls functional circuit formation and tissue homeostasis in the dentate gyrus[J].PLoS One,2012,7(2):30838.

