神经导航联合术中超声及唤醒在27例功能区胶质瘤手术中的应用
李海涛,师艺峰,熊海兵,石全红
(重庆医科大学附属第一医院神经外科 400016)
神经胶质瘤是最常见的颅内肿瘤,该肿瘤具有浸润性生长、边界欠清、容易复发等特征[1]。随着现代医学技术及手术方法的进步,神经胶质瘤的诊断已不再是问题,首选外科手术治疗。而功能区病灶的切除是手术难点,往往会让外科医生处于两难的位置,在避免功能区损伤的前提下,彻底切除肿瘤,实现肿瘤根治术是外科医生追求的目标。但由于传统手术不能完全分辨功能结构与病变的关系,极易在术中切除病灶时造成大脑功能损害[2-5]。这就需要术前的精确定位、术中的实时监控以及外科医生的经验。现将本院神经导航联合术中超声及唤醒在27例功能区神经胶质瘤手术中的应用情况报道如下。
1 资料与方法
1.1 一般资料 选择2008年1月至2011年5月本院收治的神经胶质瘤患者27例。其中,男15例,女12例;平均年龄44.5岁;均为首次治疗(未行术前化疗及放疗);中央前后回(4、3、1、2区)邻近病灶19例,颞上回、额下回及角回缘上回(42、22、44、45、39、40区)邻近病灶6例,枕叶视觉皮质区(17区)邻近病灶2例。病变均在左侧。患者均以轻度肢体运动障碍、感觉减退、轻度失语为主要表现,伴发癫痫7例,其中有颅内压增高表现者3例。1例为创伤后偶然检查发现,无临床症状。病理结果:低级别,WHO分级Ⅰ级2例,Ⅱ级14例;高级别,WHO分级Ⅲ级8例,Ⅳ级3例。
1.2 手术方法
1.2.1 术前准备 所有患者均行头颅CT或MRI检查明确病灶位置。使用美国TREON导航系统,患者术前1 d备皮,根据肿瘤部位于头皮不同扫描平面粘贴8枚marks坐标,行T1、T2、Flair、DTI等序列扫描,静脉推注造影剂强化行导航序列影像采集,将获得的影像资料存储于导航系统工作站,重建三维图像,标定病灶,在任意平面均可计算出操作位置与病变之间的距离和方位,以此设计出最佳手术路线。
1.2.2 手术方法 丙泊酚10 mg/mL(靶控输注血浆浓度3 μg/mL),瑞芬太尼50μg/mL(靶控输注效应室浓度4~6 ng/mL)以及维库溴铵0.1 mg/kg静脉滴注诱导麻醉。麻醉成功后,摆好患者体位,以Mayfield三钉头架固定,通过导航探针将标记点与影像资料所提示标记点进行准确注册,尽量减小平均注册误差,通过导航确定的病灶体表投影,结合人体解剖结构设计皮肤切口及骨瓣,规划出最佳手术路线。暴露硬膜后,引入美国GE公司Logiq P5彩色多普勒超声诊断仪,8C型小凸弧形探头,频率8~10 MHz。将探头涂以耦合剂后于硬膜表面,紧贴硬膜,持续扫描,明确病灶位置。剪开硬膜后,沿设计的最佳路线,寻找肿瘤,在此过程中再次引入术中超声,明确肿瘤与周围脑组织的分界及肿瘤周围的血流分布。此时将患者唤醒,约10 min后,患者清醒。使用直接电刺激定位病灶附近功能区。在感觉运动区电刺激到达一定强度时,患者会出现相关反应,如烧灼、麻木感,面部、手指、喉、腕部及小腿等部位的不自主运动。刺激强度在2~8 m A之间。在患者清醒状态下,通过数数、识物、遵嘱活动等确定功能区边界。术中顺利确定患者功能区25例,2例未检测到语言中枢。确定患者病灶与正常脑组织及功能区边界后,引入手术显微镜,在镜下切除肿瘤,当外科医生判定肿瘤完全切除后,取出吸收性明胶海绵、棉片、血凝块等,并用生理盐水反复冲洗,再次引入术中超声进行扫描,扫描过程探头应注意与脑组织表面保持垂直。不同恶性程度的肿瘤组织在超声下可呈不同表现。根据超声图像,再次指导外科医生进行病灶切除,整个过程由超声专业医生完成。根据Woydt等[6]研究结果,残腔见实性回声团为阳性,未见异常回声团为阴性,尽量实现病灶完整切除。
1.3 术后治疗 术后给予神经胶质瘤患者常规治疗,如脱水降颅内压、预防感染、营养神经等处理,给予丙戊酸钠预防癫痫,并在术后1周内复查头颅CT或MRI了解病灶切除情况。
2 结 果
肿瘤全切22例,大部分切除5例。术中唤醒成功定位功能区25例,2例为阴性,定位准确率达100%。术中超声的应用对于判断肿瘤的边界,低级别神经胶质瘤效果显著,避免了手术对功能区脑组织的误伤,减少了术后并发症。术后仅2例出现感觉性失语,5例单侧肢体肌力降低,无1例出现术后出血﹑视力视野障碍﹑颅内感染﹑意识障碍﹑死亡及二次手术。
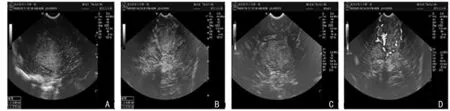
图1 超声血流信号
3 讨 论
随着现代医学的不断发展,手术切除肿瘤仍是神经胶质瘤的治疗首选方案,肿瘤的切除程度与患者的生存期密切相关[7]。对于邻近功能区肿瘤手术治疗,神经外科医生处于一个两难的境地,即在保证肿瘤完整切除与保护患者神经功能之间的矛盾。因神经胶质瘤的浸润生长的特点,使肿瘤的边界与正常脑组织常模糊不清,单单依靠外科医生的经验不能实现对肿瘤的精确切除。为了解决这一难题,越来越多的新技术的应用,如神经导航﹑术中超声﹑术中磁共振﹑神经电生理监测﹑术中唤醒等使外科手术医生能更好地处理此类病例。但术中磁共振由于其操作复杂﹑费用较高,限制了其普及程度。而神经导航与术中超声、术中唤醒的联合应用,实现了对病灶、正常脑组织、功能区三者的精确界定,术前神经导航精确定位避免了骨瓣过大,协助外科医生快速找到病灶,术中超声准确判断出病灶与正常脑组织的分界,而术中唤醒明确了病灶与功能区组织的关系,是目前确认功能区惟一的术中实时监测手段,是现代神经外科的重要组成部分[8-9],避免了外科医生完全从解剖结构上判断功能区组织,因为个体差异及病灶对脑组织的推移,势必会造成脑功能区的改变。本研究证实了这一观点。有研究发现,肿瘤推移作用可使功能区移动(20±13)mm。Haglund等[10]证明边缘离最近功能区的距离是决定预后的最重要因素。本研究将操作的距离控制在功能区1 cm的相对安全位置[11-12],结合以往经验,神经导航与术中超声也存在其不足之处。由于在术中脑脊液的丢失,脑组织的移位,脱水剂的使用等影响定位精确性,使神经导航“漂移”现象不可避免[13],不能实现真正意义上的实时导航。而术中超声的出现,正好弥补了这一缺陷,在去除骨瓣后,外科医生采取脑沟入路,潜行暴露病灶并加以切除,此过程中引入超声辅助定位,并将患者唤醒,定位功能区,指导病灶切除,使皮层损伤程度降到最小,保留功能区不受损害。本研究在超声监控下,可清楚地发现病灶,低级别与高级别的神经胶质瘤在超声下有各自不同的表现。由于术中超声的广泛应用,其对于病灶的术中定位及切除范围的指导,已得到广泛认可[14]。但本研究对于功能区的肿瘤,在超声图下结合外科医生的经验可初步判断出肿瘤的恶性程度,是否可根据其恶性程度及患者本身的情况(如年龄、症状、对手术的期望值等),在功能保护与病灶切除程度之间进行选择,在低级别神经胶质瘤中,尽量实现全切,减小肿瘤复发率,而对于高级别神经胶质瘤,则择重于功能区的保护,提高患者的生存质量。在不同情况下选择切除范围方面目前未见相关文献报道。本研究27例患者中,通过神经导航与术中超声及唤醒的应用,对于功能区肿瘤,实现病灶全切22例,大部分切除5例,其中4例病灶均位于中央前回重要功能区,且超声影像显示周围水肿明显,伴液化坏死,血流信号丰富,提示肿瘤恶性程度较高,当切除病灶边缘时,虽提示病灶尚未完全切除,但为保护患者术后功能及生存质量,均停止继续清扫肿瘤。另1例由于病灶与语言区边界欠清,术中电刺激未定位到患者语言功能区,为避免损伤,未完全切除。对于术中2例未成功定位功能区边界的病例,分析可能有以下几点原因:(1)患者优势半球在右侧;(2)手术骨瓣过小,不能完全暴露患者功能区;(3)术中由于麻醉的作用,未能保证患者的意识在Ⅰ级意识,未能取得期望的效果。在重要功能区的神经胶质瘤手术中,神经导航用于术前定位,使术者能快速准确找到病灶,术中超声所体现的价值主要表现在参与肿瘤边界以及残余肿瘤的判定,而术中唤醒的重要性体现在辨别肿瘤与功能区皮层的分界,二者在术中均指导手术,提示外科医生何时停止手术。
总之,对于邻近重要功能区的神经胶质瘤手术,通过神经导航术前精确定位,设计出最佳手术路线,避免大骨瓣开颅,缩小暴露范围[15],并辅以术中超声及唤醒,清楚地界定出病灶与正常组织及脑功能区。实时监控手术过程,提示外科医生是否完整切除肿瘤,何时停止手术。导航与超声及唤醒的结合大大提高了手术的精度,使手术更加顺利地进行,更好地保护了患者的功能。
[1]FisherJ L,SchwartzbaumJ A,Wrensch M,et al.Epidemiology of brain tumors[J].Neurol Clin,2007,25(4):867-890.
[2]Nabavi A,Blomer U,Mehdorn HM.Clincal aspects of gliomas[J].Med Laser Appl,2002,17(2):91-104.
[3]Gil-Robles S,Duffau H.Surgical management of World Health Organization GradeⅡgliomas in eloquent areas:the necessity of preserving a margin around functional structures[J].Neurosurg Focus,2010,28(2):8.
[4]Kim SS,McCutcheon IE,Suki D,et al.Awake craniotomy for brain tumors near eloquent cortex:correlation of intrao-perative cortical mapping with neurologic outcomes in 309 consecutive patients[J].Neurosurgery,2009,64(5):836-845.
[5]Sanai N,Mirzadeh Z,Berger MS.Functional outcome after language mapping for gliomas resection[J].N Engl J Med,2008,358(1):18-27.
[6]Woydt M,Krone A,Becker G,et al.Correlation of intraoperative ultrasound with histopathologic findings after tumour resection in supratentorial glimas.Amethod to improve gross total tumour resection[J].Acta Neurochir(Wien),1996,138(12):1391-1398.
[7]Keles GE,Chang EF,Lamborn KR,et al.Volumetric extent of resection and residual contrast enhancement on initial surgery as predictors of outcome in adult patients with hemispheric anaplastic astrocytoma[J].J Neurosurg,2006,105(1):34-40.
[8]江涛,陈新忠,谢坚.功能区胶质瘤的术中直接电刺激判断核心手术技术[J].中国微侵袭神经外科杂志,2005,10(4):148-150.
[9]王永志,白红民,江涛,等.双语脑语言转换和语言代表区的术中直接电刺激研究(附2例分析)[J].中国微侵袭神经外科杂志,2009,14(1):6-9.
[10]Haglund MM,Berger M,shamseldin M,et al.Cortical localization of temporal lobe language sites in patients with gliomas[J].Neurosurgery,1994,34(4):567-576.
[11]王伟民,白红民,李天栋,等.脑功能区胶质瘤手术中的新技术[J].中华神经外科杂志,2007,23(6):428-431.
[12]白红民,王伟民,李天栋,等.术中直接电刺激在功能区病变手术中的应用(附86例分析)[J].中国微侵袭神经外科杂志,2009,14(7):289-291.
[13]West JB,Fitzpatick JK,Tomas SA,et al.Fiducial point placement and the accuracy point-based,rigid body registration[J].Neurosurgery,2001,48(4):810-817.
[14]Evans SM,Laughlin KM,Pugh CR,et al.Use of power Doppler ultrasound-guided biopsies to locate regions of tumor hypoxia[J].Br J Cancer,1997,76(10):1308-1314.
[15]吴劲松,毛颖,姚成军,等.术中磁共振影像神经导航治疗脑胶质瘤的临床初步应用(附61例分析)[J].中国侵袭神经外科杂志,2007,15(3):12-16.

