齐墩果酸对食管癌细胞Eca-109的增殖抑制作用
丁玉松,马儒林,杨明,杨倩,张建明,张燕敏
(石河子大学医学院预防医学系,石河子832000)
食管癌(esophageal carcinoma)是我国最常见的恶性肿瘤之一,其中绝大多数是鳞状上皮癌(95%),食管腺癌甚为少见。当前食管癌的基本治疗策略是手术和放疗、化疗相结合的综合治疗方案。由于食管癌发病较为隐匿,确诊时已多属于中晚期,病灶的扩散和转移使病人失去手术治疗和局部放疗的机会,故化疗已成为延长生存期,改善生活质量的重要手段。但患者在接受抗肿瘤化疗过程中,正常组织细胞也遭受严重损害。人们期望能找到一种既能抗肿瘤,又不过多损害整体健康的内科治疗方法。植物化学物由于其低毒,价廉,副作用少,能减少化疗副作用等,已经越来越多的受到国内外医学界的重视。
OA,又名庆四素,五环三萜类化合物,广泛存在于女贞子、葡萄、白花蛇舌草、夏枯草、大枣、牛膝、西洋参、连翘、山芝麻、甘草等植物中[1]。OA具有多种生物活性,有护肝、解肝毒、降糖、降脂、治疗胃溃疡、抗炎、抗HIV病毒、利尿、抗突变、抗氧化、抗癌等作用[2]。已证实OA对人肺癌、乳腺癌细胞等均具有抑制肿瘤生长的作用。不同肿瘤细胞对不同药物的敏感性差异很大,且国内外尚未见有关OA作用于食管癌Eca-109细胞的相关实验研究报道。
本实验采用不同浓度的OA分别作用于,Eca-109细胞24、48和72 h,观察其对Eca-109细胞株增殖的影响,为食管癌筛选毒副作用小、抗肿瘤活性强的化疗药物提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株
人食管癌Eca-109细胞株,购自中国科学院上海生命科学研究院细胞库。
1.1.2药品及主要试剂
OA(购自西安开来生物工程有限公司,纯度98%);DMEM培养基(GIBCO公司);小牛血清(杭州四季青生物制品公司);MTT和二甲基亚飒(DMSO)(北京索莱宝科技有限公司);胰蛋白酶(Amresco公司)。
1.1.3主要仪器
CO2培养箱(Thermo Scientific公司);离心机(上海安亭 TDL-40B);自动酶标仪(M-K3型酶标仪);倒置显微镜(MOTIC公司101 mol/L );96孔细胞培养板(Corning公司);高压锅;水浴震荡器;烘箱;分析天平。
1.2 方法
1.2.1实验设计
采用成组设计,分别研究不同浓度OA(5、20、40、80、160、320μg/m L)对食管癌 Eca-109细胞在加药后24、48和72 h的抑制作用。
1.2.2样品溶液的配置
精密称取 OA 0.06 g,用7.5 m LDMSO溶解,轻轻晃动2 min,使OA完全溶解,配制成8 mg/m L的贮备液,分装后低温保存。临用时取400μL贮备液加入9.6 m L的培养液,使其混匀,制成320μg/m L的OA溶液。取320μg/m L的OA溶液5 m L,用培养液稀释两倍得160μg/m L的OA溶液。依次倍比稀释获得80、40、20、10、5μg/m L的 OA 溶液。
1.2.3 MTT试验
将Eca-109细胞接种于50 cm2细胞培养瓶中,加入10%胎牛血清的DMEM在37℃,5%CO2培养箱中常规培养,每2 d换液1次,3~4 d传代取对数生长期的Eca-109细胞经0.25%的胰蛋白酶消化,制成单细胞悬液,再用新鲜培养液稀释成细胞悬液,调整细胞浓度为1×106/m L。
将培养板周边每孔内加100μL PBS防止边缘效应,余下的每孔加100μL培养液。将上述细胞悬液分9组分别接种于96孔培养板中,并设置阴性对照组(加0.5%DMSO,不加OA),每组设6个复孔,每孔细胞数目约7×103个,共接种3个培养板,放入CO2培养箱中培养。待细胞贴壁后吸去培养液,随机选7组分别加入含 OA 5、10、20、40、80、160、320μg/m L的培养液200μL,另外两组分别为空白组和阴性对照组。各组分别培养24、48、72 h。培养结束前4 h每孔加入20μLMTT。37℃继续孵育4 h,小心吸去上清液,每孔加入100μLDMSO终止反应,于震荡器上避光震荡10 min,使Formazan颗粒充分溶解。上自动酶标仪测定各孔在波长490 nm处的光密度值(OD值)。以后每隔24 h取出一块96孔板重复以上的操作。
根据OD值计算细胞抑制率,计算公式为:

1.3 统计学处理
2 结果
2.1 不同浓度OA作用对Eca109细胞增殖的影响
OA作用24、48、72 h候对Eca-109细胞增殖的抑制率与对照组比较OA处理组在较低浓度(5、10、20μg/m L)下均未发现对食管癌 Eca-109细胞有增殖抑制作用,但在较高浓度(40、80、160、320μg/m L)下,均对食管癌Eca-109细胞表现出增殖抑制作用,有统计学意义(P<0.05)(表1)。

表1 不同浓度OA作用24、48、72 h候对Eca-109细胞增殖的影响Tab.1 Effect of OA on Eca-109 cell proliferation in different concentration for 24、48 and 72 hours
2.2 OA作用24、48和72 h的重复测量方差分析结果
2.2.1球形检验和剂量主效应方差分析结果
经Mauchly球形检验,本实验数据满足球形假设(P>0.05),不需要进行校正。进一步比较分析OA不同剂量组药物后发现,剂量因素为主效应时,不同剂量组OA对食管癌细胞株Eca-109的抑制影响差异存在统计学意义(F=133.230,P<0.001),除剂量为40μg/m L的实验组与对照组比较时差异无统计学意义(P>0.05),其余实验组与对照组比较差异均存在显著性(P<0.05)。证实OA对食管癌Eca-109细胞的增殖有一定的抑制作用。
2.2.2时间因素主效应和时间因素与剂量分组因素交互效应方差分析结果
以时间因素为主效应时,3个不同时点间差异有统计学意义(F=23.481,P<0.001);时间与药物剂量分组存在交互作用(F=4.776,P<0.001);实验药物对食管癌Eca-109细胞的时间、浓度交互作用影响如图1所示。多重比较时,24 h观察点与48 h观察点差异无显著性,其余各时间点差异均有显著性(P<0.01)。
由时间、浓度交互效应轮廓图(图1)可知:时间为48 h,剂量为160μg/mL是时间—剂量最优组合,此时达到对食管癌Eca-109细胞最大抑制作用。
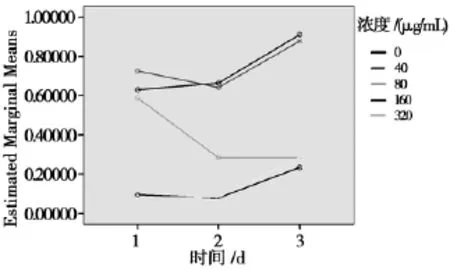
图1 时间和浓度交互效应轮廓图Fig.1 The combinell effects and interaction for time and corcentration
2.3 OA对人食管癌Eca-109细胞的形态影响
在显微镜下观察,OA作用于人食管癌Eca-109细胞24、48、72 h后的形态见图2~4。
图2~4显示:正常情况下食管癌Eca-109细胞生长良好,形状不规则,呈梭形或多角形,并可融合形成集落,生长有巢状现象(图2a、3a、4a所示)。高浓度用药组的细胞生长明显被抑制,OA作用于人食管癌Eca-109细胞后可见细胞形态变化明显,悬浮细胞增多,细胞浆混浊,细胞胞体缩小、变圆、皱缩、核固缩、碎裂,细胞折光性减弱,细胞内出现颗粒样物质,培养液中有较多的细胞碎片。

图2 不同浓度OA处理24 h后Eca-109细胞形态变化Fig.2 Eca-109 cells morphological changes in different concentrations of OA treatment 24 hours after

图3 不同浓度OA处理48 h后Eca-109细胞形态变化Fig.3 Eca-109 cells morphological changes in different concentrations of OA treatment 48 hours after

图4 不同浓度OA处理72 h后Eca-109细胞形态变化Fig.4 Eca-109 cells morphological changes in different concentrations of OA treatment 72 hours after
3 讨论
目前OA抗肿瘤机制还不十分清楚,有研究者认为可能与以下几个方面有关:(1)抗肿瘤增殖、侵袭、浸润、转移和新生血管形成的作用;(2)诱导肿瘤细胞凋亡;(3)逆转肿瘤多耐药性;(4)增强机体免疫力;(5)保护肝损伤;(6)减轻化疗药物引起的肝损伤等多种生物学活性[3]。目前OA对食管癌Eca-109细胞抑制活性研究报道较少见,其对食管癌Eca-109细胞是否具有抗肿瘤活性尚未见报道。
本实验采用MTT测定OA对食管癌Eca-109细胞的抑制作用,该方法具有简便、快速、灵敏、重复性高、无放射污染、有较好的临床符合性等优点[4],成为目前最常用的体外肿瘤药敏试验方法。
本实验所选用的人食管癌Eca-109细胞是最早建立的食管癌细胞株,经长期传代仍能保持食管癌的特性,故以人食管癌Eca-109细胞为靶细胞研究齐墩果酸的抗食管癌作用具有较好的代表性。
通过对实验中OD值和公式计算抑制率的结果比较来观察OA对食管癌Eca-109细胞的抑制作用。实验结果表明:OA处理组与对照组比较,在较低浓度下均未发现对食管癌Eca-109细胞有增殖抑制作用,这与李鸿梅等在齐墩果酸对顺铂耐药胃癌SGC-7901细胞增殖的影响及其机制研究中结论相似,即OA在较低浓度下对胃癌SGC-7901细胞未表现出抑制作用[5]。相同时间不同浓度组之间(除外40μg/m L浓度组)的OD值差异均具有显著性(P<0.001),相同浓度不同时间组之间(除外24 h观察点与48 h观察点)OD值差异也有显著性(P<0.001);不同浓度的OA对食管癌Eca-109细胞具有正相关性抑制性,OA分别处理食管癌Eca-109细胞24、48、72 h在40~160μg/mL呈明显的剂量-效应关系。OA在80μg/mL时处理24、48、72 h时呈明显的时间——效应关系。总体趋势是OA对食管癌Eca-109细胞的增殖有抑制作用,其最高抑制率在160μg/m L作用48 h可达87.9%。通过显微镜可以观察到,正常情况下食管癌Eca-109细胞生长良好,形状不规则,呈梭形或多角形,并可融合形成集落,生长有巢状现象。高浓度用药组的细胞生长明显被抑制,OA作用于人食管癌Eca-109细胞后可见细胞形态变化明显,悬浮细胞增多,细胞浆混浊,细胞胞体缩小、变圆、皱缩、核固缩、碎裂,细胞折光性减弱,细胞内出现颗粒样物质,培养液中有较多的细胞碎片。如(图2~4 c、d)。综上所述,OA对食管癌Eca-109细胞具有一定的抑制作用。OA有可能成为治疗食管癌的良好药物,但还需要实验室结果和临床应用的支持和深一步研究。
[1]Mc Laughlin F,Finn P,La Thangue N B.The cell cycle,chromatin and cancer:mechanism-based therapeutics come of age[J].Drug Discov Today,2003,(8):793-802.
[2]Jaime A,Rodrlguez Luis A,Guillermo S H.Oleanolic acid promotes healing of acetic acid-induced chronic gastric lesions in rat[J].Pharmaco.Res,2003,48(3):291-294.
[3]汤华成,赵蕾,张鹏霞,等.OA对K562细胞系VEGF表达影响的实验研究[J].中国老年医学杂志,2007,(24):2371-2373.
[4]Henrik Mueller,Matthias U Kassack,Michael Wiese.Comparison of the usefulness of the MTT,ATP,and calcein assays to predict the potency of cytotoxic agents in various hum an cancer cell lines[J].J Biomol Screen,2004,9:506-515.
[5]李鸿梅,李雪岩,蔡德富,等.齐墩果酸对顺铂耐药胃癌SGC-7901细胞增殖的影响及其机制研究[J].中国药理学通报,2009,25(10):1334-1337.

