洋葱总黄酮的大孔吸附树脂纯化工艺
王国军,唐辉,王幻,王鲁石
(石河子大学药学院/新疆特种植物药资源重点实验室,石河子832002)
洋葱(Allium Cepa L.)又名玉葱,球葱,葱头,圆葱等,是百合科葱属;味甘微辛,性温,有平肝、润肺、健胃、解毒、杀虫的功效。洋葱含挥发油、硫化物、类黄酮、甾体皂苷类和前列腺素类等化学成分,有多种药用价值[1]。洋葱与其他葱属植物相比含有更为丰富的黄酮类化合物。不仅如此,在62种常见蔬菜水果中,总黄酮含量也居于首位[2],这一药食两用的突出特点不容忽视。
黄酮类化合物的作用已被广泛证实,国内外文献报道[3],不同品种、产地的洋葱中总黄酮含量在50 mg/kg到1300 mg/kg之间。洋葱中的黄酮类成分以槲皮素-3,4'-二葡萄糖苷和槲皮素-4'-葡萄糖苷为主,占到了洋葱总黄酮含量的85%,槲皮素苷的总含量占到了洋葱总黄酮的93%。鉴于其中黄酮成分类别较为单纯,故对于定量洋葱中的总黄酮,用分光光度法测定相对于其他多种分析方法(如HPLC法)更为有效、简便[4]。在提取天然植物中的有效成分时应选择成本低、提取率高、安全性高和无污染的方法。
前期有学者对洋葱总黄酮的成分进行了研究[5],本实验重点考察制定提取纯化方案。采用应用较为广泛的大孔树脂法对黄酮进行纯化,大孔树脂具有机械稳定性高、吸附选择性好、再生简便、节省费用等优点[6]。但是黄酮类化合物结构复杂、极性各不相同,因此对于洋葱黄酮的分离纯化需要摸索其适合的树脂和工艺条件,并进一步为工业化生产在节约成本、提高安全性方面提供方法和依据。
1 材料与方法
1.1 材料
UV-2401紫外分光光度计(日本岛津公司),小型打浆机(广东南海钜华电器有限公司),SB-2000型水浴锅(上海爱郎仪器有限公司),电子分析天平(德国赛多利斯)。
80目烘干洋葱粉(甘肃张掖市福联蔬菜脱水厂);槲皮素对照品(中国生物制品检定所,批号:10081-200406);AB-8和 D-101型树脂均为南开大学化工厂,其它试剂均为分析醇。
1.2 方法
1.2.1洋葱总黄酮的测定
取洋葱粉100 g加入80%乙醇1000 m L,超声10 min,过滤,再以等量溶剂重复超声提取一遍,滤液合并定容至2000 m L,作为洋葱总黄酮粗提液[7]。利用芦丁作为对照品,以2%AlCl3为显色剂,显色5min后在200~800 nm下进行全波段扫描,确定最大吸收波长为414 nm,选定此波长为测定波长。其线性方程为:A=0.0375c+0.0068,R=0.9999,线性范围:8.1~18.6μg/m L。日内精密度 RSD为0.85%(n=6);重复性考察得到RSD 为1.9%;平均回收率为102.7%。该测定方法准确可靠,洋葱粗提液中总黄酮含量为1.14 mg/m L(n=3,RSD为1.1%),纯度为46.5%,收率是72.1%。
1.2.2树脂的预处理
树脂的预处理分两步,即水合和除去杂质。水合就是把脱水的吸附树脂放在水溶性溶剂(如乙醇、丙酮等)中充分浸泡24 h,以便从孔中赶出气泡,然后用乙醇充分洗涤,直至洗出液与水混合无白色浑浊,最后用去离子水将乙醇洗净。分别用质量分数为5%的HCl和NaOH溶液分别浸泡3 h以除去杂质,最后用去离子水洗至中性。
1.2.3吸附量、吸附率和解吸率的测定
选择适当的乙醇溶液,对吸附了洋葱总黄酮的树脂进行解吸附,按公式计算解吸率。吸附量Qe、吸附率E和解吸率D 的计算公式
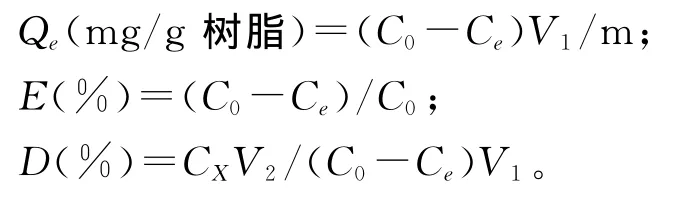
其中:Q,n,a为常数;Qe为吸附量;C0为初始浓度;Ce为平衡浓度;V1为加入样品液体积;m为树脂干重;E为吸附率;D为解吸率;CX为洗脱液浓度;V2为洗脱液体积。
1.2.4静态吸附实验
分别称取预处理好的2种大孔吸附树脂10 g(通过含水率换算的干重),置于150 m L具塞锥形瓶中,分别加入50 m L样品溶液,室温下,定时取样进行分析,并按公式计算洋葱总黄酮的吸附量和吸附率。
1.2.5动态吸附实验
在室温下,样品液以一定的流速通过装有树脂的φ2.0×30 cm的玻璃层析柱,测定流出液中洋葱总黄酮的浓度,考察样品液流速对树脂吸附性能的影响,绘制树脂的泄漏曲线,确定最佳的吸附工艺条件。对已吸附样品的树脂进行解吸附实验,考察洗脱剂浓度、流速等对树脂解吸附性能的影响,绘制解吸附曲线,确定最佳的解吸附工艺条件。
2 结果与分析
2.1 静态吸附实验
2.1.1优选合适的吸附树脂
静态吸附实验结果见表1。
由表1可知:2种型号树脂吸附率和解吸率均较好,AB-8型优于D-101型树脂。
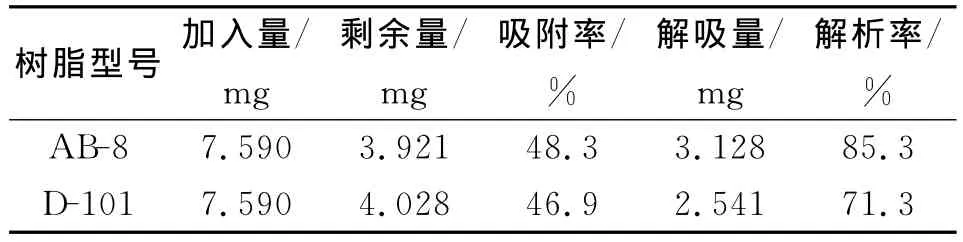
表1 两种树脂对洋葱总黄酮的吸附率和解吸附率Tab.1 Adsorption rate of total flavones in onion and desorption rate by 80%ethanol
2.1.2静态吸附动力学特征
准确称取预处理好的AB-8型树脂1.0 g,于50 m L具塞容量瓶中,精确加入一定浓度的供试液,置于恒温振荡器中震荡,每隔一定时间取上清液,进行测定,绘制AB-8树脂静态吸附曲线,结果见图1。
由图1可知:在2 h内基本达到平衡。
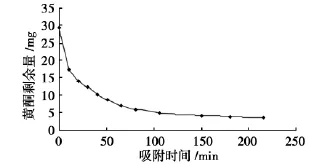
图1 AB-8型树脂的静态吸附曲线Fig.1 Static-adsorption dynamic curve of AB-8 resin
2.1.3静态解吸附动力学特征
将吸附饱和的树脂经水洗后移入具塞锥形瓶中,加入80%的乙醇,置于横纹振荡器中解吸附,每隔一定时间取解吸液进行测定,绘制AB-8树脂解吸附曲线,结果见图2。
由图2可知:在20 min左右基本达到解吸附平衡。

图2 AB-8型树脂的静态解吸曲线Fig.2 Static-desorption dynamic curve of AB-8 resin
2.1.4上样液浓度对吸附量的影响
准确称取5份预处理好的AB-8型树脂1.0 g,于50 m L具塞容量瓶中,取5 m L供试品液以水稀释成不同浓度后加入容量瓶中,置于恒温振荡器中震荡2 h后,取上清液进行测定,计算吸附量,结果见图3。
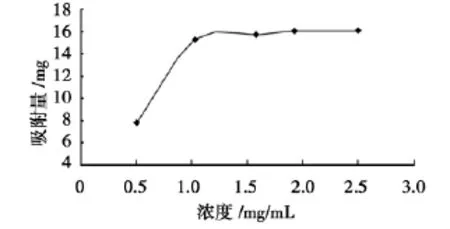
图3 吸附液浓度对吸附量的影响Fig.3 Effect of concentration on adsorption
由图3得知:上样浓度较低时,随浓度的增加吸附率增加。这主要是因为分子越密集,与树脂碰撞的几率越大,吸附量就越大。但是上样浓度过低时,树脂吸附平衡后仍有相当大一部分树脂未达到吸附饱和,树脂使用率较低。若上样浓度过高时,吸附率不再上升,并容易发生絮凝和沉淀,堵塞树脂柱。故确定上样浓度为1~2 mg/m L时达到该树脂的最佳吸附效果。
2.1.5 pH值对树脂吸附性能的影响
准确称取5份预处理好的AB-8型树脂1.0 g,分别加入用0.5%HCl和NaOH溶液调至p H值为2、3、4、5、6的供试液,震荡吸附2 h后,取上清液进行测定,结果见图4。
由图4可见:当p H值低于5时吸附效果好,随着供试液p H值的升高,吸附效果下降,说明洋葱总黄酮在酸性条件下容易被吸附。供试液p H值在2~5之间时树脂的吸附性能较好。但p H值过低时,可能会导致黄酮苷的水解。供试液p H值为4,因此选择在供试品液本身p H值下进行后续实验。
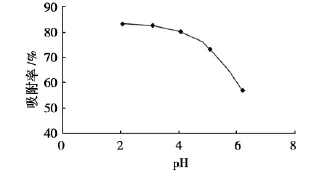
图4 pH值对吸附性能的影响Fig.4 Effect of pH value on adsorption
2.1.6洗脱溶剂浓度的确定
准确称取6份预处理好的AB-8型树脂1.0 g,用一定浓度的供试品溶液使之吸附平衡后,分别用40%、50%、60%、70%、80%、90%的乙醇,置于恒温振荡器上解吸附2 h,取上清液进行测定,结果见图5。
由图5可见:洗脱剂乙醇浓度低时,洗脱效果较差,随着乙醇浓度的增加,洗脱力增加,当乙醇浓度达到60%后,洗脱率增幅极小。考虑到成本,确定60%乙醇为洗脱剂。

图5 洗脱剂浓度对解析率的影响Fig.5 Effect of ethanol concentration on desorption
2.2 动态吸附实验
2.2.1动态吸附曲线
取处理好的树脂10 g装柱,将供试品液以水调制浓度为1.410 mg/m L时上样,每5 m L收集一管,并进行测定,绘制吸附曲线,结果见图6。
由图6可见:初始阶段,流出液的吸光度很小,吸附效率较高,当上样量增加到25 m L时,开始有少量泄露,并逐渐接近饱和吸附,当上样量达到30 m L时,吸附饱和,故选择上样量为3 m L/g树脂。

图6 动态吸附曲线Fig.6 The adsorption curve
2.2.2动态解吸曲线
将一定浓度的供试液上柱,吸附饱和后用60%的乙醇在0.75 BV/h流速下进行洗脱,结果见图7。
由图7可见:用60%的乙醇进行洗脱时,在0.75 BV/h流速下总黄酮出柱较集中。

图7 动态解吸曲线Fig.7 The desorption curve
2.3 验证性实验
为验证优选工艺的可行性,本实验称取200 g处理好的树脂装柱,取浓度为1.512 mg/m L的供试液550 m L上样,上样完毕后用60%乙醇进行解吸,每0.5 BV收集一份。合并含有黄酮的流份,并浓缩至干,称重。经测定总黄酮纯度为69.8%,收率为86.8%。
3 讨论
黄酮类成分在洋葱中含量比较高,有抗病毒、保肝、抗肿瘤等多种药理作用。本实验优选弱极性AB-8树脂富集总黄酮,以便得到含量尽可能高的黄酮类成分做进一步研究。试验中也证明了AB-8型树脂对总黄酮具有较好的吸附和解吸附性能,因此适合对黄酮类成分进行纯化。
本实验考察了吸附率、解析率、吸附液浓度及p H值、洗脱剂浓度等影响树脂吸附性能的主要因素。黄酮类物质大多有酚羟基,有一定的弱酸性,当上样液偏碱性时,可能由于离子化而不被吸附;反之,p H过低时,黄酮类化合物由于转化为佯盐也影响吸附,而且黄酮苷类会水解,因此试验中样品液p H选取为5。吸附流速主要是影响溶质向数值表面的扩散,从而决定了吸附效率,如果吸附流速增大,则溶质分子来不及扩散到树脂内表面,就会发生泄露,吸附效率下降;流速过慢则会延长纯化周期,本实验采用上样流速为1.5 BV/h,洗脱流速为吸附流速的1/2,即0.75 BV/h。
由验证实验可以看出,AB-8树脂处理后的洋葱总黄酮纯度达69.8%、收率为86.8%,和纯化前相比总黄酮的纯度明显提高,富集效果良好。该工艺操作简单、重复性好,可作为洋葱总黄酮的有效富集方法。
[1]V Lanzotti.The analysis of onion and garlic[J].J.Chromatogr.A,2006,1112(1):3-22.
[2]T.Leighton,C.Ginther,L.Fluss,et al.Phenolic compounds from food and their effect on health[J].American Chemical Society Symp,1992,506:220.
[3]Lancaster,J.E.,Kelly,K.E.Quantitative analysis of the S-alk(en)yl-L-cysteine sulfoxides in onion(Allium cepa L.)[J].Sci.Food,2005,16(34):1229-1235.
[4]Jinyuarn Lin,Chingyin Tang.Determination of total phenolic and favonoid contents in selected fruits and vegetables,as well as their stimulatory effects on mouse splenocyte proliferation[J].Food chemistry,2007,101(1):140-147.
[5]Torgils Fossen,Atile.T P,Qyvind M A.Flavonoids from red onion (Allium cepa)[J].phytochemistry,1998,2(47):281-285.
[6]甘永祥,陈文,张华,等.D-301大孔树脂富集刺山柑总酚酸工艺研究[J].石河子大学学报:自然科学版,2009,27(5):630-633.
[7]王卓慧,张沐新,杨晓虹,等.洋葱中总黄酮乙醇提取工艺的研究[J].中草药,2006,37(3):387-388.

