不同单肺通气模式对胸科手术患者血浆炎性介质水平的影响
高元丽 代志刚 张印龙
(石河子大学医学院第一附属医院,新疆 石河子 832008)
容量控制通气(VCV)和压力控制通气(PCV)是单肺通气的两种通气模式,目前以容量控制通气(VCV)模式应用最为广泛,但这一过程常引起炎性细胞激活释放大量炎性因子,可引起肺部言行反应及并发症。所以近些年来,麻醉医师选择在严重呼吸衰竭患者治疗过程中广泛应用的压力控制通气模式(pressure controlled ventilation,PCV)来改善动脉氧合,但此种保护性通气模式应用于正常肺组织,特别是单肺通气期间个体化肺保护性通气策略的应用能否减少炎性因子释放,减轻炎性反应尚不清楚。我们拟通过研究两种通气模式对患者的血清中炎症介质的影响,来间接评价两种通气模式的所致肺损伤的程度及临床效果。
1 资料与方法
1.1 实验对象
选择需要单肺通气,ASAⅠ~Ⅱ级,排除心肝肾疾病的食管癌根治患者40例,患者术前作肺功能测定,并记录结果:FVC,FEV1,FEV1/FVC,MVV。
1.2 麻醉方法
所有患者在麻醉前30min肌内注射苯巴比妥0.1g,阿托品0.5mg。麻醉诱导用咪唑安定0.05~0.1mg/kg,芬太尼5~6μg/kg,阿曲库铵0.6mg/kg,依托咪酯0.2~0.4mg/kg。插入双腔支气管导管(F35~39),纤维支气管镜定位确认导管位置正确后,接Ohmeda790型麻醉机行机械通气,麻醉维持用咪唑安定、芬太尼间断静脉注射以及阿曲库铵7~10μg/(kg•min)、异丙酚6~12mg/kg/min经静脉微泵注入。
1.3 通气方式及分组
所有患者入手术室在吸入空气条件下,抽取动脉血及混合静脉血,测定血气。然后麻醉诱导,插入35-39F左或右双腔支气管导管,纤维支气管镜定位导管位置正确后,接麻醉机进行容量控制双肺通气(TLV-VCV),FiO2为100%,潮气量(VT)为10mL/kg,呼吸频率12次/分,吸气:呼气为1∶2。单肺通气时非通气侧肺先置入一细导管用于连接监测呼气末CO2分压,如PETCO2为零说明非通气侧肺密闭较好,无通气。单肺通气时,吸气时间为33%,吸气末暂停时间为10%。40例患者随机分为2组,A组(N=20)用容量控制单肺通气(OLV-VCV),VT 10mL/kg;B组用压力控制单肺通气(OLVPCV),Ppeak为能提供双肺通气潮气量时的气道压力,潮气量(VT)10ml/kg。OLV-VCV及 OLV-PCV均需调整呼吸频率,维持呼吸末CO2分压(PETCO2)在30~35mmHg范围内。A组(n=20):单肺通气时行容量控制通气模式 (OLV-VCV);B组(n=20):单肺通气时行压力控制通气模式 (OLV-PCV)。
1.4 观察指标及测定方法
麻醉全过程均采用美国HP多功能监护仪监测HR、收缩压(SBP)、舒张压(DBP)、SpO2、呼气末二氧化碳分压(PETCO2)、ECG,记录手术时间、出血量、出入量和平均气道压。在单肺通气前(T1),单肺通气30min(T2)、单肺通气60min(T3)、术毕双肺通气30min(T4)时、术后24h(T5)分别采取外周静脉血5mL,以3000r/min离心10min,取上清液于-70℃冰箱保存测所有标本血清IL-6,IL-8,IL-10及TNF-α浓度所有标本留取在OLV1h内(结扎肺血管前)进行,采血时停止手术操作,避免压迫术侧肺。
1.5 统计学处理
采用SPSS13.0统计软件进行统计学分析,计量资料以均数±标准差(±s)表示,组内比较采用单因素方差分析,组间比较采用成组t检验,计数资料比较采用卡方检验(单侧检验),P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
各组间患者性别、年龄、体质量、手术时间、术中出入量、失血量等差异无统计意义(P>0.05),各组麻醉及手术经过顺利,无麻醉意外和并发症发生,见表1。
表1 两组临床基本情况比较(n=20,±s)

表1 两组临床基本情况比较(n=20,±s)
项目 A组(n=20)B组(n=20)身高(cm)166.6±8.2 170.6±8.6体质量(kg)64.4±8.6 65.0±9.5性别(男/女)11/9 15/5年龄(岁)57.3±15.7 56.7±13.8术中出入量(mL)1381.8±233.1 1218.3±122.2出血量(mL)320.1±61.2 334.2±89.0手术时间(min)220.8±38.3 198.9±29.8
2.2 血清TNF -α,IL-6,IL-8,IL-10水平比较
与T1比较,两组血浆TNF -α,IL-6,IL-8及IL-10水平均持续升高(P<0.05);B组的TNF -α,IL-6,IL-8在T2,T3,T4时间点均明显低于A组(P<0.05);血浆IL-10水平在T3,T5时间点明显高于B组(P<0.05)。
3 讨 论
单肺通气对开胸手术来说是必不可少的通气方式,但近年来的研究显示,单肺通气技术应用不当引起相关性肺损伤,并且促使肺内炎症介质移位到血液,引发或加重全身炎症反应综合征其可造成多种生理紊乱,同时这也是影响手术患者预后的重要病理生理过程[1]。多项研究表明[2],VT和Ppeak是引起肺炎性反应的主要危险因素。从气压伤、容积伤及由此引起的生物伤的机制出发,采取限制性通气方式,通过对通气压力或通气容量的限制,有效地控制肺泡压和肺泡跨壁压是预防肺再损伤的关键,故近年来许多学者对于生物伤的防治主要集中于保护性通气策略。保护性通气的实质就是减少潮气量及降低气道压力,避免肺泡过渡膨胀及萎陷,减少剪切力等对肺的损伤[2,3]。
目前临床常通过调整机械通气方式来调整肺血流以防治低氧血症,减肺的机械牵拉损伤。以前的研究多采用容量控制通气模式(VCV)。此时,通常气道压会明显增高,造成肺内分流增加使氧合得不到很好改善;另一方面,增加了肺的机械牵张,共同造成炎症介质释放增加,从而引起一定的肺损伤。近些年来,麻醉医师在传统的胸科麻醉指南基础上,发现了新的问题并积极寻求解决的方法。选择在严重呼吸衰竭患者治疗过程中广泛应用的压力控制通气模式(PCV)来改善动脉氧合,以降低气道峰压,减少肺损伤。但目前多数手术室还没有使用,因此,选择VCV还是PCV通气模式目前临床上还存在一定争议。我们通过探索两种通气模式对患者的呼吸力学及相应的血清中的炎症介质的影响,来间接评价两种通气模式的所致肺损伤的程度及临床效果。
表2 血清TNF-α,IL-6,IL-8,IL-10水平比较((pg/mg),±s)
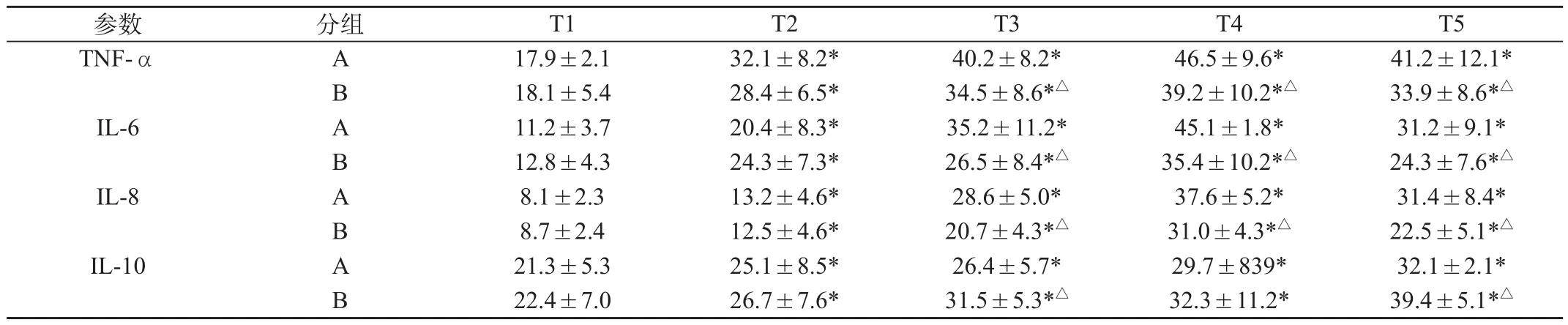
表2 血清TNF-α,IL-6,IL-8,IL-10水平比较((pg/mg),±s)
与T1比较:*P<0.05;与A组比较:△P<0.05
组 T1 T2 T3 T4参数 分T5 TNF-α A 17.9±2.1 32.1±8.2* 40.2±8.2* 46.5±9.6* 41.2±12.1*B 18.1±5.4 28.4±6.5* 34.5±8.6*△ 39.2±10.2*△ 33.9±8.6*△IL-6 A 11.2±3.7 20.4±8.3* 35.2±11.2* 45.1±1.8* 31.2±9.1*B 12.8±4.3 24.3±7.3* 26.5±8.4*△ 35.4±10.2*△ 24.3±7.6*△IL-8 A 8.1±2.3 13.2±4.6* 28.6±5.0* 37.6±5.2* 31.4±8.4*B 8.7±2.4 12.5±4.6* 20.7±4.3*△ 31.0±4.3*△ 22.5±5.1*△IL-10 A 21.3±5.3 25.1±8.5* 26.4±5.7* 29.7±839* 32.1±2.1*B 22.4±7.0 26.7±7.6* 31.5±5.3*△ 32.3±11.2* 39.4±5.1*△
在众多炎性因子中IL-6水平的急剧上升可看作急性期反应的表现,即炎性因子的大量激活,它与肺损伤、肺部并发症密切相关。已知开胸食管癌手术是应激反应最强烈的手术之一,手术相关死亡率较高。与其他重大手术相比,食管癌手术后炎症因子显著升高的机制尚不清楚。IL-8也由肺泡巨噬细胞产生,IL-8水平亦与肺损伤密切相关,合并肺部并发症者术中IL-8较无并发症者高[4],IL-8被公认为是炎性反应中导致肺组织损的特异性细胞因子,对白细胞有强大的趋化用[5]。由此可知二者是具有观察意义的炎性因子,减少它们的产生可有效防止肺部并发症。TNF-α主要由激活的巨噬细胞产生,其主要生物活性是导致肿瘤细胞坏死,同时也具有抗感染和免疫调节作用。是炎症早期最具影响的介质之一在炎性反应发生发展中,TNF-a起着始动作用[5,6]。IL-10 主要由Th2淋巴细胞产生,是一种抗炎性细胞因子,可抑制巨噬细胞的递呈作用,对免疫应答主要起抑制作用。IL-10它不仅抑制单核细胞等产生TNF-a、IL-1、IL-6、IL-8,同时IL-10活化后又导致血中TNF可容性受体1,2、IL-1受体拮抗剂等抗炎性介质的释放,在创伤后的炎症反应中有保护性作用[7]。IL-10的主要功能是限制和最终终止炎症反应[8]。
本研究结果显示,两组患者血清TNF -α、IL-6、IL-8水平在单肺通气时显著高于单肺通气前,提示单肺通气对肺组织的损伤此时明显增加,而由单肺通气转换为双肺通气后30min,血清TNF -α、IL-6、IL-8水平仍然很高,尽在术后24h才开始下降但仍高于单肺通气前,提示肺部损伤虽有所恢复,但仍未完全恢复正常,至于肺损伤可能持续的时间,仍需进一步的研究。但压力通气模式组TNF -α、IL-6、IL-8水平显著低于容量通气模式组,而抗炎症因子IL-10水平显著高于容量通气模式组,说明压力通气模式组的炎症反应程度轻与容量通气模式,单肺通气期间选择容量通气模式可以减轻肺部的炎症反应从而减轻肺损伤,值得在临床推广应用。
[1]Schilling T,Kozian A,Kretzschmar M,et al.des fl urane anaesthesia on the alveolar in fl ammatory response to one-lung ventilation[J].Br J Anaesth,2007,99(3):368-375.
[2]Michelet P,D'Journo XB,Roch A,et al.Protective ventilation influences systemic inflammation after esophagectomy: a randomized controlled study[J].Anesthesiology, 2006,105 (5):911-919.
[3]Petrucci N,Iacovelli W.Ventilation with smaller tidal volumes:A quantitative systematic review of randomized controlled trials[J].Anesth Analg,2004,99(1):193-200.
[4]Tsukada K,Hasegawa T,Miyazaki T,et al.Predictive value of interleukin-8 and granulocyte elastase in pulmonary complication after esophagectomy[J].Am J Surg,2001,181(2):167-71.
[5]XieGQ,JiangJX,ChenYH,et al.hiduction of acut ehepatic injure by Endotoxinin in mice[J].HePatobiliary Pancreat Dis lnt,2002,1(4):558-564.
[6]Kim GY,Roh,Sl,Park SK,et al.A lleviation of experimental septic shock inmice by acidic polysaccharide isolated from the medicinal mushroomphell inuslinteus[J].Biol Pharm Bull,2003,26(10):1418-1423.
[7]欧阳平,刘煜,赖文岩,等.重组人白介素10对离体大鼠胸主动脉血管平滑肌细胞增殖的影响[J].第一军医大学学报,2001,21(11):828.
[8]吴英达,祝胜美,赵抗美,等.食管癌手术患者围术期IL-6、IL-8、IL-10的变化与术后并发症的关系[J].中华麻醉学杂志,2002,22(8):456.

