自身免疫性胰腺炎81例临床特征分析
辛磊 彭国林 廖专 胡良皞 常雪娇 朱明华 郑建明 潘春树 沈茜 李兆申
·论著·
自身免疫性胰腺炎81例临床特征分析
辛磊 彭国林 廖专 胡良皞 常雪娇 朱明华 郑建明 潘春树 沈茜 李兆申
目的总结我国自身免疫性胰腺炎(AIP)患者的临床特征。方法分析上海长海医院2005年2月至2012年5月诊断为AIP的81例患者临床资料。结果81例AIP患者中男女比例7.1∶1,平均年龄(57±12)岁。51.9%(42/81)患者以梗阻性黄疸为首发症状。影像学显示胰腺局灶型占位45例,弥漫型肿大35例,胰腺假性囊肿为主要表现1例;72.8%(59/81)伴有胆管受累,11.1%(5/45)伴有主胰管扩张。PET-CT表现为全胰腺(11例)或胰头颈部(2例)代谢增高,5例伴有胰腺外显著高代谢区。血清IgG4阳性率94.6%(53/56),CA19-9阳性率54.4%(37/68),ss-DNA抗体阳性率14.3%(4/28),抗核抗体阳性率10.7%(3/28),ds-DNA抗体阳性率7.1%(2/28)。20例手术标本行HE染色和IgG4免疫组化染色,均符合淋巴浆细胞硬化性胰腺炎表现。结论我国AIP以1型为主,结合临床症状、胰腺外表现、影像学和(或)核医学、血清学、细胞学和(或)组织学等检查可有效提高AIP的正确诊断率。
胰腺炎,自身免疫性; 胰腺炎,慢性; 疾病特征; IgG4; 淋巴浆细胞硬化性胰腺炎
1961年,Sarles等[1]首次报道一例伴有腹痛、梗阻性黄疸以及高γ球蛋白血症的慢性硬化性胰腺炎患者,并推测为自身免疫性疾病。1995年,日本学者Yoshida等[2]将这种胰腺疾病命名为自身免疫性胰腺炎(autoimmune pancreatitis,AIP)。此后,国际上对其研究日渐深入,极大地提高了AIP的诊断和治疗水平。但目前我国对AIP的认识尚处于起步阶段,仅有小样本报道[3-7],与欧美和日本的报道例数相差甚远。本研究分析上海长海医院诊治的AIP患者的临床资料,旨在总结我国AIP患者临床特点,提高对AIP的认识。
资料与方法
一、病例采集
检索长海医院病案数据库,得到2005年2月至1012年5月出院诊断为“自身免疫性胰腺炎”的病例。检索2005年至2009年因胰腺占位行胰腺手术、且病理示“慢性胰腺炎”的病例,对病理标本重新进行HE染色和IgG4免疫组化染色。参照日本胰腺协会AIP指南、美国Mayo医院HISORt标准、国际胰腺协会AIP共识意见以及火奴鲁鲁共识意见,对以上所得病例进行筛选,符合任一诊断标准的病例纳入本研究。
二、研究内容
包括人口学信息、临床表现、胰腺外表现、影像学和(或)核医学检查结果、内镜逆行胰胆管造影(ERCP)和(或)超声内镜(EUS)检查结果、血清学指标、细胞学和(或)组织学诊断。
三、统计学处理
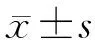
结 果
一、临床表现
2005年2月至2012年5月长海医院共诊断AIP患者81例(图1),占同期诊断慢性胰腺炎患者的9.4%。男女比例为7.1(71∶10),平均年龄(57±12)岁,均为汉族。
本组患者的主要首发症状以梗阻性黄疸最为常见(51.9%,42/81),其中4例(9.5%)在病程中有自我缓解和反复发作。其次为腹痛和(或)腹部不适(27.2%,22/81)以及急性胰腺炎发作(9.9%,8/81),在急性胰腺炎发作的8例患者中,有2例(25.0%)呈反复发作。其他首发表现包括体检发现胰腺异常5例(6.2%),腹泻1例(1.2%),血糖升高1例(1.2%),消瘦1例(1.2%),脂肪泻1例(1.2%)。17.3%的患者(14/81)在入院前或入院后被诊断为糖尿病。
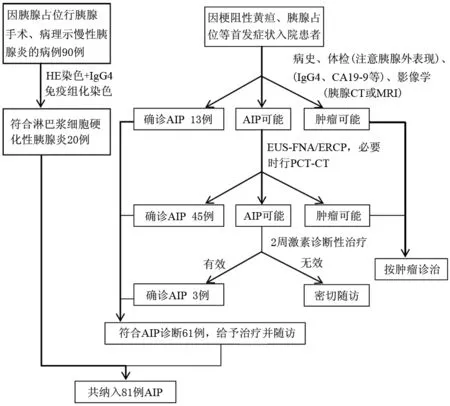
图1 长海医院81例AIP患者诊断流程
胰腺外表现以胆管受累为最常见(72.8%,59/81),其中影像学提示硬化性胆管炎20例(24.7%),临床症状和影像学表现为胆管受压扩张39例(48.1%)。其他胰腺外表现,包括硬化性下颌下腺炎2例,主动脉炎、硬化性泪腺炎、类Sjögren综合征、间质性肺炎、溃疡性结肠炎、硬化性涎腺炎、眶周炎性肿物、下颌淋巴结肿大各1例。
二、影像学表现
综合CT与MRI,81例患者中胰腺局灶型占位45例(55.6%),胰腺弥漫型肿大35例(43.2%),未见明显胰腺肿大或占位、以假性囊肿为主要表现1例(1.2%)。在局灶型占位患者中,胰头受累比例最高(40.7%)。
1.CT表现:45例有详细增强CT资料,其中27例表现为胰腺弥漫性肿大,呈“腊肠样”改变,18例表现为局灶型占位(图2)。平扫期胰腺密度均匀,未见胰腺钙化或胰管结石;增强期胰腺病变部位延迟强化,12例(26.7%)表现有增厚的、低密度包膜,即“帽状缘”。5例(11.1%)伴有主胰管扩张,未伴远端胰腺萎缩。3例(6.7%)见胰腺假性囊肿,最大直径10.5 cm。29例(64.4%)伴有肝内外胆管扩张,胰头段胆总管管壁增厚、管腔狭窄或消失,增强后胆管壁明显强化,断面呈小圆形或环形。此外,5例CT提示脾静脉受累,其中2例还伴有胃底静脉曲张;1例有主动脉炎症表现;7例伴有腹膜后淋巴结肿大。
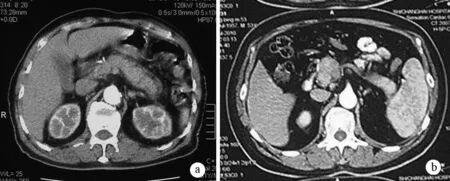
a为弥漫型,伴有体尾部“帽状缘”;b为局灶型,病变位于胰头钩突部
图2AIP的CT表现
2.PET-CT表现:13例患者接受PET-CT检查,11例(84.6%)显示全胰腺氟代脱氧葡萄糖(FDG)代谢增高,2例(15.4%)显示胰头颈部FDG代谢增高。5例(38.5%)提示胰腺外显著高代谢区,包括1例下颌肿大淋巴结、1例胆管+颈部淋巴结、1例肺门+结肠、1例胸壁+纵隔+双侧肺门、1例肾上腺+左锁骨上及腹膜后淋巴结。
3.EUS表现:49例行EUS检查,病变部位多呈低回声伴内部高回声光点,边界较清晰。31例(63.3%)患者伴有胆管受累。所有病例均未见明显胰管结石和胰腺钙化。6例行EUS+声学造影,病变和毗邻胰腺组织均呈现网状高血流信号,达峰可显著或不显著,消退明显早于周围组织。
4.ERCP表现:19例患者接受ERCP,6例(31.6%)见主乳头明显肿胀,18例行胆管造影,3例行胰管造影,2例行胆管内超声(intraductal ultrasonography,IDUS)。18例胆管造影均可见胆总管远端狭窄,近端胆管扩张,6例表现为硬化性胆管炎。3例胰管造影见节段性不规则狭窄。2例IDUS亦表现为硬化性胆管炎。
三、血清学指标
1.免疫相关指标:56例患者检测血清IgG4,中位值为9.37g/L(0.02~52.2 g/L),53例(94.6%)IgG4升高。45例患者行血清IgG检测,中位值为18.05 g/L(8.43~32.30 g/L),32例(71.1%)IgG升高。其中41例同时行血清IgG4与IgG检测,IgG4阳性率高于IgG(95.1%比73.2%,P=0.004)。28例患者接受自身免疫抗体检测,ss-DNA抗体阳性4例(14.3%),抗核抗体阳性3例(10.7%),ds-DNA抗体阳性2例(7.1%),抗核糖体抗体、抗平滑肌抗体、抗ENA抗体阳性各1例(3.6%),自身免疫抗体阳性者均伴有IgG4水平升高。
2.其他血清学指标:42例伴有梗阻性黄疸的患者中,总胆红素水平中位值为96.4 mmol/L(23.1~380.9 mmol/L),直接胆红素水平中位值为71.1 mmol/L(8.6~281.7 mmol/L)。3.4%(2/58)的患者CEA水平升高,54.4%(37/68)的患者CA19-9水平升高。
四、细胞学和病理学表现
29例(59.2%)行内镜超声引导下细针穿刺(EUS-FNA)检查,细胞学检查见导管上皮细胞和炎性细胞,未见恶性细胞。穿刺后无明显并发症。因所得样本量较少,未见明显淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP)表现。
20例手术切除标本行病理检查和IgG4免疫组化染色。镜下见胰腺组织散在淋巴细胞和浆细胞浸润,小叶间导管纤维化,部分病例可见闭塞性小静脉炎和席纹样纤维化,符合LPSP、即1型AIP表现(图3)。20例均有IgG4阳性细胞,其中19例每高倍视野≥5个。IgG4染色阳性细胞集中于小叶和导管间,尤以大、中导管为著,炎症浸润的腺泡和胰周的淋巴细胞聚集区亦见IgG4阳性浆细胞。

图3 AIP的病理变化(左)和IgG4阳性细胞(右)(×400)
讨 论
AIP是一种少见的、特殊的慢性胰腺炎,因临床表现与胰腺癌难以鉴别,所以临床上误诊误治现象较为普遍。自2002年以来,日本胰腺学会、韩国Asan医学中心、美国Mayo医院等机构先后发布多个AIP指南意见,2011年发布AIP国际共识意见,对提高AIP的规范化诊断和治疗起到重要推动作用。我国对AIP的研究尚处于起步阶段,包括港台地区报道的样本量均较小[3-9]。本研究分析上海长海医院诊治的81例AIP患者临床特征,系目前国内最大样本量的病例报道。
本研究纳入的81例AIP患者中,梗阻性黄疸为最常见的首发症状,部分患者在病程中有自我缓解和反复发作。由于梗阻性黄疸为AIP主要的起病表现,因此与胰腺癌、肿块型慢性胰腺炎等疾病的鉴别成为临床难点。其他临床表现包括腹痛和(或)腹部不适,急性胰腺炎发作。本研究还发现,17.3%患者在入院前或入院后被诊断为糖尿病,提示AIP对内分泌功能的影响。
2011年的国际共识意见将AIP分为两个亚型,1型AIP是IgG4相关系统性疾病在胰腺的表现,胰腺外脏器受累的表现为诊断AIP提供了重要依据[10]。本研究中,胆管受累为最常见胰腺外表现,表现为典型硬化性胆管炎或不同程度的胆管狭窄。1型AIP合并的胆管炎,即IgG4相关性胆管炎(immunoglobulin G4 associated cholangitis,IAC),其胆管狭窄可发生于远端胆总管,也可发生于近端肝外胆管或肝内胆管。一项纳入53例IAC患者的研究显示,胆总管胰腺内段狭窄占51%,近端肝内胆管狭窄9%,肝内胆管狭窄8%,32%的患者存在多部位狭窄。该研究还表明,ERCP中发现胆管狭窄对诊断IAC特异性有限,与原发性硬化性胆管炎的鉴别仍需结合其他临床表现[11]。除胆管受累外,本组患者的胰腺外表现还包括硬化性下颌下腺炎、主动脉炎、硬化性泪腺炎等、此外,鉴于部分AIP难以与胰腺癌等鉴别,必要时可行PET-CT以明确全身情况。本组患者中,13例接受PET-CT检查,5例显示显著胰腺外高代谢区。
AIP国际共识意见中,胰腺实质的影像学检查占据诊断标准的首要位置[12]。胰腺弥漫性增大伴延迟强化(部分伴有强化期的帽状缘),不伴有低密度占位、胰管扩张和胰管截断为诊断AIP的“确定”证据;节段或局灶性胰腺肿大、伴有延迟强化为诊断AIP的“支持”征象。此外,影像学检查还是评价激素诊断性治疗的主要手段。国际共识认为,2周内影像学复查提示胰腺病变明显好转或胰腺外征象消失是评价激素治疗有效的惟一标准[12]。本研究中,55.6%患者表现为胰腺局灶型占位,43.2%为胰腺弥漫型肿大,仅1例以假性囊肿为主要表现。值得注意的是,本组11.1%的患者CT提示主胰管扩张,与之前的报道不尽一致。国际共识意见认为胰管扩张是AIP的不典型表现[12],存在这一表现往往倾向于排除AIP的诊断,我国多家医院之前的报道也未观察到明显的胰管扩张病例[3-6],但盛京医院最近的报道显示,病理确诊的1、2型AIP患者分别有45.5%(10/22)和60%(3/5)的影像学检查表现有胰管扩张,部分病例的病理学诊断亦见胰管扩张[7]。鉴于AIP发病机制尚不明确,胰管扩张是否是AIP少见表现还有待进一步研究。
血清IgG4是国际共识意见中推荐的诊断1型AIP惟一血清学标志物。IgG4水平高于2倍正常上限为诊断AIP的“确定”证据,IgG4水平在正常上限和2倍之间为“支持”证据[12]。各中心报道的IgG4诊断价值差异较大,敏感性从44%到95%不等[13-16],与其纳入患者来源有关。本组患者血清IgG4阳性率高达94.6%。由于本研究纳入患者多通过影像学联合血清IgG4水平得到诊断,对一些IgG4水平正常的AIP患者存在漏诊的可能,在今后的工作中要注意此部分患者的诊断。此外,既往报道多认为自身免疫抗体对诊断AIP具有一定诊断价值,不同研究所报道的抗核抗体(ANA)阳性率为24%~50%,类风湿因子(RF)阳性率为17%~23%[13-15]。但来自韩国的一项研究显示,ANA和RF的敏感性较差,且大部分ANA和RF阳性者均为总IgG或IgG4升高患者,因此附加检测ANA和RF指标并不能提高AIP诊断[16]。本研究结果也显示ANA、RF、ss-DNA抗体、ds-DNA抗体等自身免疫抗体阳性率较低,且阳性者均伴有IgG4水平升高。因此在检测血清IgG4水平的情况下,联合检测其他自身免疫抗体的价值不大,但在无法检测血清IgG4水平时,ANA、RF等可以对AIP诊断起到一定的提示作用。血清CA19-9是常用的胰腺癌肿瘤标记物,本组AIP患者CA19-9的升高比例为54.4%,最高值>1000 U/ml,这部分患者均伴有胆管受累。因此在AIP和胰腺癌的鉴别中,CA19-9的价值有限。
通过影像学、血清学等无创检查,约70%的AIP患者可明确诊断[12],但仍有部分患者需要病理学的明确诊断。取得病理学标本的方法有EUS引导下穿刺和手术切除。EUS-FNA的创伤小,但获取标本量较少,难以完成对AIP的病理诊断和后续的免疫组化检验[17-18],多用于排除恶性病变。为解决样本量的限制,多数研究认为可对难以鉴别的患者行trucut针活检[18-20]。本研究有29例患者行EUS-FNA,细胞学检查见导管上皮细胞和炎性细胞,未见恶性细胞,但受制于标本量未能得到进一步病理诊断。本研究中对90例因胰腺占位行胰腺手术、且病理示“慢性胰腺炎”的标本重新进行HE染色和IgG4免疫组化染色,重新诊断20例AIP。HE染色和IgG4染色提示这些患者均符合LPSP、即1型AIP的病理表现,结合IgG4的较高阳性率,可初步认为我国AIP患者以1型为主,对2型AIP的诊断需要病理学的进一步支持。
[1] Sarles H, Sarles JC, Muratore R, et al. Chronic inflammatory sclerosis of the pancreas——an autonomous pancreatic disease? Am J Dig Dis, 1961,6:688-698.
[2] Yoshida K, Toki F, Takeuchi T, et al. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci, 1995,40:1561-1568.
[3] Song Y, Liu QD, Zhou NX, et al. Diagnosis and management of autoimmune pancreatitis: experience from China. World J Gastroenterol, 2008,14:601-606.
[4] 刘全达, 周宁新, 宋扬, 等. 自身免疫性胰腺炎23例临床分析. 中国全科医学, 2007, 2084-2086.
[5] 吕红,蒋卫忠,钱家鸣,等. 自身免疫性胰腺炎16例的临床分析. 中华胰腺病杂志,2010,10:155-158.
[6] 吴刚, 李雪丹, 石蕊, 等. 自身免疫性胰腺炎14例临床分析. 中华外科杂志, 2010,48:484-487.
[7] Zhang X, Zhang X, Li W, et al. Clinical analysis of 36 cases of autoimmune pancreatitis in china. PLoS One, 2012,7:e44808.
[8] Lin LF, Huang PT, Ho KS, et al. Autoimmune chronic pancreatitis. J Chin Med Assoc, 2008,71:14-22.
[9] Kamisawa T, Kim MH, Liao WC, et al. Clinical characteristics of 327 Asian patients with autoimmune pancreatitis based on Asian diagnostic criteria. Pancreas, 2011,40:200-205.
[10] Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas,2011,40:352-358.
[11] Ghazale A, Chari ST, Zhang L, et al. Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy. Gastroenterology, 2008,134:706-715.
[12] Sah RP, Chari ST. Autoimmune pancreatitis: an update on classification, diagnosis, natural history and management. Curr Gastroenterol Rep,2012,14:95-105.
[13] Kamisawa T, Shimosegawa T, Okazaki K, et al. Standard steroid treatment for autoimmune pancreatitis. Gut,2009,58:1504-1507.
[14] Frulloni L, Scattolini C, Falconi M, et al. Autoimmune pancreatitis: differences between the focal and diffuse forms in 87 patients. Am J Gastroenterol, 2009,104:2288-2294.
[15] Raina A, Yadav D, Krasinskas AM, et al. Evaluation and management of autoimmune pancreatitis: experience at a large US center. Am J Gastroenterol, 2009,104:2295-2306.
[16] Song TJ, Kim MH, Moon SH, et al. The combined measurement of total serum IgG and IgG4 may increase didagnostic sensitivity for autoimmune pancreatitis without sacrificing specificity, compared with IgG4 alone. Am J Gastroenterol, 2010, 105:1655-1660.
[17] Imai K, Matsubayashi H, Fukutomi A, et al. Endoscopic ultrasonography-guided fine needle aspiration biopsy using 22-gauge needle in diagnosis of autoimmune pancreatitis. Dig Liver Dis, 2011,43:869-874.
[18] Mizuno N, Bhatia V, Hosoda W, et al. Histological diagnosis of autoimmune pancreatitis using EUS-guided trucut biopsy: a comparison study with EUS-FNA. J Gastroenterol, 2009,44:742-750.
[19] Kanno A, Ishida K, Hamada S, et al. Diagnosis of autoimmune pancreatitis by EUS-FNA by using a 22-gauge needle based on the International Consensus Diagnostic Criteria.Gastrointest Endosc, 2012,76:594-602.
[20] Levy MJ. Endoscopic ultrasound-guided trucut biopsy of the pancreas: prospects and problems. Pancreatology, 2007,7:163-166.
Clinicalcharacteristicofautoimmunepancreatitis:ananalysisof81patients
XINLei,PENGGuo-lin,LIAOZhuan,HULiang-hao,CHANGXue-jiao,ZHUMing-hua,ZHENGJian-ming,PANChun-shu,SHENQian,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo analyze the clinical characteristic of Chinese autoimmune pancreatitis (AIP) patients.MethodsAll clinical data of 81 patients with a diagnosis of AIP in Shanghai Changhai Hospital from February 2005 to May 2012 were analyzed.ResultsThe sex ratio was 7.1∶1 and the mean age was (57±12) years old in 81 patients with AIP. Obstructive jaundice was the initial symptom in 51.9%(42/81) patients. In patient receiving CT, focal and diffuse type accounted for 45 and 35 patients, respectively, and pseudocyst was the main manifestation in 1 patient, biliary tract was involved in 59(72.8%)patients,dilatation of main pancreatic duct was observed in 5(11.1%) patients. In patients receiving PET-CT, diffuse increased Flourine-18 FDG uptake by the pancreas was found in 11 patients, focal increased uptake in 2 patients, and significant extra-pancreatic uptake was found in 5 patients. The positive rate of serum IgG4, CA19-9, ss DNA, anti-nuclear antibody and ds-DNA antibody was 94.6%(53/81), 54.4%(37/68), 14.3%(4/28), 10.7%(3/28), 7.1%(2/28), respectively. The pathological findings of H-E staining and IgG4 immunohistochemical analysis in 20 patients were consistent with lymphoplasmacytic sclerosing pancreatitis.ConclusionsType 1 AIP is the main subtype of AIP in China. Combining clinical symptoms,extra-pancreatic manifestations, imaging or nuclear medicine findings, serology, cytology or histology can effectively increase the correct diagnosis rate of AIP.
Pancreatitis, autoimmune; Pancreatitis, chronic; Disease attributes; Immunoglobulin G4; Lymphoplasmacytic sclerosing pancreatitis
10.3760/cma.j.issn.1674-1935.2012.05.002
国家自然科学基金(81270541);江西省科技支撑计划项目(2009JX01549);第二军医大学长海医院“1225”联合攻关重大项目(CH125510312)
200433 上海,第二军医大学长海医院消化内科(辛磊、廖专、胡良皞、彭国林、李兆申),病理科(常雪娇、朱明华、郑建明),放射科(潘春树),检验科(沈茜);解放军184医院(彭国林)
共同第一作者:彭国林
李兆申,Email:zhsli@81890.net
2012-10-8)
(本文编辑:吕芳萍)

