氯沙坦钾对2型糖尿病肾病大鼠肾脏TGF-β1、CD68和MCP-1 表达的影响*
马丽娟, 杜国利, 吕文魁, 曾小云, 朱 筠
(新疆医科大学第一附属医院内分泌科, 新疆 乌鲁木齐 830054)
1000-4718(2012)05-0947-04
2011-11-01
2012-03-15
新疆维吾尔自治区重点学科(内科学)资助项目
△通讯作者 Tel: 0991-4361195; E-mail:zhujun6677@163.com
氯沙坦钾对2型糖尿病肾病大鼠肾脏TGF-β1、CD68和MCP-1 表达的影响*
马丽娟, 杜国利, 吕文魁, 曾小云, 朱 筠△
(新疆医科大学第一附属医院内分泌科, 新疆 乌鲁木齐 830054)
目的探讨氯沙坦钾对2型糖尿病肾病大鼠转化生长因子β1(transforming growth factor beta 1, TGF-β1)、CD68(巨噬细胞标记物)和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)表达的影响,进一步说明氯沙坦钾对2型糖尿病大鼠肾脏的保护作用。方法雄性SD大鼠30只,按随机数字表法分为正常对照组、模型组和治疗组,每组10只。15周后, 观测肾组织形态学、肾功能和24 h尿蛋白定量等指标的变化, 用免疫组化法检测肾脏TGF-β1、CD68和MCP-1表达水平的变化。结果(1)与正常对照组相比,模型组及治疗组大鼠体重均降低,血糖、甘油三酯、胆固醇及MCP-1、CD68、TGF-β1的阳性细胞数升高,模型组24 h尿蛋白和肌酐升高;(2)与模型组相比,治疗组血肌酐、24 h尿蛋白、甘油三酯及MCP-1、CD68、TGF-β1的阳性细胞数明显降低。结论在2型糖尿病肾病大鼠中氯沙坦钾可以通过减少肾组织MCP-1表达,阻止巨噬细胞的浸润,下调TGF-β1表达,对糖尿病肾病病变起到保护作用。
糖尿病肾病; 氯沙坦钾; 转化生长因子β; CD68, 单核细胞趋化蛋白-1
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus, DM) 常见和严重的慢性并发症之一,糖尿病肾病是糖尿病严重的微血管并发症,也是终末期肾病的常见病因。目前大量研究表明免疫炎症细胞、细胞因子、急性期反应蛋白等炎症介质在糖尿病肾病的发生发展中起重要作用[1]。近年来,血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)肾脏保护作用受到关注,在本实验中, 我们观察了氯沙坦钾对实验性2型糖尿病肾病大鼠的保护作用,并探讨其相关机制。
材 料 和 方 法
1动物模型的建立与分组
雄性SD大鼠30只(新疆医科大学动物实验中心提供),体重80 g左右(4~5周龄),随机分为正常对照组、模型组和治疗组。其中模型及治疗组饲以高脂高糖饲料(饲料配方:10%炼猪油,20%蔗糖,2%胆固醇,67%普通饲料、1%猪胆盐),正常对照组(每组10只),饲以普通饲料。6周后模型组及治疗组空腹12 h后予小剂量链脲佐菌素(streptozocin,STZ;按30 mg/kg溶入pH 4.5的柠檬酸缓冲液)尾静脉注射,正常对照组给予等量柠檬酸缓冲液尾静脉注射。注射后1周测空腹血糖(fasting plasma glucose,FPG)和葡萄糖耐量实验2 h血糖(2hPG)(葡萄糖耐量实验:实验前禁食12 h,空腹剪尾取血测FPG,继以葡萄糖2 g/kg灌胃,于120 min时取血测血糖),取FPG≥7.0 mmol/L和(或)2hPG≥11.1 mmol/L者为2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠。T2DM成模的大鼠在STZ注射后分别在6周和7周时用尿微量蛋白试纸连续测大鼠晨尿3次以上,若为阳性,则为2型糖尿病肾病的大鼠,阳性者继续测24 h尿蛋白。将成模后治疗组大鼠每天给予氯沙坦钾片20 mg/kg灌胃,模型组给予等量生理盐水灌胃,15周后处死并收集4~6 mL静脉血及处死前收集24 h尿,留取双侧肾脏,称重, 在肾皮质处切取1 mm×1 mm×1 mm大小肾组织数块放入2.5%戊二醛固定,其余肾脏以4%多聚甲醛固定。
2主要试剂
STZ(Sigma),氯沙坦钾片(杭州默沙东),尿白蛋白检测EIA试剂盒(SPI),兔抗大鼠单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和小鼠抗大鼠CD68单克隆抗体(武汉博士德生物有限公司),转化生长因子-β1(transforming growth factor β1,TGF-β1)多克隆抗体(Santa Cruz),免疫组织化学试剂盒(北京中杉生物有限公司)。
3生化指标检测
24 h尿白蛋白测定采用酶免疫分析法(EIA)、血糖、血肌酐、尿素氮、胆固醇、甘油三酯由全自动生化仪(法国ABX)检测。
4免疫组织化学
采用SP法。石蜡切片常规处理,分别滴加MCP-1(1∶100)、TGF-β1(1∶100)和CD68(1∶200)Ⅰ抗,37 ℃孵化30 min,4 ℃过夜。滴加Ⅱ抗,显微镜下控制DAB显色,苏木紫复染。同时采用PBS代替Ⅰ抗作为阴性对照。应用北航CM-2000B 型医学生物图像分析系统,进行免疫组化图像分析,在单盲情况下每张切片在高倍镜(×400)下随机选择5个视野的肾小管-间质,以出现棕黄色染色为阳性信号,计数每个视野平均每0.02 mm2的阳性细胞数,并求其均值。
5统计学处理

结 果
1各组肾脏一般项目及血生化比较
与正常对照组相比,模型组及治疗组大鼠体重均降低(P<0.05),血糖和胆固醇升高(P<0.01),甘油三酯升高(P<0.05)。模型组24 h尿蛋白和肌酐升高(P<0.01)。与模型组相比,治疗组肌酐和24 h尿蛋白降低(P<0.01),甘油三酯亦降低(P<0.05),见表1、2。
表1各组体重、肾重、血糖和24h尿蛋白定量的比较
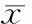

GroupBodyweight(g)Weightofkidney(g)Bloodglucose(mmol/L)Urinaryprotein(g/24h)Normalcon-trol473.50±57.063.60±0.396.96±1.910.02±0.01Treatment431.10±54.63*4.02±0.4421.97±3.32**0.06±0.26▲▲Model404.80±63.52*3.92±0.6221.71±1.99**1.15±0.34**
*P<0.05,**P<0.01vsnormal control;▲▲P<0.01vsmo-del.
表2各组甘油三酯、胆固醇、尿素氮和肌酐的比较
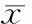

GroupTriglyceride(mmol/L)Cholesterol(mmol/L)Ureanitrogen(mmol/L)Creatinine(μmol/L)Normalcon-trol0.88±0.920.78±0.388.89±0.8044.20±4.64Treatment4.62±3.77*▲28.85±25.57**11.26±2.9854.11±24.68▲▲Model8.29±4.73**28.10±19.47**11.78±4.62218.40±35.73**
*P<0.05,**P<0.01vsnormal control;▲P<0.05,▲▲P<0.01vsmodel.
2肾脏病理学改变
2.1肾脏光镜改变 与正常对照组相比,模型组系膜细胞轻度到中度增生,系膜区面积占整个肾小球毛细血管襻面积增加,肾小管扩张或灶状萎缩,并有大量炎症细胞浸润。与模型组相比,治疗组系膜细胞稍有增生,肾小管扩张不明显,炎症细胞浸润少,见图1。
2.2肾脏电镜改变 模型组系膜内皮肿胀,内皮细胞空泡变性,少部分线粒体轻微肿胀。治疗组内皮细胞水肿,基底膜皱缩,系膜区有电子密度较高团块状结构,足细胞内微丝多,线粒体增多,血管腔闭塞。正常对照组肾小球结构正常,基底膜皱缩,见图2。
2.3各组大鼠肾脏CD68、MCP-1和TGF-β1的表达变化 CD68、MCP-1和TGF-β1均主要在肾小管-间质胞浆表达,细胞浆呈棕黄色为阳性。模型组和治疗组CD68、MCP-1和TGF-β1表达明显高于正常对照组(P<0.01),治疗组明显低于模型组(P<0.01);正常对照组几乎无表达或少表达,见图3、表3。
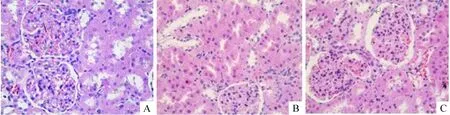
Figure 1. Light microscopic performance(HE staining,×400).A: treatment group; B: model group; C: normal control group.
图1光镜观察肾脏形态学变化

Figure 2. Electron microscopic performance(×6 000).A: treatment group; B: model group; C: normal control group.
图2电镜观察肾脏形态学改变

Figure 3. Expression of CD68,MCP-1 and TGF-β1in kidney tissues(immunohistochemical staining,×400). A: treatment group; B: model group; C: normal control group.
图3各组肾组织CD68、MCP-1和TGF-β1表达的变化
表3各组大鼠肾组织TGF-β1、MCP-1和CD68表达的变化
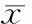

GroupTGF-β1MCP-1CD68Normalcontrol2.58±0.682.20±0.792.10±0.61Treatment6.64±1.35▲▲**7.40±1.34▲▲**6.64±0.70▲▲**Model16.20±2.12**15.30±2.70**17.720±1.79**
**P<0.01vsnormal control;▲▲P<0.01vsmodel.
讨 论
根据美国肾数据系统在2010年10月公布的统计数据,在2008年12月底,美国晚期肾病的人数达到了547 982人的空前高度[2],其中糖尿病肾病占了很大比例。新近研究揭示糖尿病肾脏疾病(diabetic kidney disease,DKD)的发病源于代谢紊乱和血流动力学障碍。有研究指出,炎症及转化因子、趋化因子的释放会导致肾脏损伤[3-5],其中MCP-1在DKD中的重要作用已成为目前研究的一个重要方向[6]。
TGF-β1是一个强力的致纤维化因子,通过促进肾小球细胞外基质(extracellular matrix,ECM)成分如胶原纤维连接蛋白的合成、抑制降解ECM成分的酶类合成等机制参与肾小球肥大和ECM的进行性积聚过程,最终引起肾小球硬化。Diamond等[7]利用SD大鼠单侧输尿管梗阻模型研究血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)对TGF-β1的刺激作用,发现梗阻侧肾皮质中单核巨噬细胞浸润数目在短期内与TGF-βmRNA表达有显著相关性,同时肾小管上皮细胞内MCP-1表达明显增强。Pimentel等[8]对浸润的单核巨噬细胞进行免疫组化研究,发现细胞内TGF-β1免疫反应增强,提示这些细胞也能分泌TGF-β1,促进ECM成分的积聚,有研究表明,MCP-1可通过TGF-β1介导实验性肾小球肾炎胶原产生增加[9]。因此,DN患者小管间质MCP-1高表达,可能是上调TGF-β1而参与小管间质损害。Cheng等[10]亦发现MCP-1通过与人肾小球系膜细胞胞膜上CCR2结合,引起核因子-κB(NF-κB)激活和TGF-β1产生, 诱导纤连蛋白( fibronectin,Fn)的mRNA和蛋白质合成增多。
肾素血管紧张素系统(renin-angiotensin system,RAS)在慢性肾脏疾病的病理生理过程中起重要的作用。RAS系统过度兴奋是慢性肾脏病发生、发展以及恶化的一个重要机制。己有研究证实,高糖状态下,肾脏局部RAS异常活跃。AngⅡ作为RAS的最终产物,其生理及病理学作用均是通过与肾组织中相应的受体结合后实现的。AngⅡ除影响全身和肾脏血液动力学直接参与肾损害外,还通过其非压力依赖作用造成的肾损伤。AngⅡ作为一种生长调节因子,它能促进多种细胞因子如TGF-β1等的合成和释放,进而刺激系膜细胞和上皮细胞肥大及增生,使ECM成分堆积,引起肾小球及肾间质纤维化。AngⅡ不仅造成小球毛细血管高压和小球的滤过选择性的损害,还影响间质的成纤维细胞和小管上皮细胞的某些功能,AngⅡ通过RAS及AngⅡ 1型受体(AngⅡ type 1 receptor,AT1)刺激肾小管细胞肥大、胶原纤维分泌,诱导成纤维细胞增生、胶原沉积和TGF-β1的合成,使间质成纤维细胞、肾小管上皮细胞分化为成肌纤维细胞[11],后期诱导凋亡[12],最终引起小管间质纤维化。
本研究建立2型糖尿病肾病模型,结果表明,与正常对照组相比,模型组及治疗组大鼠体重均降低,血糖、甘油三酯、胆固醇及MCP-1、CD68、TGF-β1的阳性细胞数明显升高,模型组24 h尿蛋白、肌酐升高;与模型组相比,治疗组肌酐、24 h尿蛋白、甘油三酯及MCP-1、CD68、TGF-β1的阳性细胞数明显降低。因此2型糖尿病肾病大鼠肾脏的损伤可能与MCP-1、CD68和TGF-β1相关。给予氯沙坦钾后,与模型组大鼠相比,治疗组大鼠蛋白尿明显减少,肾损伤程度明显减轻,而MCP-1、CD68及TGF-β1表达减少,这说明氯沙坦钾可能通过减少MCP-1、CD68及TGF-β1表达来发挥对肾脏的保护作用。由此我们认为,在2型糖尿病肾病大鼠中氯沙坦钾可以通过减少肾组织MCP-1表达,阻止巨噬细胞的浸润,下调TGF-β1表达,对DN病变起到保护作用。
[1] Mora C,Navarro JF.The role of inflammation as a pathogenic factor in the development of renal disease in diabetes[J].Curr Diab Rep,2005,5(6):399-401.
[2] US Renal Data System. USRDS 2010 annual data report: atlas of chronic kidney disease and end-stage renal disease in the United States[EB/OL]. Bethesda:National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2010[2010-12-20]. http://www.usrds.org/2010/ADR_booklet_2010_lowres.pdf,http://www.usrds.org/2009/pdf/V2_02_INC_PREV_09.PDF.
[3] Matavelli LC, Huang J, Siragy HM (Pro)renin receptor contributes to diabetic nephropathy by enhancing renal inflammation [J]. J Clin Exp Pharmacol Physiol,2010,37(3):277-282.
[4] Yokoi H, Mukoyama M, Mori K, et al. Over expression of connective tissue growth factor in podocytes worsens diabetic nephropathy in mice[J]. Kidney Int,2008,73(4):446-455.
[5] Jaffa AA, Usinger WR, McHenry MB, et al. Connective tissue growth factor and susceptibility to renal and vascular disease risk in type 1 diabetes[J].J Clin Endocrinol Metab,2008,93(5): 1893-1900.
[6] 陈芬琴,王秋月.单核细胞趋化蛋白-1与糖尿病肾病[J].国际内科学杂志,2008,35(3):140-143.
[7] Diamond JR, Kees-Folts D,Ding G,et al.Macrophages monocyte chemoattractant peptide-1 and TGF-beta 1 in experimental hydronephrosis [J].Am J Physiol,1994,266(6 Pt 2):F926-F933.
[8] Pimentel JL Jr,Sundell CL,Wang S,et al. Role of angiotensinⅡin expression and regulation of transform in growth factor-β in obstructive nephropathy [J].Kidney Int,1995,48(4):1233-1246.
[9] Schenider A,Panzer U,Zahner G,et al. Monocyte chemoattractant protein-1 mediates collagen deposition in experimental glomerulonephritis by transforming growth factor-β[J].Kidney Int,1999,56(1):135-144.
[10]Cheng J. TGF-β1 stimulates monocyte chemoattractant protein-1 expression in mesangia l cells through a phosphodiesterase isoenzyme 4-dependent process [J]. Am J Physiol Cell Physiol, 2005, 289(4): C959-C970.
[11]Sbarbati A, Osculati F, Slivagni D ,et al. Obesity and inflammation: evidence for an elementary lesion[J].Pediatrics,2006,117(1):220-223.
[12]Constant VA, Gagnon A, Landry A,et al. Macrophage-conditioned medium inhibits the differentiation of 3T3-L1 and human abdominal preadipocytes[J].Diabetologia,2006,49(6):1402-1411.
InfluenceoflosartanpotassiumonrenalexpressionofTGF-β1,CD68andMCP-1intype2diabeticnephropathyrats
MA Li-juan, DU Guo-li, LÜ Wen-kui, ZENG Xiao-yun, ZHU Jun
(DepartmentofEndocrinology,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urmuqi830054,China.E-mail:zhujun6677@163.com)
AIM: To observe the effects of losartan potassium on renal expression of transforming growth factor beta 1(TGF-β1), CD68 and monocyte chemoattractant protein-1 (MCP-1) in type 2 diabetic nephropathy rats for exploring the protective mechanism of losartan potassium on type 2 diabetic rat kidney.METHODSThirty Sprague-Dawley rats were randomized into 3 groups: normal control group, model group and treatment group. The morphology of kidney tissues, the renal function, and the change of 24 h urinary protein quantitative index were measured after 15 weeks of treatment, while TGF-β1, CD68 and MCP-1 expression in kidney cortex was observed by immunohistochemistry.RESULTSCompared with the normal control rats, the body weight of the rats was lower in other groups, but the levels of blood glucose, triglyceride and cholesterol were higher.The expression of CD68, MCP-1 and TGF-β1, 24 h urinary protein quantitative index and serum creatinine were higher in model group than those in normal control rats. However, compared with model group, serum creatinine, 24 h urinary protein quantitative index and the expression of CD68, MCP-1 and TGF-β1were decreased in treatment group.CONCLUSIONLosartan potassium protects the kidney of diabetic nephropathy rats through inhibiting the expression of TGF-β1and MCP-1 in the kidney and restraining macrophage infiltration.
Diabetic nephropathies; Losartan potassium; Transforming growth factor beta; CD68; Monocyte chemoattractant protein-1
R363
A
10.3969/j.issn.1000-4718.2012.05.034

