去势大鼠骨量丢失过程中骨髓间充质干细胞的增殖分化功能*
梁世桢, 王国轩, 范龙坤, 吴高义, 金 岩, 朱国雄△
(1辽宁医学院济南军区总医院研究生培养基地口腔科,山东 济南 250031;2辽宁医学院研究生学院, 辽宁 锦州 121001;3济南军区总医院口腔科,山东 济南 250031;4第四军医大学口腔医学院,陕西 西安 710032)
1000-4718(2012)03-0398-06
2011-10-19
2011-12-13
国家自然科学基金资助项目(No.2011CB964700)
△ 通讯作者Tel:0531-51665340;E-mail:jnjqzgx@163.com
# 现工作单位:济南军区总医院口腔科,山东 济南 250031
去势大鼠骨量丢失过程中骨髓间充质干细胞的增殖分化功能*
梁世桢1#, 王国轩2, 范龙坤2, 吴高义3, 金 岩4, 朱国雄3△
(1辽宁医学院济南军区总医院研究生培养基地口腔科,山东 济南 250031;2辽宁医学院研究生学院, 辽宁 锦州 121001;3济南军区总医院口腔科,山东 济南 250031;4第四军医大学口腔医学院,陕西 西安 710032)
目的研究骨髓间充质干细胞(BMSCs)增殖分化功能在去势大鼠骨质疏松发病过程中对骨量丢失的作用。方法选用10周龄健康雌性SD大鼠行双侧卵巢切除术(OVX),建立骨质疏松症(OP)的动物模型;选用同一批次、周龄相同、体重相近的健康雌性SD大鼠行双侧卵巢附近脂肪组织部分切除术,建立假手术(sham)组,假手术大鼠组(sham group)。采用离心法、贴壁法和有限稀释法分离、培养、纯化大鼠BMSCs,体外培养传至3~4代后用于实验:流式细胞术进行BMSCs表型鉴定;克隆形成实验检测BMSCs增殖状况;MTT法测定BMSCs生长曲线;成脂诱导后脂滴油红O染色法检测比较2组大鼠BMSCs成脂能力;成骨诱导后钙化结节茜素红染色法检测比较2组大鼠BMSCs成骨能力;RT-PCR法检测大鼠BMSCs成骨相关蛋白Runx2、骨钙素(OCN)和骨桥蛋白(OPN)mRNA的表达。结果与sham组大鼠BMSCs相比,OVX组大鼠BMSCs克隆形成能力减弱,增殖能力降低,成脂向分化增强,成骨向分化减弱(P<0.05)。结论去卵巢骨质疏松大鼠BMSCs增殖及成骨分化减弱,成脂分化增强;这导致去势大鼠快速的骨量丢失,在去势大鼠OP发病过程中发挥着重要作用。
骨髓间充质干细胞; 卵巢切除术;大鼠; 骨生成; 脂肪形成
骨质疏松症(osteoporosis,OP)是一种以骨量丢失为重要特征的骨代谢疾病,在绝经后妇女中发病率较高。研究表明骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在OP的发病过程中发挥着重要作用[1]。BMSCs存在于骨髓,具有高度自我更新能力和多向分化潜能,适宜条件下可分化再生骨、软骨、脂肪等间充质组织。研究表明OP的发生与BMSCs增殖和分化能力的改变有密切关系。研究发现,在体外实验中,OP患者来源的BMSCs增殖能力较正常人来源的差[2];OP的发生与BMSCs成骨分化能力的下降有重要关系[3];绝经后OP发病过程中骨量丢失时常伴有骨髓中脂肪组织的增加[4];骨髓腔内的脂肪细胞和成骨细胞均来源于BMSCs,二者具有相同的细胞表型,在一定条件下可以相互转换,并且存在彼消此长的关系[5]。本文旨在通过比较去势(ovariectomized,OVX)后OP模型大鼠与假手术(sham)大鼠BMSCs增殖及成骨、成脂向分化能力的改变,从细胞学的角度研究BMSCs增殖、成骨及成脂分化三因素的联合作用在OVX组大鼠OP发病过程中对骨量丢失的重要作用。
材 料 和 方 法
1材料
1.1动物 同一批次的健康10周龄SD大鼠24只,雌性,体重(210±20)g,由第四军医大学实验动物中心提供。
1.2主要试剂 低糖α-MEM培养液(alpha modified Eagle’s medium,Gibco),胎牛血清(Gibco),β-甘油磷酸钠(glycerophosphate,GP,Sigma),地塞米松(dexamethasoned,Dex, Sigma),维生素C(vitamin C,Vit C,Sigma),3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methyl xanthine,IBMX,Sigma),吲哚美辛(Sigma),胰岛素(万邦制药),逆转录试剂盒(TaKaRa),RT-PCR试剂盒(TaKaRa)。
1.3主要仪器 CO2细胞培养箱(Heraeus),酶标仪(Bio-Rad),倒置相差显微镜(Olympus),超净工作台(苏州净化),流式细胞仪(Becton Dickinson)等。
2方法
2.1OP动物模型建立[6]与分组 24只10周龄健康雌性SD大鼠随机分为2组,每组12只。一组大鼠行去势即双侧卵巢切除术,去势后3月,即可成功构建OP的动物模型,为OVX组;另一组大鼠行双侧卵巢附近脂肪组织部分切除术,建立假手术(sham)组,作为对照。所有动物均在24~28 ℃、通风良好的相同条件下饲养,自由摄水食。
2.2BMSCs体外分离培养纯化 术后3月,分别将OVX组与sham组大鼠脱颈处死,75%乙醇浸泡10 min,取出后无菌条件下分离大鼠股骨,去除附着的肌肉、骨膜等软组织,切除两侧干骺端,5 mL注射器吸取含10%胎牛血清(fetal bovine serum,FBS)的α-MEM培养液吹出骨髓,吹打均匀后,800 r/min离心5 min,弃上清,10%FBS的α-MEM培养液重悬,吹打均匀,将原代BMSCs接种于培养瓶中,置于37 ℃、 5%CO2细胞培养箱中,第4 d首次半量换液,弃悬浮细胞,以后每隔1 d全换液1次。
2.3BMSCs的传代 待细胞融合生长达培养瓶底壁80%~90%时,弃去旧的培养液,PBS(phosphate buffered saline)清洗2遍,加入2~3 mL胰酶,培养箱中消化1~2 min。倒置相差显微镜下观察细胞,待细胞收缩成圆形、悬浮后,加入3~4 mL含10%FBS的α-MEM培养液终止消化,吹匀,移入10mL离心管中,800 r/min离心5 min,弃上清,10%FBS的α-MEM培养液重悬,吹打均匀,以1∶2接种于新培养瓶中,置于细胞培养箱中培养。传至3~4代后细胞纯化率较高,生长状态较好,用于实验。
2.4BMSCs细胞表型鉴定 将生长状态较好的P3代细胞消化后,用含3%FBS的PBS清洗1次后重悬,分别加入不同标记的抗体:CD29、CD34、CD44(PE标记)和CD45(FITC标记)[7],4 ℃避光1 h,1 000 r/min 离心5 min,弃上清,用含3%FBS的PBS清洗2次,再次重悬,分别以PE、FITC标记作为阴性对照,流式细胞仪检测。
2.5BMSCs细胞增殖状况 取P3代细胞常规消化,离心,重悬后计数,以2 000个细胞 /皿,接种于直径10 cm平皿,补加培养液至10 mL,十字形晃动使细胞均匀分散,置于培养箱中常规培养2周,PBS清洗2遍,多聚甲醛6 mL室温固定30 min,PBS再次清洗2遍,10 g/L甲苯胺蓝PBS溶液染色,计数克隆数。克隆形成率 =(克隆数/接种细胞数)×100% 。
2.6生长曲线 取P3代细胞常规消化、离心、计数,以2 000 cells/well、180 μL /well设置7组,每组7孔(6个复孔,1个对照孔)接种于96孔板,接种24 h后,加入3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)液5 μL /well(MTT液配制:5 g MTT/L PBS液),置于培养箱中4 h后,弃去旧的液体,加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL /well,微孔板振荡器振荡10 min,酶联免疫仪选取490 nm测定吸光度值(A),以后每隔24 h检测1组,以时间为横轴,A值为纵轴绘制生长曲线。
2.7BMSCs成脂向诱导 取P3代细胞,计数后接种于6孔板,待细胞完全融合后,加入成脂诱导液(配置250 mL诱导液:含10%FBS的 α-MEM培养液250 mL+吲哚美辛8.9445 g+IBMX 27.8 g+1 g/L胰岛素500 μL+39.1 g/L Dex 250 μL)[8]2~3 mL/well,培养箱中培养,每隔2 d换液1次,诱导14 d。
2.8BMSCs成脂诱导后油红O染色 细胞成脂诱导14 d后,PBS清洗2遍,多聚甲醛2 mL/well,室温固定30 min,PBS清洗2遍,5 g/L油红异丙醇溶液以去离子水按3∶2 稀释、过滤后染色,室温1 h,PBS清洗2遍,照相。
2.9BMSCs成脂向诱导定量检测 细胞成脂诱导染色后,PBS清洗2遍,加异丙醇溶脂,酶标仪570 nm检测A值。
2.10BMSCs成骨向诱导 取P3代细胞,计数后接种于6孔板,待细胞融合80%后,加入成骨诱导液(配置250 mL诱导液:含10%FBS的α-MEM培养液250 mL+GP 0.815 g+30 g/L Vit C 417 μL+0.002 g/L Dex 50μL)2 mL /well,培养箱中培养,每隔2 d换液1次,诱导14 d。
2.11BMSCs成骨诱导后茜素红染色法(ARS) 细胞成骨诱导14 d后,PBS清洗2遍,多聚甲醛2 mL/well,室温固定30 min,PBS清洗2遍,加入茜素红染液(1 g Tris+100 mL去离子水,加HCl调pH至8.0,加入0.1 g茜素红粉剂,混匀、过滤),培养箱中染色1 h,PBS清洗2遍、照相。
2.12BMSCs成骨向诱导定量检测 细胞成骨诱导染色后,PBS清洗2遍,加Tris·HCl(pH 5.6),钙结节溶解后,酶标仪405 nm检测A值。
2.13RT-PCR检测BMSCs成骨诱导后骨钙素(osteocalcin,OCN)和骨桥蛋白(osteopontin,OPN)和Runt相关转录因子(Runt-related transcription factor 2,Runx2) mRNA的表达 (1)成骨诱导14 d后,用Trizol法(Invitrogen)按说明书提取总RNA;(2)取总RNA2.0 μg,用逆转录试剂盒(TaKaRa),逆转录体系(50 μL):5×PrimeScript Buffer(for real-time)10 μL,PrimeScript RT Enzyme MixⅠ2.5 μL,Oligo dT Primer(50 μmol/L)2.5 μL,Random 6-mers(100 μmol/L)2.5 μL,Total RNA,补加RNase free dH2O至50 μL,按说明书合成cDNA;(3)PCR扩增,扩增体系(20 μL):SYBR Premix Ex TaqTMⅡ(2×)10μL,ROX reference dyeⅡ(50×)0.4 μL,DNA模板2 μL,PCR forward primer(10 μmol/L)0.5 μL,PCR reverse primer(10 μmol/L)0.5 μL,dH2O 6.6 μL。扩增条件:95 ℃预变性30 s,95℃ 15 s,60 ℃ 34 s,40个循环,然后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。所用引物采用Oligo 6.0引物设计软件设计,由上海英骏生物公司合成。β-actin上游引物5’-CAC CAC ACC TTC TAC AAT GAG C-3’,下游引物5’-GTG ATC TCC TTC TGC ATC CTG T-3’,扩增片段长度692 bp;Runx2上游引物5’-CCA CCT CTG ACT TCT GCC TC-3’,下游引物5’-TAT GGA GTG CTG CTG GTC TG-3’,扩增片段长度298 bp;OCN上游引物5’-AGC GAC TCT GAG TCT GAC AAA-3’,下游引物5’-AAC GGT GGA GCC ATA GAT GCG-3’,扩增片段长度221 bp;OPN上游引物5’-AGA GAG CAA CGG GAA GAC-3’,下游引物5’-ATG GAA CTC GCC TGA CTG-3’,扩增片段长度207 bp。PCR扩增后,得到OVX组与sham组β-actin、Runx2、OCN与OPN mRNA检测结果Ct值:ΔCt=Ct-Ctβ-actin,ΔΔCt=ΔCtOVX-ΔCtsham,mRNA相对表达水平即为2-ΔΔCt。
3统计学处理
结 果
1BMSCs细胞表型鉴定
P3代BMSCs表型鉴定如图1所示,表型分子CD29和CD44阳性率分别为97.1%和94.0%,CD34和CD45阳性率分别为0.2%和3.1%。
2BMSCs增殖
克隆形成染色如图2所示,与sham组相比,OVX组大鼠BMSCs增殖形成的肉眼可见的克隆较少,较稀疏,单克隆较小。定量分析,OVX组大鼠BMSCs克隆形成率较sham组降低约19%,见表1,差异有统计学意义(P<0.05)。镜下观察单克隆细胞形态,显示OVX组大鼠BMSCs与sham组相比,细胞较为宽大、扁平,细胞多呈裂解状态。
3BMSCs生长曲线
生长曲线如图3所示,从第1~3 d,OVX组BMSCsA值与sham组相比,无明显差异;从第4 d开始,sham组BMSCs较OVX组BMSCs曲线升高明显,OVX组BMSCs活性减弱,细胞生长速度减慢,2组比较差异显著(P<0.05)。
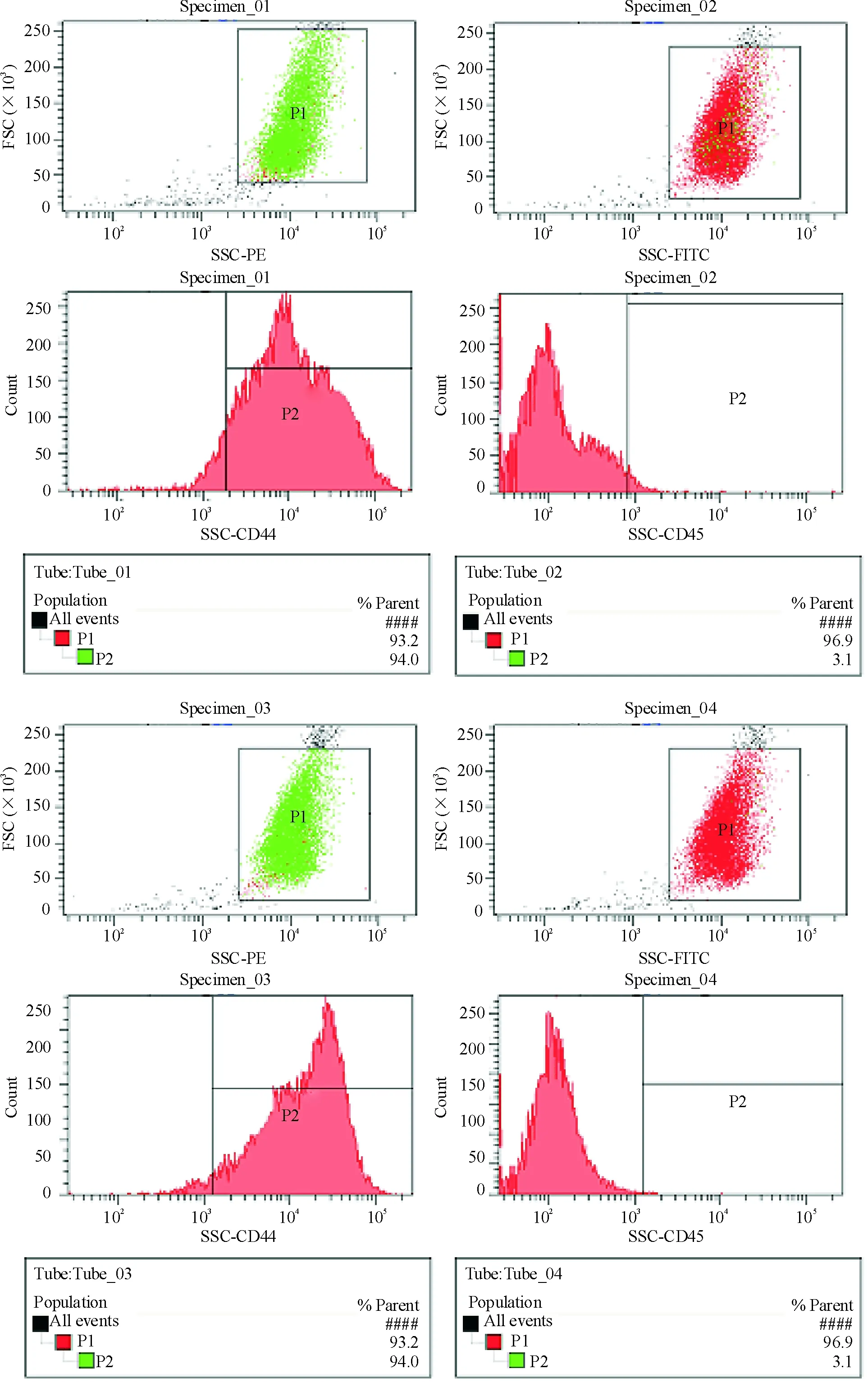
Figure 1. Phenotypes of rat BMSCs observed by FCM.
图1大鼠BMSCs细胞表型鉴定
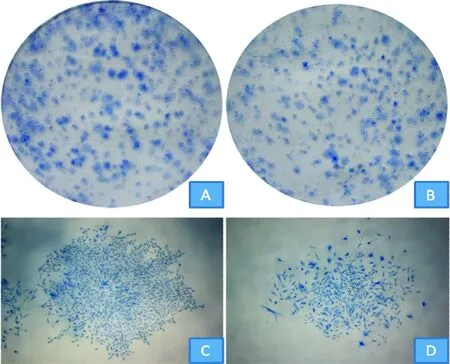
Figure 2. Colony formation and monoclonal morphology of rat BMSCs.A:colony formation of BMSCs in sham group;B:colony formation of BMSCs in OVX group;C:monoclonal morphology of BMSCs in sham group(×40);D:monoclonal morphology of BMSCs in OVX group(×40).
图2大鼠BMSCs克隆形成及单克隆形态
表1OVX组与sham组BMSCs克隆形成率、成脂及成骨分化能力的定量分析


GroupCFE(%)AADIAOSISham0.160±0.0082.238±0.1331.995±0.174OVX0.130±0.006*3.059±0.122*1.215±0.073*
*P<0.05vssham group.
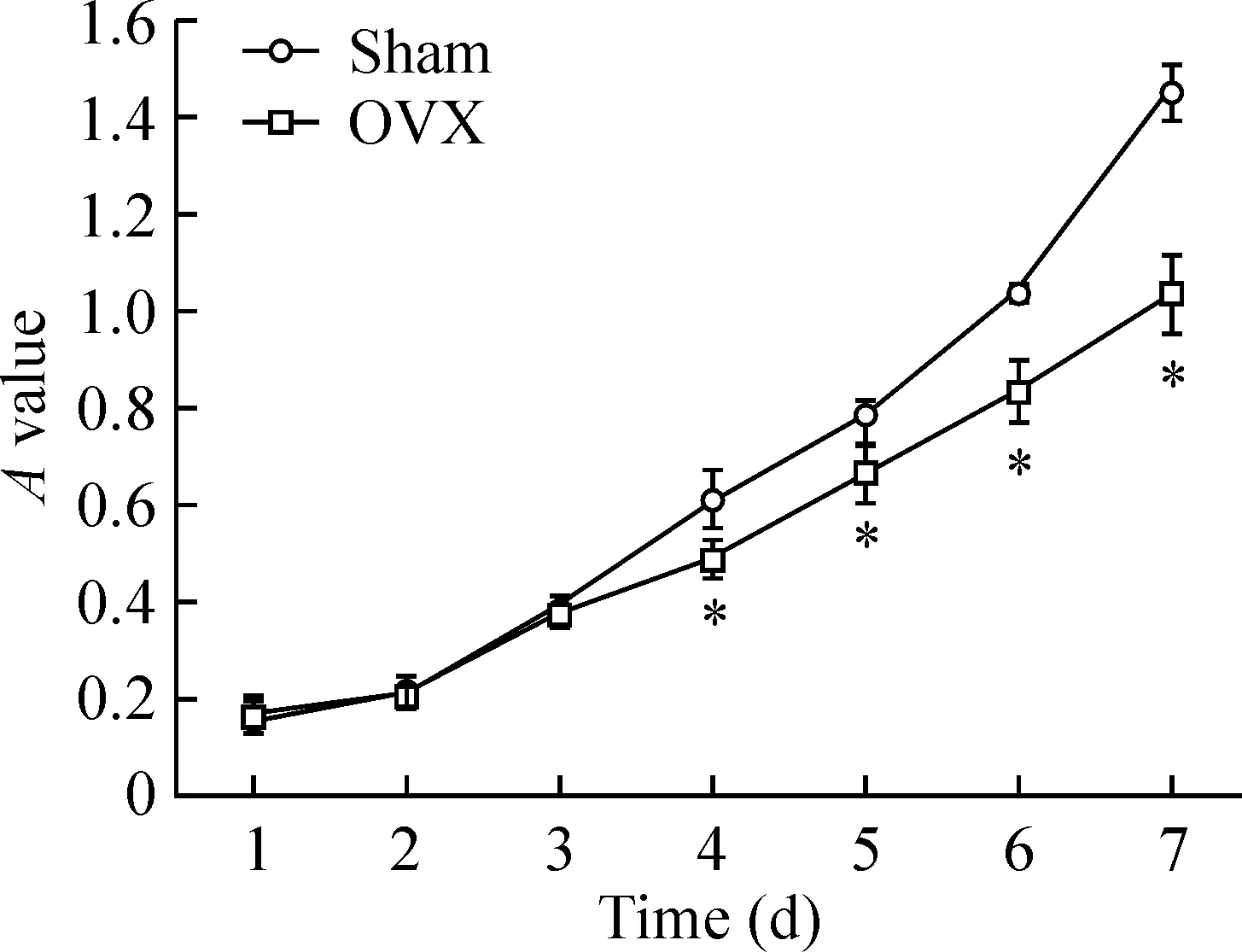
Figure 3. Growth curves of rat BMSCs in sham group and OVX group.*P<0.05vssham group.
图3Sham组与OVX组大鼠BMSCs生长曲线
4BMSCs成脂诱导染色及定量
镜下观察, sham组BMSCs成脂诱导染色后,脂滴较少,与sham组相比,OVX组脂滴红亮,数量明显增多,见图4。定量检测, OVX组BMSCs成脂能力较sham组明显增强,A值增加约27%,差异有统计学意义(P<0.05),见表1。

Figure 4. Oil red O dyeing after adipogenic induction of rat BMSCs in sham and OVX groups(×200).A:sham group;B:OVX group.
图4Sham组与OVX组大鼠BMSCs成脂诱导油红O染色
5BMSCs成骨诱导染色及定量
镜下观察,与sham组比较,OVX组钙化结节形成数量明显减少,见图5。定量检测, OVX组BMSCs成骨能力较sham组明显减弱,A值降低约39%,差异有统计学意义(P<0.05),见表1。
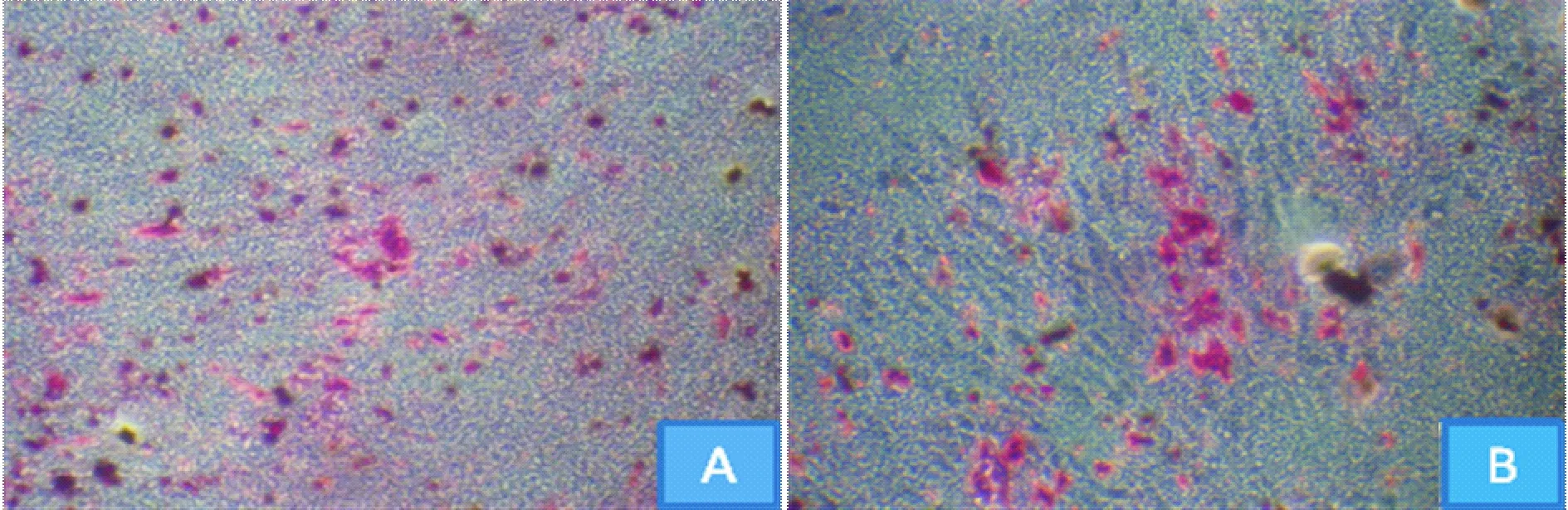
Figure 5. Alizarin red staining after osteogenic induction of rat BMSCs in sham and OVX groups(×100).A:sham group;B:OVX group.
图5Sham组与OVX组大鼠BMSCs成骨诱导茜素红染色
6BMSCs成骨诱导后OCN、OPN、Runx2mRNA表达的比较
如图6所示,成骨诱导14 d后,与sham组比较,OVX组BMSCs OCN、OPN和Runx2 mRNA表达均显著降低,其中Runx2降低最明显,差异有统计学意义(P<0.05),提示OVX组BMSCs成骨向分化能力较sham组降低。


图6Sham组与OVX组成骨诱导后Runx2、OCN和OPNmRNA表达的比较
讨 论
OP是以骨量丢失以及骨组织的退变为特征的一种全身性骨代谢疾病,高发于老年人和绝经后妇女。随着人口老龄化社会的到来,OP已成为严重危害人类健康的世界范围的公共卫生问题。研究表明,BMSCs是存在于骨髓中的干细胞群体,维持骨发育和动态平衡,其在OP发病途径中发挥着重要作用。
BMSCs不具有特异性的表面抗原,CD29、CD44、CD105是其重要表型分子,因其不表达造血干细胞(hematopoietic stem cells,HSCs)表面抗原,如CD34、CD45,因此本实验采用CD29、CD34、CD44、CD45作为BMSCs鉴定的参考分子。实验结果显示指标CD29和CD44表达阳性,指标CD34和CD45表达阴性,符合BMSCs表型特征。阳性指标CD29和CD44阳性率分别为97.1%和94.0%,表明实验所用P3代BMSCs纯化率在94.0%以上。
实验通过克隆形成和MTT生长曲线检测比较OVX组与sham组大鼠BMSCs增殖能力及倍增速度。克隆形成实验通过克隆形成率及克隆大小两个指标反应细胞增殖状况。实验结果显示,OVX组BMSCs克隆形成率低于sham组,OVX组BMSCs单克隆与sham组相比较小,且单克隆中单个干细胞生长状态较差,表明OVX组BMSCs较sham组增殖减弱。MTT生长曲线上,从总体趋势来看,OVX组曲线斜率小于sham组,其BMSCs倍增时间长于sham组,表明OVX组BMSCs增长速度降低。实验表明,从单个细胞增殖能力和细胞群体倍增时间两个方面来看,OVX组BMSCs增殖活性明显降低。研究表明,OP模型小鼠中,小鼠BMSCs增殖能力下降时,成骨能力减弱[9]。BMSCs增殖受到抑制时,可致去势大鼠快速骨量丢失[10]。
不同诱导条件下,BMSCs可向成骨细胞或成脂细胞分化[11]。本实验中,BMSCs成脂向诱导后,镜下可见有成串脂滴形成,经油红O染色,形成圆形光亮橙红色脂滴,表明干细胞成脂向诱导成功。钙化结节是成骨细胞分泌胶原结合钙盐而成,是鉴定干细胞向成骨细胞分化的重要标志。BMSCs成骨向诱导后,经茜素红染色成红褐色阳性钙化结节,表明干细胞成骨向诱导成功。OCN及OPN是BMSCs诱导成骨后的关键指标,反映成骨细胞的活性,在OP时OCN及ONP水平均有下降。Runx2是成骨细胞的特异转录因子,可通过结合成骨细胞特异性元件[12],调控OPN和OCN基因的表达,合成蛋白,实现骨形成。RT-PCR结果显示,去势后,成骨相关蛋白的mRNA水平均下调。
研究认为,OP的发生是干细胞成骨成脂分化能力不平衡[13]。研究发现OP患者BMSCs成骨分化能力减弱,成脂分化能力增强[3]。本实验表明,大鼠去势后,与sham组相比,OVX组大鼠BMSCs成脂能力明显增强,成骨能力明显减弱。OVX组大鼠BMSCs成骨诱导后,成骨标志性基因及蛋白如Runx2、OCN、OPN mRNA表达均有显著降低。在一定条件下,BMSCs成脂成骨向分化可以相互转化,且存在此消彼长关系[5],BMSCs成骨分化减弱时,可致去势大鼠症状加重或快速骨量丢失[10]。本实验中,OVX组大鼠BMSCs成骨向分化明显减弱,成脂向分化增强,同时也意味着成骨向分化的进一步减弱,在去势后大鼠骨量丢失过程中发挥着重要作用。
研究发现,信号通路Wnt /β-catenin经典通路调节并促进BMSCs增殖,促进BMSCs成骨向分化,抑制BMSCs成脂向分化[14]。Wnt /β-catenin信号通路通过β-catenin/Tcf-1介导的成骨性转录因子Runx2的活化促进骨的形成[15]。本实验采用去势大鼠与假手术大鼠比较,消除了去势时手术对大鼠的刺激因素,更好地显示去势后大鼠BMSCs增殖分化功能的改变;实验表明,去势大鼠BMSCs可能通过信号通路,如Wnt/β-catenin经典信号通路的抑制,降低其增殖及成骨向分化功能,增强成脂向分化功能,从而引起去势大鼠快速的骨量丢失;此三因素在去势后大鼠骨量丢失过程中联合作用,共同发挥着重要作用。
[1] Teitelbaum SL. Stem cells and osteoporosis therapy[J]. Cell Stem Cell, 2010, 7(5):553-554.
[2] Rodríguez JP, Ríos S, Fernández M, et al. Differential activation of ERK1,2 MAP kinase signaling pathway in mesenchymal stem cell from control and osteoporotic postmenopausal women[J]. J Cell Biochem, 2004, 92(4):745-754.
[3] Astudillo P, Ríos S, Pastenes L, et al. Increased adipogenesis of osteoporotic human-mesenchymal stem cells (MSCs) characterizes by impaired leptin action[J]. J Cell Biochem, 2008, 103(4):1054-1065.
[4] Nuttall ME, Gimble JM. Controlling the balance between osteoblastogenesis and adipogenesis and the consequent therapeutic implications[J]. Curr Opin Pharmacol, 2004, 4(3):290-294.
[5] Ahdjoudj S, Lasmoles F, Oyajobi BO, et al. Reciprocal control of osteoblast/chondroblast and osteoblast/adipocyte differentiation of multipotential clonal human marrow stromal F/STRO-1+cells[J]. J Cell Biochem, 2001, 81(1):23-38.
[6] Bian Q, Liu SF, Huang JH, et al. Oleanolic acid exerts an osteoprotective effect in ovariectomy-induced osteoporotic rats and stimulates the osteoblastic differentiation of bone mesenchymal stem cellsinvitro[J]. Menopause,2012,19(2):225-233.
[7] Sekiya I, Larson BL, Vuoristo JT, et al. Adipogenic differentiation of human adult stem cells from bone marrow stroma (MSCs)[J]. J Bone Miner Res, 2004, 19(2):256-264.
[8] Backesjo CM, Li Y, Lindgren U. Activation of Sirt1 decreases adipocyte formation during osteoblast differentiation of mesenchymal stem cells[J]. J Bone Miner Res, 2006, 21(7):993-1002.
[9] Chen XD, Shi S, Xu T, et al. Age-related osteoporosis in biglycan-deficient mice is related to defects in bone marrow stromal cells[J]. J Bone Miner Res, 2002, 17(2):331-340.
[10]Miura M, Chen XD, Allen MR, et al. A crucial role of caspase-3 in osteogenic differentiation of bone marrow stromal stem cells[J]. J Clin Invest, 2004, 114(12):1704-1713.
[11]Nishimura R, Hata K, Ikeda F, et al. Signal transduction and transcriptional regulation during mesenchymal cell differentiation[J]. J Bone Miner Metab, 2008, 26(3):203-212.
[12]de Crombrugghe B, Lefebvre V, Nakashima K. Regulatory mechanisms in the pathways of cartilage and bone formation[J]. Curr Opin Cell Biol, 2001, 13(6):721-727.
[13]Rosen CJ, Bouxsein ML. Mechanisms of disease: is osteoporosis the obesity of bone?[J]. Nat Clin Pract Rheumatol, 2006, 2(1):35-43.
[14]Zmuda JM, Yerqes LM, Kammerer CM, et al. Association analysis of WNT10B with bone mass and structure among individuals of African ancestry[J]. J Bone Miner Res, 2009, 24(3):437-447.
[15]Zhang C, Cho K, Huang Y, et al. Inhibition of Wnt signaling by the osteoblast-specific transcription factor Osterix[J]. Proc Natl Acad Sci U S A, 2008, 105(19):6936-6941.
Proliferationanddifferentiationofbonemarrowmesenchymalstemcellsinprocessofbonelossinovariectomizedrats
LIANG Shi-zhen1, WANG Guo-xuan2, FAN Long-kun2, WU Gao-yi3, JIN Yan4, ZHU Guo-xiong3
(1DepartmentofStomatology,JinanMilitaryGeneralHospital,PostgraduateTrainingBaseofLiaoningMedicalUniversity,Jinan250031,China;2PostgraduateCollege,LiaoningMedicalUniversity,Jinzhou121001,China;3DepartmentofStomatology,JinanMilitaryGeneralHospital,Jinan250031,China;4SchoolofStomatology,FourthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:jnjqzgx@163.com)
AIM: To study the function of proliferation and differentiation of bone marrow mesenchymal stem cells (BMSCs) for bone loss in the pathogenesis of osteoporosis (OP) in ovariectomized rats.METHODSAnimal model of OP was established by ovariectomy (OVX,bilateral ovarian resection) in 10-week-old healthy female Sprague-Dawley (SD) rats.BMSCs were isolated, cultured and purified by the combination of density gradient centrifugation, adhesion separation and limited dilution method, and culturedinvitroto the 3rd~4th passage in all experiments. The BMSCs phenotype appraisal was studied by flow cytometry. Colony-forming assay was applied to detect the BMSCs proliferation ability. The MTT method was used to analyze the growth curves of BMSCs. After adipogenic induction (ADI), lipid drops were observed by oil red O staining to compare the adipogenic potential between the 2 kinds of BMSCs. After osteogenic induction (OSI), calcium nodules were observed by alizarin red staining (ARS). The mRNA expression levels of BMSCs osteogenesis-related proteins, for instance, Runx2, osteocalcin (OCN) and osteopontin (OPN) were measured by RT-PCR.RESULTSCompared with sham group, the colony-forming ability of BMSCs in OVX group became decreased, the proliferation capacity was declined, the osteogenic potential was decreased, and the adipogenic potential was increased(P<0.05).CONCLUSIONIn ovariectomized OP rats, the proliferation and osteogenesis of BMSCs decrease, and the adipogenesis of BMSCs increases, which may cause rapid bone loss and play an important role in the pathogenesis of OP.
Bone marrow mesenchymal stem cells; Ovariectomy; Rats; Osteogenesis; Adipogenesis
R361+.3
A
10.3969/j.issn.1000-4718.2012.03.003

