硫酸钡-比浊法测定褐藻糖胶中硫酸根的含量
陈 乾,马天翔,郭宏举,史 宁,吴久鸿(1.安徽医科大学,安徽 合肥 30000;.解放军第306医院,北京 100101)
国家自然科学基金项目(3077263).
陈 乾(1982-),男, 药师,硕士研究生.
吴久鸿.Tel: (010)64879825, E-mail:jiuhongwu@hotmail.com.
硫酸钡-比浊法测定褐藻糖胶中硫酸根的含量
陈 乾1.2,马天翔2,郭宏举2,史 宁2,吴久鸿2
(1.安徽医科大学,安徽 合肥 230000;2.解放军第306医院,北京 100101)
目的运用硫酸钡比浊法测定日高昆布中褐藻糖胶硫酸根的含量。方法采用硫酸钡比浊法,通过分光光度计检测到最大吸收波长为360 nm;在此波长下测定褐藻糖胶中硫酸根的含量。结果硫酸根在60~120 μg范围内线性关系良好(r2=0.990 9),测得褐藻糖胶中硫酸根的含量为(20.52±0.57)%;方法学符合测定要求。结论该方法简单、准确、快速、灵敏度较高,适用于海藻多糖硫酸根含量的测定。
褐藻糖胶;硫酸根;硫酸钡比浊法
褐藻糖胶(fucoidan)又名褐藻多糖硫酸酯(sulfated fucans,FPS) ,是一种水溶性的硫酸杂多糖,普遍存在于褐藻中(如海带、昆布、羊栖菜、裙带菜等)。它是褐藻中所固有的细胞间质多糖具有抗凝血、抗辐射、抗病毒、抗肿瘤及调节免疫功能等多种重要的生物活性[1~5],而硫酸根的存在对褐藻糖胶的物理化学性质及生物活性都有重要影响。因此,定性、定量测定褐藻糖胶的硫酸根,对于鉴定褐藻糖胶样品及分析构效关系都有重要意义。常用的分析方法有硫酸钡-比浊法、硫酸钡-重量法、离子色谱法、联苯胺法等[6]。这些方法中硫酸钡-比浊法、硫酸钡-重量法是最常用、最经典的方法,硫酸钡-重量法操作比较复杂而硫酸钡-比浊法操作简单,在普通实验室就可进行且测定结果可靠稳定,故而本实验选择硫酸钡-比浊法测定日高昆布中褐藻糖胶硫酸根含量。
1 材料与方法
1.1实验材料
1.1.1试剂 日高昆布购于日本北海道,经上海市自然博物馆杭金欣副研究员鉴定为LaminariajaponicaAresch;硫酸钾、三氯乙酸、氯化钡、明胶、浓盐酸、乙醇等均为国产分析纯,购于国药集团化学试剂北京有限公司。
1.1.2仪器 BS110S、BS323S型电子天平(德国赛多利斯集团);台式离心机(上海安亭科学仪器厂);UV-2000型紫外分光光度计(上海洪富仪器仪表有限公司);DZF-6020型真空干燥箱(上海一恒科技有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂)。
1.2试验方法
1.2.1褐藻糖胶的提取 取日高昆布,清水洗净,风干后磨成粉末过20目筛。称取215 g的日高昆布藻粉用石油醚1 500 ml、90 ℃回流1 h,脱脂2次,离心(4 000 r/min,10 min)分离,沉淀挥发溶剂后,加入昆布质量15倍的pH值为2的15 g/L氯化钙溶液60 ℃浸提1.5 h。取上清液浓缩加乙醇至体积分数为65%沉淀,沉淀用乙醇和丙酮浸洗再离心,40 ℃干燥,得褐藻糖胶粗多糖16.16 g,得率为7.55%;粗多糖配制成2%多糖水溶液,用Sevag法去除粗多糖中的蛋白质,离心除去不溶物,加乙醇至体积分数为20%,离心除去沉淀,上清液继续加乙醇至60%,离心,得沉淀;然后对60%乙醇沉淀物进行重新沉淀,先加乙醇至体积分数为30%,留上清液去除沉淀,再加乙醇至体积分数为70%,溶液呈半胶体,加入1 ml 10%氯化钠溶液后,迅速有白色絮状沉淀产生,沉淀用无水乙醇及丙酮浸洗,40 ℃真空干燥得纯化的褐藻糖胶2.13 g,得率为0.994%[7,8]。
1.2.2褐藻糖胶样品的处理 称取褐藻糖胶样品10 mg,于具塞试管,加入1 mol/L盐酸溶液5 ml于110 ℃加热水解8 h,冷却后,8 000 r/min离心20 min,过滤,保存备用。
1.2.3紫外光谱的测定 精密称取105 ℃干燥至衡重的硫酸钾108.75 mg,以1 mol/L的盐酸溶解,定容置100 ml容量瓶中,摇匀,即得硫酸根标准贮备液(SO42-=0.60 mg/ml);取硫酸盐标准溶液0.2 ml,加三氯乙酸3.8 ml和氯化钡溶液1 ml,混匀,进行紫外光谱测定;结果硫酸钾在360 nm处显最大吸收峰。如图1所示。
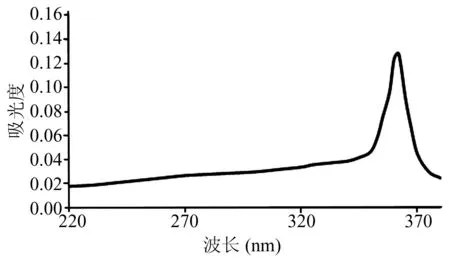
图1 硫酸盐的紫外光谱图
1.2.4标准曲线绘制 分别精密吸取硫酸盐标准溶液0、0.04、0.08、0.10、0.12、0.16、0.20 ml于试管,各以盐酸溶液补至0.20 ml;以0.2 ml盐酸溶液作为空白,加三氯乙酸3.8 ml和氯化钡溶液l ml,混匀,室温静置25 min,于360 nm测吸收度A1;以5%的明胶溶液1.0 ml代替氯化钡溶液依法操作,测吸收度A2,以硫酸根mg数为横坐标,纵坐标为吸收度(A1-A2)值,得标准曲线,确定线性范围。其中每点做3个平行样品,取平均值。
1.2.5硫酸根含量的测定 吸取样品溶液0.2 ml,按标准曲线的制作方法,测吸收度(A1-A2)值,根据标准曲线及换算因子计算硫酸根含量。
2 实验结果
2.1线性范围 标准曲线吸光度值见表1。以吸光度吸收度(A1-A2)值对硫酸根(mg)数进行线性回归,得回归方程A=0.877 4C-0.004 500,r2=0.990 9;SO42-在60~120 μg 范围内线性关系良好。
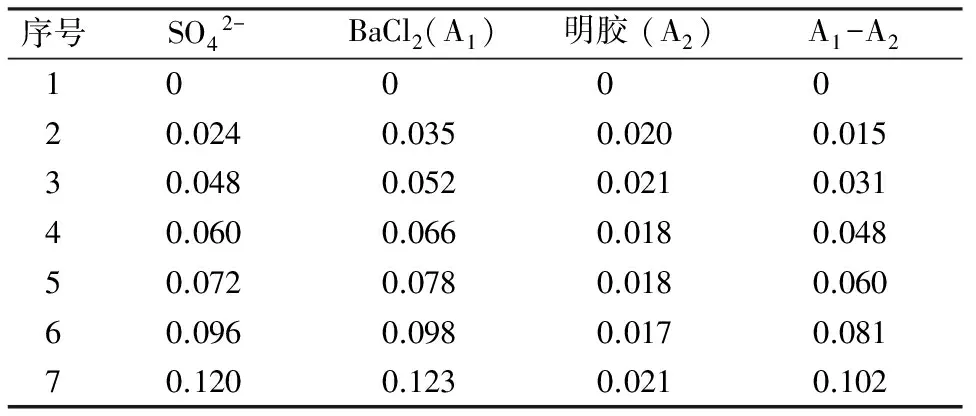
表1 硫酸盐标准样品溶液的吸光度值(n=3)
2.2测定时间确定 取新鲜配制样品溶液0.2 ml,按标准曲线的操作方法操作,在不同时间检测同一样品SO42-含量,稳定实验结果如图2所示。结果同丛建波[9]、宫春宇等[10]报道的稍有不同,即在15~40 min之间测量结果比较稳定。本实验选择测定时间为25 min。
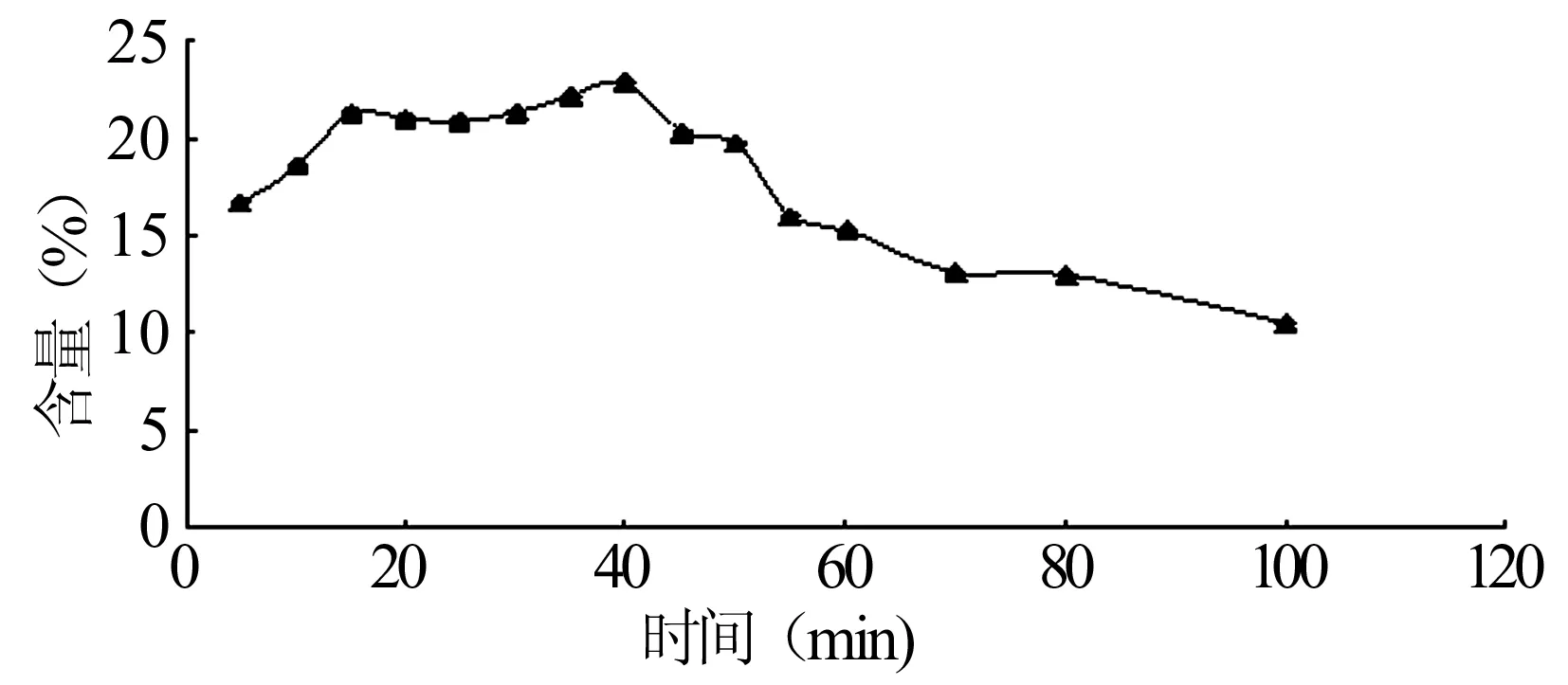
图2 不同时间褐藻糖胶样品中SO42-含量测定
2.3重复性试验 在不同时间分别取新鲜配制3批样品溶液各0.2 ml,按标准曲线的操作方法检测SO42-的含量,检验该方法的重复性。测定结果见表2。结果显示,不同时间检测样品溶液SO42-含量没有明显差别,说明重复性较好;水解样品在25 h内测定差异较小(RSD=2.58%)。
2.4换算因子(f)测定 精密吸取硫酸盐标准溶液0.15 ml,按标准曲线的操作方法,测吸收度(A1-A2)值,由回归方程求供试液中SO42-的含量,根据f=w/c计算换算因子f=1.02(W为所取SO42-质量,C为SO42-测定质量)。
2.5回收率试验 为检验本方法的准确性和可靠性,要进行回收率实验。测定方法如下:取硫酸盐标准溶液和褐藻糖胶样品水解液组成2 ml加样样品液,然后吸取此加样样品液0.2 ml,按标准曲线的制作方法,测吸收度(A1-A2)值,由回归方程测定加样样品液硫酸根量,计算回收率。测定结果见表3。
回收率=[实测硫酸根(量)-样品中的硫酸根(量)]/加入硫酸根标准贮备液(量)
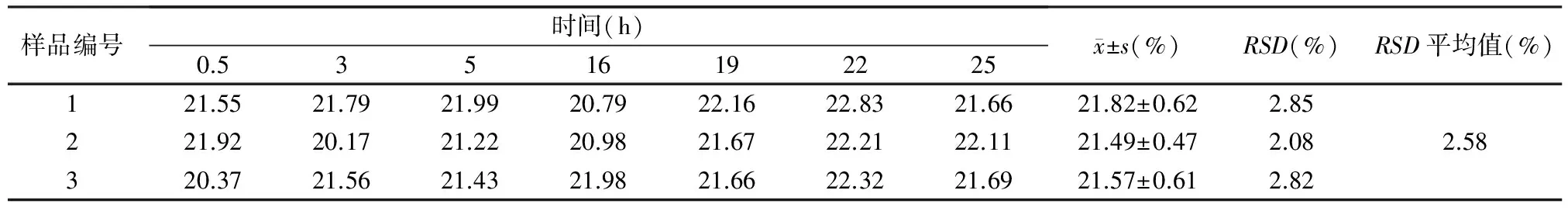
表2 3批褐藻糖胶样品中SO42-的含量测定结果(%)
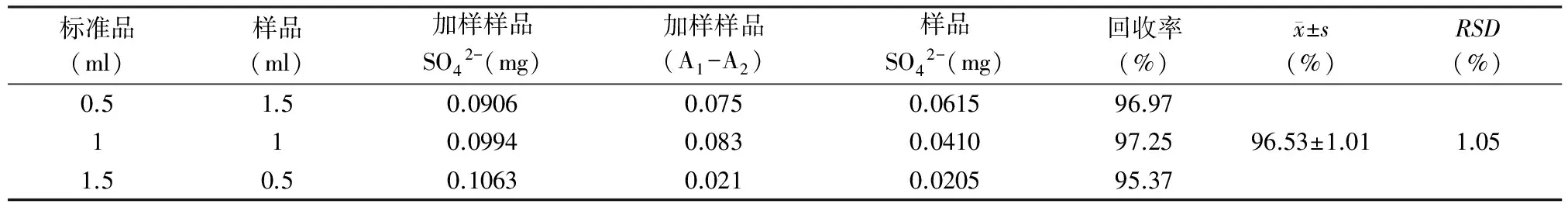
表3 褐藻糖胶回收率检测试验结果
2.6样品硫酸根含量测定 吸取样品液0.2 ml,按标准曲线的制作方法,测吸收度(A1-A2)值,根据标准曲线及换算因子计算硫酸根含量。其中,每个样品测3次,取平均值。硫酸根含量(%)=[f×(C/0.2)×V/W]×100%,其中f为换算因子,C为样品测定值(mg),V为样品水解液总体积,W为初始样品质量。结果见表4。
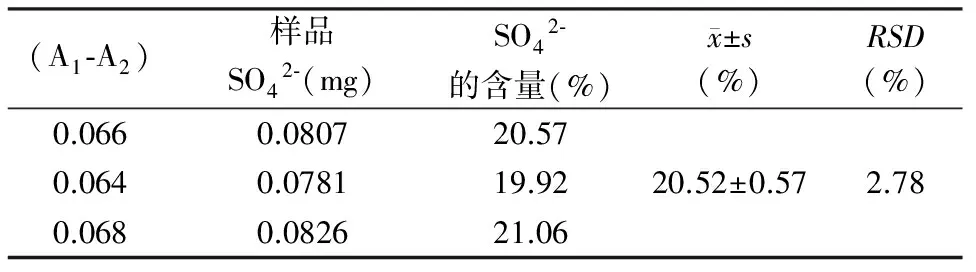
表4 褐藻糖胶的硫酸根含量测定结果
3 讨论
3.1明胶中含有微量杂质,当加入氯化钡配置l%氯化钡-0.5%明胶溶液时,溶液成轻微乳浊液状,可能是明胶中含有微量杂质同钡离子形成沉淀所致。因此,要离心处理l%氯化钡-0.5%明胶溶液,这样不仅可以获得良好的重复性而且还可以保证测定结果的准确性、可靠性和稳定性。重复性试验所用的硫酸盐标准溶液、褐藻糖胶样品液都必须现配才能减少测量误差。
3.2运用硫酸钡比浊法测定日高昆布中褐藻糖胶硫酸根的含量时,采用离心l%氯化钡-0.5%明胶溶液,硫酸根在60~120 μg范围内线性关系良好(r2=0.990 9);有文献报导[11],硫酸钡比浊法测SO42-的含量时,SO42-的含量在0~120 μg范围内呈良好的线性关系。稳定性试验显示15 min前SO42-的含量会随着时间的增长而增大,15~40min之内SO42-的含量比较稳定,而40 min以后随时间的增长而降低,因此,本实验选择测定时间为25 min时检测;测得日高昆布中褐藻糖胶硫酸根含量为(20.52±0.57)%,RSD=2.78%,方法学符合测定要求。
[1] Wang J, Zhang QB, Zhang ZS.etal.Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted from Laminaria japonica[J]. Int J Biol Macromol,2010, 46(1):6.
[2] 陈 乾,吴久鸿,郭宏举.褐藻糖胶对60Co-γ射线照射引起的人外周血淋巴细胞微核率的影响[J].解放军药学学报,2011,27(5):383.
[3] Lee J, Kim J, Moon C.etal.Radioprotective effects of fucoidan in mice treated with total body irradiation[J].Phytother Res,2008,22(12):1677.
[4] Ponce NM, Pujol CA, Damonte EB.etal. Fucoidans from the brown seaweed Adenocystis utricularis: extraction methods, antiviral activity and structural studies[J].Carbohydr Res,2003,338(2):153.
[5] 王 君,胡霞敏.海藻提取物Fucoidan抗肿瘤作用的实验研究[J].时珍国医国药,2009, 20(7):1757.
[6] 樊文乐,武文洁.褐藻糖胶中硫酸根质量分数的测定方法[J].化学工业与工程技术,2005,26(5):47.
[7] 肖 策,李多伟,逄敏洁.从海带中提取褐藻糖胶工艺的研究[J].西北药学杂志,2008,23(4):212.
[8] 余 华.海带多糖中蛋白质去除方法的对比研究[J].成都大学学报:自然科学版,2005,24(4):265.
[9] 丛建波,王长振,李 妍.褐藻硫酸多糖硫酸基含量测定-硫酸钡比浊法研究[J].解放军药学学报,2003,19(3):181.
[10] 宫春宇,潘迎捷.硫酸钡比浊法对龙须菜多糖中硫酸基含量的测定[J].天然产物研究与开发,2009,21(B10):402.
[11] 张维杰.糖复合物生化研究技术[M] .第2版.杭州:浙江大学出版社,1999:91~92.
Determinationofthesulfatecontentinsulfatedfucansbybariumsulfateturbidity
CHEN Qian1.2, MA Tian-xiang2, GUO Hong-ju2, SHI Ning2, WU Jiu-hong2
(1.Anhui Medical University, Hefei 230000, China; 2.306th Hospital of PLA, Beijing 100101, China)
ObjectiveTo determine the sulfate content in sulfated fucans (FPS) by Barium sulfate turbidity.MethodsWith spectrophotometer at 360 nm, the sulfate content was determined by Barium Sulfate Turbidity.ResultsThere was a good linearity (r2=0.990 9) when the sulfate content was within the range of 60~120 μg. Sulfate content of FPS was (20.52±0.57)% under the determination method.Methodology met the measurement requirement.ConclusionThe method was proved to be reliable, quick, sensitive and applicable.
fucoidan; sulfated content; barium sulfate turbidity
R927.2
A
1006-0111(2012)02-0118-03
10.3969/j.issn.1006-0111.2012.02.011
2011-09-15
[修回日期] 2011-12-01

