真核延长因子eEF1A功能研究进展
程 君,芮耀诚(第二军医大学药学院药理学教研室,上海 200433)
程 君(1986-),女,硕士研究生.Tel:15921847826,E-mail:chengjun7826@163.com.
芮耀诚.Tel:(021)81871273,E-mail:ruiyc@smmu.edu.cn.
真核延长因子eEF1A功能研究进展
程 君,芮耀诚
(第二军医大学药学院药理学教研室,上海 200433)
真核延长因子(eEFs)是一类在蛋白质合成过程中发挥肽链延伸作用的重要分子,在真核生物体内它有eEF1和eEF2两个亚型。其中在肽链延伸过程中起主要作用的eEF1A 是eEF1的一个亚型,它不但能促进氨酰基-tRNA(aa-tRNA)与核糖体的A位点结合,发挥肽链延伸功能;而且近年来大量的研究表明它在细胞凋亡、肿瘤的发生、细胞内信号转导及心血管系统的调节方面均发挥了重要作用,而且这些作用与它在蛋白合成中的功能无关;这表明eEF1A是一个多功能蛋白,能够成为一个潜在的疾病防治的靶点。本文就国内外近几年来有关eEF1A的研究做一综述,介绍真核延长因子eEF1A功能研究的进展。
真核延长因子eEF1A;蛋白合成;细胞凋亡;肿瘤;心血管系统
蛋白质的翻译是一个非常复杂的过程,需要多种因子的参与才能完成,主要可分为起始、延长、中止3个阶段,其中真核延长因子(eukaryotic elongation factors,eEFs)在延长过程中发挥了重要作用。eEFs是真核细胞内蛋白质合成翻译过程中的一类重要蛋白质,在细胞内广泛存在。真核生物体内,eEFs主要有两种类型:eEF1与eEF2。eEF1负责将氨酰基-tRNA转运到核糖体上,eEF2主要催化延长的肽链在核糖体上的转位。eEF1有eEF1A和eEF1B两个亚型,eEF1A是一个GTP结合蛋白,能促进氨酰基-tRNA与核糖体的A位点结合,发挥促进肽链延伸的作用。eEF1B是一种核苷酸交换因子,催化eEF1A-GDP转换为eEF1A-GTP的活性形式,恢复eEF1A转运酰基-tRNA的活性。
eEF1A是一个多功能蛋白,除了在蛋白翻译延长过程中发挥重要作用外,近年来有关eEF1A的其它非经典作用成为了人们研究的热点。大量的研究表明,它与细胞凋亡、信号转导、心血管系统及肿瘤的发生发展等一系列生理病理过程均有密切关系[1]。下面就eEF1A蛋白的特点及其功能做一综述。
1 eEF1A的结构特点
eEF1A是真核生物体内除肌动蛋白之外含量第二多的蛋白,占总蛋白量的1%~3%,且具有高度保守性。不同生物的eEF1A序列相似,其生物学功能也非常相似[2]。在细菌体内它又称为EF-Tu。eEF1A含有三个空间构象和功能都不同的结构域:domain I,II,III,其中Domain I与GTP结合,Domain II与酰基-tRNA结合,domainII 和domain III还共同参与和细胞内的肌动蛋白的结合[3]。
eEF1A由一个多基因家族编码,在不同的物种中,可编码eEF1A的基因数目也不同。在大肠杆菌中,它有2个编码基因;在水稻中,则有4个编码基因;在玉米中它有10~15个的编码基因[4]。在人类eEF1A有2个不同的异构体:eEF1A1和eEF1A2,分别由在6号和20号染色体上的不同基因编码。二者在氨基酸组成上有92%的相似性,在蛋白延长中的功能也相似[5]。但是在生物体生长发育的不同阶段,这两种亚型的表达却存在较大的差异。eEF1A1在胚胎发育过程中,表达很广泛,但在新生的肌肉组织中表达下调。出生后21 d的小鼠肌肉组织中,则检测不到eEF1A1的表达,eEF1A2完全取代了eEF1A1的表达。研究表明,在胚胎时期的小鼠神经元中, eEF1A1呈高水平表达并随着发育而不断下降,小鼠出生1周后,它的表达明显下降,出生后26 d则停止表达。相反,eEF1A2只在骨骼肌、心脏和神经元中表达,其他组织中没有表达。在发育后期,神经元、心脏、骨骼肌系统中,eEF1A1逐渐转换为eEF1A2的表达形式[6]。但这两种基因表达的组织特异性有何生理意义尚不清楚。有研究证实,eEF1A2的表达可能与组织的终末分化有关联[7]。
2 eEF1A的生物学功能
2.1eEF1A与蛋白合成 在蛋白质合成的延伸阶段,eEF1A 首先与GTP结合被激活,并进一步与氨酰基-tRNA结合,形成三元复合物。在核糖体上,eEF1A-GTP-tRNA上携带的反密码子与核糖体A位点上的mRNA的密码子互补配对,并促进氨酰基-tRNA结合到A位点,此过程引发核糖体水解GTP,eEF1A-GDP复合物从核糖体解离。在核苷酸交换因子eEF1B的作用下,eEF1A-GDP转换为eEF1A-GTP的活性形式,继续转运氨酰基-tRNA参与肽链的延伸[8]。核糖体P位点的多肽在肽酰转移酶的作用下转移至A位氨酰基-tRNA的氨基酸上,形成新的肽键;多肽-tRNA在A位点,脱酰基后的tRNA在P位点。延长后的多肽-tRNA从A位点到P位点由eEF2催化。eEF2与eEF1A一样,也是一个GTP结合蛋白;GTP水解后,复合物eEF2离开核糖体,一个延伸周期结束并开始新的周期[9],其延伸过程见图1。
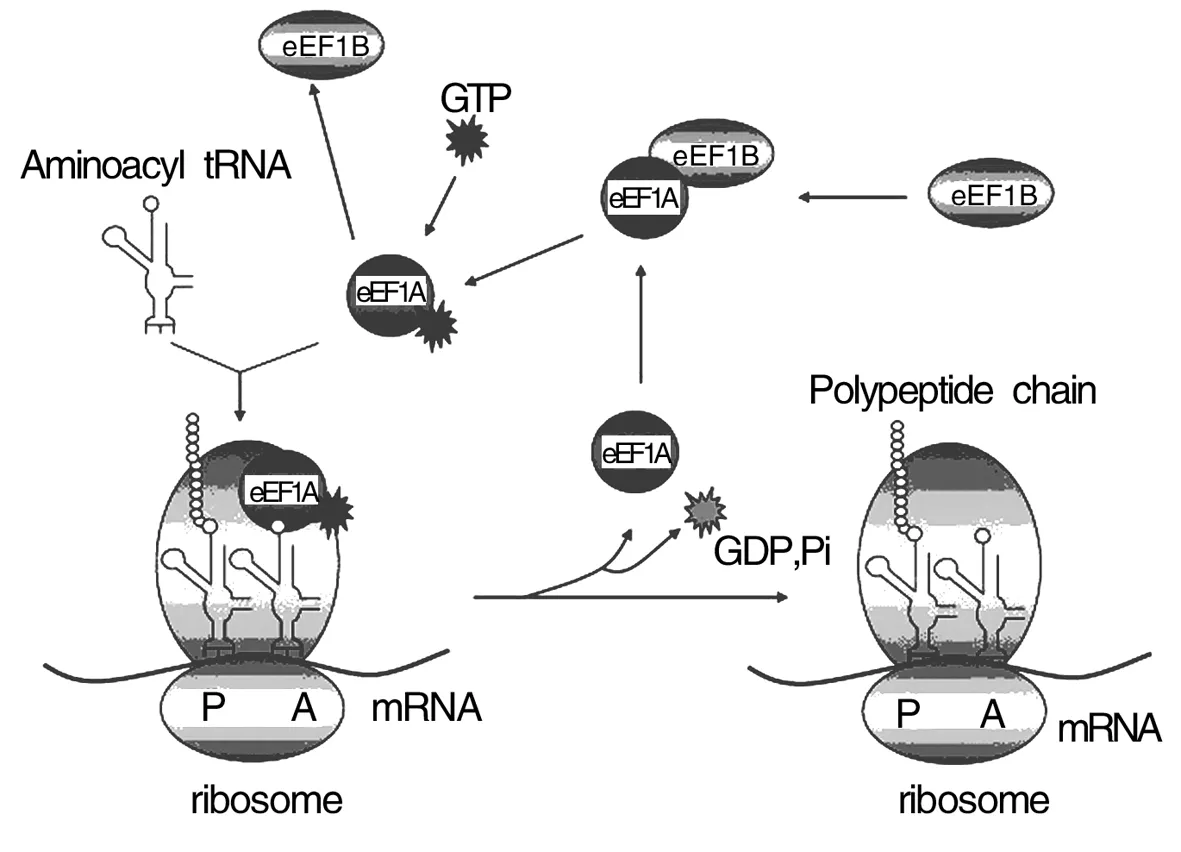
图1 eEF1参与蛋白质合成的肽链延伸过程
2.2eEF1A与细胞凋亡 eEF1A能调节细胞凋亡,研究发现:在体外培养的微管实验中,eEF1A1有促进凋亡的作用,而eEF1A2则有抗凋亡的活性,这表明这两种异构体在发挥蛋白翻译功能之外的方面还具有互补的功能[10]。Borradaile等[11]研究eEF1A1在脂毒性引起的细胞凋亡中发挥重要作用。在对棕榈酸诱导的凋亡有抵抗作用的仓鼠体内,分离出一种功能失调的eEF1A1,这种eEF1A1在其碱基相关部位有碱基突变,而且用其上下游引物扩增全长,产物进行琼脂糖凝胶电泳不能显示条带。该研究已经证实了在大鼠心肌细胞中eEF1A1参与棕榈酸引起的高脂质模型中细胞凋亡过程;用eEF1A1的siRNA干扰其表达之后能够抑制棕榈酸对心肌细胞引起的脂毒性,这些都表明eEF1A1在细胞对脂质堆积引发的细胞凋亡中发挥了正向调节作用。进一步研究发现棕榈酸是通过引起细胞内氧化应激和内质网应激而诱导细胞凋亡的。在野生型的仓鼠和大鼠心肌细胞中,棕榈酸诱导氧化应激反应,也伴随着eEF1A1表达的增加。在过氧化氢诱导的凋亡的大鼠心肌细胞中,eEF1A的表达持续升高;eEF1A1表达的降低能抑制过氧化氢和内质网应激诱导的心肌细胞的凋亡作用,在此类凋亡过程中,eEF1A1调节细胞凋亡与蛋白合成无关,因为细胞eEF1A1表达水平的改变并不伴随着蛋白合成的量发生变化。有研究表明[12],eEF1A1是通过与细胞内肌动蛋白微丝结合,破坏了细胞的骨架结构从而促使细胞凋亡。此外,也有研究表明:在生长因子缺乏诱导的细胞凋亡中,eEF1A有抗凋亡作用,但它不能抑制紫外辐射等诱导的核损伤介导的细胞凋亡 。
最近研究还发现,eEF1A参与由TNF-α刺激等引起的单核巨噬细胞的凋亡。干扰素诱导蛋白(interferon-induced protein with tetratricopeptide repeats-1,IFIT-1)是一个在病毒感染细胞时产生的蛋白,它能抑制病毒的增殖。研究发现,在LPS、IL-1、TNF-a等非病毒性因素刺激时,IFIT-1的表达也升高,该研究还发现TNF-α 刺激的单核巨噬细胞中eEF1A1的表达升高,体外pull-down试验、体内激光共聚焦和免疫共沉淀试验均证实了IFIT-1是通过与eEF1A相互作用,发挥促进细胞凋亡的作用[13]。
2.3eEF1A与肿瘤 eEF1A1与前列腺肿瘤、肝脏肿瘤的发生等均有关系。前列腺肿瘤诱导基因1(The prostate tumor-inducing gene 1,PTI-1)是一类在前列腺肿瘤细胞中表达而在正常细胞中缺失的基因。研究表明它是eEF1A1基因的一个剪切体。它的全长基因中有1494bp与人类eEF1A有97.7%的相似性。PTI-1编码一个含有398个氨基酸的蛋白,与eEF1A1序列相比:它缺少了前面的67个氨基酸,在N端新增了3个氨基酸,含有6个点突变。在PTI-1过表达的细胞中,用Western blot的方法也能检测到eEF1A1的表达。这些表明eEF1A1可能在前列腺肿瘤的发生发展中起作用[14]。Zhang等[15]研究发现,在HepG2和Hep3B肿瘤细胞中,骨桥蛋白(osteopontin,OPN)是一种能够增加细胞迁移和浸润,诱导肿瘤相关炎性因子和血管生成的磷酸化蛋白。eEF1A1能与OPN的5′-非翻译区(UTR)相互作用而影响OPN-mRNA的半衰期,进而影响OPN-mRNA的稳定性,这种作用是肌动蛋白(actin)依赖性的,而且在HepG2和Hep3B肿瘤细胞中作用的结果是相反的。这提示我们eEF1A在参与肿瘤的过程中有可能是通过与细胞骨架的结合力发生改变而调节细胞的迁移状态。
近年来,eEF1A2被证实了是一个癌基因,有研究显示它在大部分的卵巢癌和2/3的乳腺癌组织中过度表达,在正常组织中则很难检测到它的表达,而且在上述肿瘤中eEF1A2在mRNA水平上表达也较正常组织明显升高。当正常卵巢细胞转染表达了eEF1A2之后,这些细胞具有肿瘤细胞的特性,且易生长成为肿瘤细胞。有研究发现eEF1A2促进肿瘤发生可能与它能够抑制细胞凋亡及细胞骨架重塑有关[16,17]。
2.4eEF1A与心血管系统 近年来,已有研究发现eEF1A在心血管系统中有参与。NO是心血管系统中一种重要的调节因子。人血管内皮一氧化氮合酶(endothelial NO synthase,eNOS)能催化L-精氨酸氧化生成NO,eNOS活性的异常与心血管系统的疾病的发生密切相关[18]。Yan等[19]人首次发现TNF-α可通过与eEF1A1相互作用,调节eNOS的mRNA的稳定性从而发挥其下调eNOS表达的作用。长久以来,研究已证实TNF-α能够抑制eNOS的表达,而且是通过降低其mRNA的稳定性来实现的。其中eNOS的mRNA的3′-非翻译区(3′-UTR)在转录后mRNA的稳定性方面发挥了重要作用。eEF1A1与eNOS mRNA的3′-UTR作用后,能缩短其半衰期从而降低其稳定性。该实验还证实了过表达eEF1A1能够显著降低eNOS的表达水平;相反,eEF1A1表达被抑制之后,TNF-α诱导的降低eNOS表达水平被显著抑制。这些试验都说明了eEF1A1在eNOS的表达水平方面发挥了重要的调节作用。
TNF-α通过eEF1A1下调eNOS mRNA稳定性而抑制eNOS的表达,能引起血管功能异常,从而引发动脉粥样硬化、糖尿病、心力衰竭等重大心血管疾病[20,21]。这也提示我们eEF1A1在心血管系统中可能具有重要的调节作用,为我们在心脑血管疾病的防治中提出了新的靶点和思路。
2.5eEF1A与信号转导和细胞骨架 研究表明eEF1A能够与Rho-相关激酶、Rho-GTPase激活蛋白、磷脂酶C、鞘氨醇激酶等在信号调节方面发挥重要作用的酶作用,并改变其酶活性;或者改变eEF1A与细胞内肌动蛋白、微管的结合与聚集能力,进一步调节细胞内应力纤维、粘附斑等细胞内骨架的形成,细胞的聚集,钙调素介导的细胞间的粘附;从而在细胞骨架和细胞形态方面发挥重要的调节作用[22,23]。最近有文章报道,eEF1A在神经系统疾病中有参与。帕金森病是一种常见的神经元退行性疾病。其中富亮氨酸重复序列激酶(leucine-rich repeat kinase2,LRRK2) 基因突变引起的激酶活性异常是引起遗传性帕金森疾病的最常见原因。该试验通过免疫共沉淀的方法发现了LRRK2编码的蛋白能与eEF1A相互作用,这种作用的结果导致LRRK2激酶活性降低,eEF1A介导的微管聚集活性也受到抑制,由此引起细胞骨架微管和eEF1A在神经元内的lewy小体内聚集,可能引起帕金森病的病理过程[24]。
eEF1A还参与细胞内其它重要生理过程。研究证实它与蛋白折叠有关,细胞内新合成的肽链从核糖体上解离之后,需要在分子伴侣的作用下经过正确的折叠并采取一定的空间构象才能被运输到其作用部位发挥作用。对于那些不能正确折叠的肽链,eEF1A能与其结合并促进其正确折叠,可以看出eEF1A在维持细胞内环境的稳定方面有重要作用[25]。eEF1A还与RNA共同参与了对热休克过程中起重要作用的热休克转录因子-1(HSF-1)的调节[26]。
综上所述,eEF1A是一个表达非常丰富,在细胞中功能非常复杂的蛋白。目前对eEF1A1的研究已比较广泛深入,但对于其异构体eEF1A2的研究还有待继续深入。大量的蛋白质组学研究已表明,eEF1A能与细胞内许多分子相互作用,调节细胞内重要生理过程和机制。这表明eEF1A可能是一个参与细胞调节的重要的中间分子。进一步研究其功能,将可以深入了解它在一些心血管系统疾病、脂质堆积等代谢性疾病、肿瘤及细胞骨架重构方面发挥的作用,为这些疾病的防治提出新的思路。
[1] Lamberti A,araglia M,longo O,etal.The translation elongation factor 1A in tumorigenesis, signal transduction and apoptosis[J]. Amino Acids,2004,26(4):443.
[2] Infante C,sensio E,aavate JP,etal. Molecular characterization and expression analysis of five different elongation factor 1 alpha genes in the flatfish Senegalese sole (Solea senegalensis Kaup): Differential gene expression and thyroid hormones dependence during metamorphosis[J]. BMC Mol Biol,2008,9:19.
[3] Maria K,Mateyak,Kinzy TG. eEF1A: Thinking outside the ribosome[J]. J Biol Chem,2010,5(4):432.
[4] Ejiri Shin ichiro. Moonlighting functions of polypeptide elongation factor 1:from actin bundling to zinc finger protein r1-associated nuclear localization[J]. Biotechnol Biochem,2002,66(1):1.
[5] Khalyfa A,Bourbeau D,Chen E,etal. Characterization of Elongation Factor-1A (eEF1A-1) and eEF1A-2/S1 Protein Expression in Normal and wasted Mice[J]. J Biol Chem,2001,276(25):22915.
[6] Newbery HJ,Loh DH,Donoghue JE,etal. Translation elongation factor eEF1A2 is essential for post-weaning survival in mice[J]. J Biol Chem,2007,282(39):28951.
[7] Pan J,Ruest LB,Xu SY,etal. Immuno-characterization of the switch of peptide elongation factors eEF1A-1/EF-1a and eEF1A-2/S1 in the central nervous system during mouse development[J]. Dev Brain Res,2004,149:1.
[8] Andersen GR,Nissen P,Nyborg J. Elongation factors in protein biosynthesis[J]. Trends Biochem Sci,2003,28(8):434.
[9] Villa E,Sengupta J,Trabuco LG,etal. Ribosome-induced changes in elongation factor Tu conformation control GTP hydrolysis[J]. Proc Natl Acad Sci,2009,106(4):1063.
[10] Ruest LB,Marcotte R,Wang E. Peptide elongation factor eEF1A-2/S1 expression in cultured differentiated myotubes and its protective effect against caspase3-mediated apoptosis[J]. J Biol Chem,2002,277(7):5418.
[11] Borradaile NM, Buhman KK, Listenberger LL,etal. A critical role for eukaryotic elongation factor 1A1 in lipotoxic cell death[J]. Mol Biol Cell,2006,17:770.
[12] Talapatra1 S,Wagner J,Thompson CB. Elongation factor-1 alpha is a selective regulator of growth factor withdrawal and ER stress-induced apoptosis[J]. Cell Death and Differ, 2002,9:856.
[13] Li HT,Su YP,Cheng TM,etal. The interaction between interferon-induced protein with tetratricopeptide repeats-1 and eukaryotic elongation factor-1A[J]. Mol Cell Biochem,2010, 337:101.
[14] Mansillaa F,Hansenb LL,Jakobsena H,etal. Deconstructing PTI-1: PT1-1 is a truncated, but not mutated form of translation elongation factor 1A1, eEF1A1[J]. Biochim Biophys Acta ,2005,1727(2):116.
[15] Zhang JP,Guo HT,Mi ZY,etal. EF1A1-actin interactions alter mRNA stability to determine differential osteopontin expression in HepG2 and Hep3B cells[J]. Exp Cell Res,2009,315:304.
[16] Anand N,Urthy S,Mann G,etal.Protein elongation factor eEF1A2 is a putative oncogene in ovarian cancer[J]. Nat Genet,2002,31:301.
[17] Tomlinson VA,ewbery HJ,ray NR,etal. Translation elongation factor eEF1A2 is a potential oncoprotein that is overexpressed in two-thirds of breast tumours[J]. BMC cancer,2005,5:113.
[18] Morikawa E,Moskowitz M,Huang Z,etal. L-Arginine infusion promotes nitric oxide dependent vasodilation,increases regional blood flow and reduces infarct volume in the rat[J]. Stroke,1994,25(2):429.
[19] Yan GJ,You B,Chen SP,etal. Tumor necrosis factor-a downregulates endothelial nitric oxide synthase mRNA stability via translation elongation factor 1A1[J]. Circ Res,2008,103(12):591.
[20] Picchi A,Gao X,Belmadani S. Tumor necrosis factor-alpha induces endothelial dysfunction in the prediabetic metabolic syndrome[J]. Circ Res,2006,99:69.
[21] Agnoletti L,Curello S,Bachetti T,etal. Serum from patients with severe heart failure downregulates eNOS and is proapoptotic:role of tumor necrosis factor-alpha[J]. Circulation, 1999,100:1983.
[22] Gross SR,Kinzy TG. Tranlation elongation factor 1A is essential for regulation of actin cytoskeleton and cell morphology[J]. Nat Struct Mol Boil,2005,12:772.
[23] Leclercq TM, Moretti PAB, Vadas MA,etal.Eukaryotic elongation factor 1A interacts with sphingosine kinase and directly enhances its catalytic activity[J]. J Biol Chem,2008,283:9606.
[24] Gillardon F. Interaction of elongation factor 1-a with leucine-rich repeat kinase 2 impairs kinase activity and microtubule bundling in vitro[J]. Neuroscience,2009,163:533.
[25] Yuka Hotokezaka,Udo Tobben,Hitoshi Hotokezaka,etal. Interaction of the Eukaryotic Elongation Factor 1A with NewlySynthesized Polypeptides[J]. J Biol Chem ,2002,277(21):18545.
[26] Shamovsky Iiya,Ivannikov Maxim,Kandel ES,etal. RNA-mediated response to heart shock in mammalian cells[J]. Nature,2006,440(23):556.
AdvanceinfunctionoftheeukaryoticelongationfactoreEF1A
CHENG Jun, RUI Yao-cheng
( Department of Pharmacology, School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
Eukaryotic elongation factors(eEFs)was a kind of important molecules that assist in elongating the polypeptide chain in the protein biosynthesis of the organisms. It had two subtypes in eukaryotic organism:eEF1 and eEF2. One subtype of eEF1:eEF1A played the main functions in elongating the peptide chain, which carried the aminoacyl-tRNA (aa-tRNA)on the A site of the ribosome,and many studies indicated that eEF1A played another roles range from cell apoptosis,tumorigenesis,signal transduction to the regulation of the cardiovascular system, and these functions were not related to the protein synthesis. All of this demonstrated eEF1A was a multifunction protein,which could be a potential target of the disease prevention and cure. The advance in function of the eukaryotic elongation factor eEF1A in recently years were introduced in this article.
eukaryotic elongation factor eEF1A;protein biosynthesis;cell apoptosis;tumor;cardiovascular system
R591.2
A
1006-0111(2012)02-0089-04
10.3969/j.issn.1006-0111.2012.02.003
2011-07-14
[修回日期]2011-12-05

