PFC联合QHS抑制试验在食管癌中的诊断价值
肖锦华
(无锡市第三人民医院 检 验科,江苏 无 锡214041)
食管癌是指由食管鳞状上皮或腺上皮异常增生所形成的恶性病变,其发展一般经过上皮不典型增生、原位癌、浸润癌等阶段。食管鳞状上皮不典型增生是食管癌的重要癌前病变,由不典型增生到癌变一般需要几年甚至十几年。正因为如此,一些食管癌可以早期发现,并可以完全治愈[1]。吞咽不畅或有异物感的患者应尽早行胃镜检查,以便发现早期食管癌或癌前病变[2]。对无条件开展或是无法耐受的患者,有无其他方法可供选择?这是医患一直都关心的问题。本研究应用空斑形成抑制实验(PFC)联合体外溶血素分泌测定(QHS)对食管癌进行诊断,观察两种方法在食管癌诊断中的的价值,现报道如下。
1 资料与方法
1.1 实验对象 选取2008年1月~2011年10月我院肿瘤科收治的食管癌患者120例作为食管癌组,男68例,女52例,年龄35~68岁,平均年龄(47.2±5.6)岁,均由病理检查确诊;另选同期60例健康志愿者作为对照组,男30例,女30例,年龄36~70岁,平均年龄(46.7±5.1)岁,均由我院统一招募。两组患者性别、年龄等比较,无明显差异,具有可比性。
1.2 PEC方法(琼脂固相法)
1.2.1 实验材料 玻璃器皿(7×1.5 cm);1 ml注射器和青霉素小瓶;水浴(47-49℃ );Hanks'液;胎牛血清 (56℃30分钟灭活,并经羊红细胞吸收);琼脂或琼脂糖(表层基0.7%;底层基1.4%;用Hanks'液配制 );右旋糖酐(DEAE-dxtran分子量50万,用蒸馏水配置10 mg/ml);抗-Ig血清(测定间接空斑用);20%绵羊红细胞悬液(Hanks'液配制);补体:豚鼠血清(用前经绵羊红细胞吸收)
1.2.2 试验方法 (1)将溶化的底层琼脂倾注平皿形成一薄层,使其凝固,备用;(2)将每管含2 ml表层基的试管加热溶化后,放入47-49℃水浴内保温;(3)免疫小鼠脾细胞悬液的制备:将免疫小鼠腹腔或静脉注射绵羊红细胞4×108个。测定直接溶血空斑用免疫后4天的小鼠。测间接空斑用免疫后10天的小鼠。拉脱颈椎致死,取出脾脏,用200目钢网研磨过滤,细胞计数并检查活细胞的百分率;(4)实验平皿的制备:将底层平皿和所有试剂预温40℃左右。于水浴内保温的表层基中加入以下试剂:胎牛血清0.1 ml、DEAE-右旋糖酐0.1 ml、适当稀释的抗-Ig血清0.1 ml、20%羊红细胞0.1 ml和脾细胞悬液0.1 ml充分混匀,倾注于铺有底层之平皿内,在水平台上令表层基铺平凝固后,37℃1小时,然后每个平皿加1:10稀释的补体1.5-2.0 ml,均匀覆盖其表面,再次温育30分钟,即可进行空斑计数。
1.3 QHS抑制试验
1.3.1 实验材料 SRBC免疫小鼠;新鲜SRBC溶液 (1.5×108/ml);经SRBC吸收的补体溶液(来自豚鼠血清,经SRBC吸收去除非特异性抗体)。
1.3.2 实验方法 (1)制备脾细胞:①断颈处死SRBC免疫的小鼠;②取脾,以 Hank’s液漂洗;③经200钼铜网,以针拴研磨脾脏成单细胞悬液;④收集细胞悬液,加适量 Hank’s洗涤;⑤离心1 500 rpm,5 min,弃上清;⑥细胞沉淀中加入4.5 ml蒸馏水,用力混匀40 s;⑦迅速加入0.5 ml 9%NaCl;⑧离心1 500 rpm,5 min;⑨弃上清,加入1.2 ml Hank’s溶液。(2)抗原-抗体-补体反应:①加1ml SRBC溶液,加1 ml补体,彻底混匀;②37℃孵育1 h;③离心,3 000 rpm,5 min;④分光光度计检测上清液413 nm波长下的吸光值。(3)计数。
1.4 统计方法 采用13.0统计软件包进行统计,以均数±标准差表示,组间比较采用t检验进行统计学分析;计数资料应用Ridit分析进行统计。
2 结果
2.1 受检者血清PFC抑制阳性率和血清PFC抑制率均数比较
以血清PFC抑制率50%为上限,大于50%则为阳性。食管癌组阳性率高达84.17%,对照组阳性率仅为11.67%。两组阳性率经Ridit检验,差异有统计学意义(P<0.01)。见表1。食管癌组血清PFC抑制率均值为0.64%,而对照组血清PFC抑制率为0.27%,经T检验,P<0.05,说明两组血清PFC抑制率比较有统计学意义。见表2。

表1 PFC抑制情况比较

表2 血清PFC抑制率均数比较
2.2 两组QHS抑制率均数比较
食管癌组血清QHS抑制率均值为0.68%,而对照组血清QHS抑制率为0.35%,两组血清QHS抑制率比较,P<0.05,差异有统计学意义。见表3。
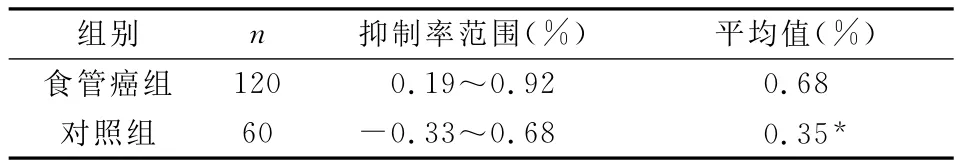
表3 血清QHS抑制率均数比较
3 讨论
食管癌是最常见的恶性肿瘤之一。根据1990年-1992年中国恶性肿瘤统计分析发现:食管癌的粗死亡率为17.19/10万,占全部肿瘤死因的第4位,比例为16.4%。流行病学研究显示,吸烟和重度饮酒是引起食管癌的重要因素[3]。国外研究显示,对于食管鳞癌,吸烟者的发生率增加3-8倍,而饮酒者增加7-50倍。在我国食管癌高发区,主要致癌危险因素是致癌性亚硝胺及其前体物、某些霉菌及其毒素。食管癌高危人群主要是处于食管癌高发区、年龄在40岁上、有肿瘤家族史或者有食管癌的癌前疾病,或癌前病变者[4,5]。
根据临床症状、体征及影像学检查,符合下列之一者即可进行临床诊断:吞咽食物时有哽噎感、异物感、胸骨后疼痛或出现明显的吞咽困难,食管造影发现食管粘膜局限性增粗、局部管壁僵硬、充盈缺损或龛影等表现。吞咽食物时有哽噎感、异物感、胸骨后疼痛或出现明显的吞咽困难,胸部CT检查发现食管管壁的环形增厚或不规则增厚。临床诊断食管癌病例需经病理学检查确诊[6]。
根据临床症状、体征及影像学检查,经细胞学或组织病理学检查,符合下列之一者可诊断为食管癌:纤维食管镜检查刷片细胞学或活检阳性;临床诊断为食管癌,食管癌病变(锁骨上淋巴结、皮肤结节)经活检或细胞学检查明确诊断者。但是,因于病理检查的技术难度及患者的耐受程度,以及可能在活检中并不能取到真正的病变部位等局限性,在临床上寻求一种可靠的或是可供参考的诊断方法非常有意义。本文采取PFC联合QHS抑制试验检查食管癌,结果表明,其阳性检测率均明显高于健康人(P<0.05)。
PFC测定技术又称溶血空斑试验[7],是一种体外检测单个抗体形成细胞(浆细胞)的方法。自从1963年Jerne和Nordin首先建立PFC测定技术以来,使免疫学方法得到很大的发展。特别是间接溶血空斑测定法的建立,更扩大了本实验的应用范围。它不仅可以测定产生Ig M类的抗体产生细胞,而且还可以检测产生其他各类免疫蛋白及其亚类的抗体形成细胞。它不仅可以作为免疫基本理论研究的有力工具,而且还可以作为临床筛检抗肿瘤新药以及研究中药对机体免疫功能的影响(免疫增强剂和免疫抑制剂)的特异指标。1983年王建光等[8]应用此法测定胃癌病人血清抑制活性,获阳性结果,与本研究的结果一致,提示此方法是一种可供选择的方法。
[1]李秀敏,赵志敏,张渊智,等.食管癌高发区食管癌患者遗传易感性对生存期的影响[J].实用医学杂志,2010,26(4):675.
[2]徐宝宏,陈雪华,李 静,等.无痛胃镜检查的临床观察[J].中华全科医师杂志,2007,6(9):558.
[3]李 颢,李会庆.食管癌的流行病学研究进展[J].中华胃肠外科杂志,2009,12(1):96.
[4]贺宇形,李建涛,刘江惠,等.食管癌高发区人群免疫功能与食管癌发病相关性研究[J].中华预防医学杂志,2009,43(1):73.
[5]代丽萍,王凯娟,张建中,等.以人群为基础的食管癌高发区危险因素病例对照家系研究[J].中华预防医学杂志,2009,43(7):597.
[6]丁以国,沈振亚,余云生,等.同时性食管重复癌27例的诊断与治疗分析[J].现代肿瘤医学,2009,17(6):1098.
[7]王 霞,刘 静,赵汝松,等.复杂环境介质中全氟化合物的分析检测现状[J].光谱实验室,2008,25(6):1064.
[8]王建光,李一鸣,叶维曾,等.胃癌血清中免疫抑制因子的初步探讨[J].上海免疫学杂志,2011,3:53.
[9]邓家刚,吴 光,运晨霞,等.达肝清对小鼠免疫功能影响的实验研究[J].中国现代应用药学,2008,25(4):278.

