SIK2抑制3T3-L1脂肪细胞脂肪合成的效应及机制
杜 静,杨 超,晏耀明,陆 红,周 薇,邹德学
(1.北京大学深圳医院,广东 深圳518036;2.暨南大学第二临床医学院,广东 深圳518020)
肥胖已成为现代生活的流行病和21世纪影响人类健康的主要危险因素之一,深入了解机体甘油三酯合成和动员的调控机制,有助于发现治疗肥胖的新方法。有研究表明一种脂肪特异性AMPK相关蛋白激酶-SIK2,在脂肪细胞的能量代谢中发挥着重要的调节作用[1]。本试验通过前期构建好的SIK2腺病毒表达载体,研究SIK2基因高表达影响3T3-L1成熟脂肪细胞能量代谢的作用及其机制,深入认识脂代谢异常的发病机理,为发现治疗肥胖新的分子靶标提供依据。
1 材料与方法
1.1 材料 3T3-L1细胞系购自 ATCC公司。SIK2腺病毒表达载体由我室构建和鉴定[2],胰蛋白酶购自GIBCO公司。M-MLV逆转录酶(molony murine leukemia virus reverse transcriptase)购自Promega公司。DMEM和胎牛血清购自GIBCO公司。SIK2、ACC2、FAS、SCD1、GPAT、DGAT1、SREBP1和三磷酸甘油醛脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase ,GAPDH)。PCR 引物由上海生物工程公司合成。
1.2 方法
1.2.1 3T3-L1前脂肪细胞的诱导分化:3T3-L1细胞按常规的贴壁细胞方法培养。在细胞状态良好时,传代分瓶(1×105/ml),细胞接触抑制两天后加入含10%胎牛血清的DMEM培养液(含0.5 m M 3-异丁基-1甲基黄呤、10μg/ml胰岛素、0.25μM地塞米松)培养两天,换成含10%胎牛血清的DMEM培养液(含10μg/ml胰岛素)培养两天,最后改为含10%胎牛血清的DMEM培养,每两天换液,直至90%的细胞为成熟的脂肪细胞。
1.2.2 SIK2腺病毒载体转染成熟的3T3-L1:脂肪细胞用2.5×1011纯化病毒颗粒/ml SIK2腺病毒和空载体病毒转染成熟3T3-L1脂肪细胞,并以空载体病毒作为阴性对照,更换培养液后在37℃细胞培养箱中继续培养48小时后,收集细胞,提取细胞总RNA。
1.2.3 油红O染色:各组3T3-L1前脂肪细胞传代于放置无菌玻片的6孔板中,细胞按上述诱导分化方案进行诱导,分别于转染的48小时后对细胞进行油红O染色。按Ramirez等报道的油红O染色提取法提取结合到脂滴的油红O染料[3],即0.5%油红O贮存液(溶于异丙醇)用水按3∶2稀释。弃去培养孔中的培养基,PBS冲洗3次;用3.7%中性福尔马林固定5 min,PBS洗涤3次;固定后的细胞用上述油红O稀释液室温孵育1 h后,移去染液,蒸馏水漂洗细胞3次倒置显微镜下观察。用水彻底冲洗后干燥,入异丙醇提取结合到脂滴的染料,在510 nm波长处比色,记录吸光度。
1.2.4 实时RT-PCR检测脂肪细胞中SIK2和脂代谢相关酶及转录因子SREBP1的表达:收集转染后48小时的成熟脂肪细胞,提取细胞总RNA。琼脂糖凝胶电泳检测RNA质量,并用紫外分光光度计测定RNA浓度。实时RT-PCR按SYBR Prime-Script RT-PCR kit的操作说明进行,扩增采用ABI PRISM 7900 Sequence Detectort(美国ABI公司)荧光定量PCR仪,测定SIK2和脂代谢相关酶及转录因子SREBP1 m RNA表达,结果以目标基因与GAPDH基因表达的比值表示,相应引物的序列见表1。
1.2.5 统计分析:用SPSS 11.0软件进行统计分析。所有计量资料采用均数±标准差(X±SD)来表示,组间比较采用t检验。以P<0.05为显著统计学差异。
2 结果
2.1 SIK2基因高表达对3T3-L1脂肪细胞脂滴形成的影响 显微镜下观察,未分化脂肪细胞为梭型或三角形,类似于成纤维细胞,经过诱导,细胞分化充脂,随时间延长逐渐聚集为大脂滴。腺病毒载体转染脂肪细胞,用油红O染色提取法测定波长510 nm处结合于脂滴的油红O染料的吸光度,以平均值±SD表示。由图1可见,转染48小时后,与对照组比较,SIK2基因高表达组细胞浆中脂滴数量和体积均明显减少,脂肪细胞内油红O染料的吸光度下降56%,由0.63降低到0.28(P<0.05)。
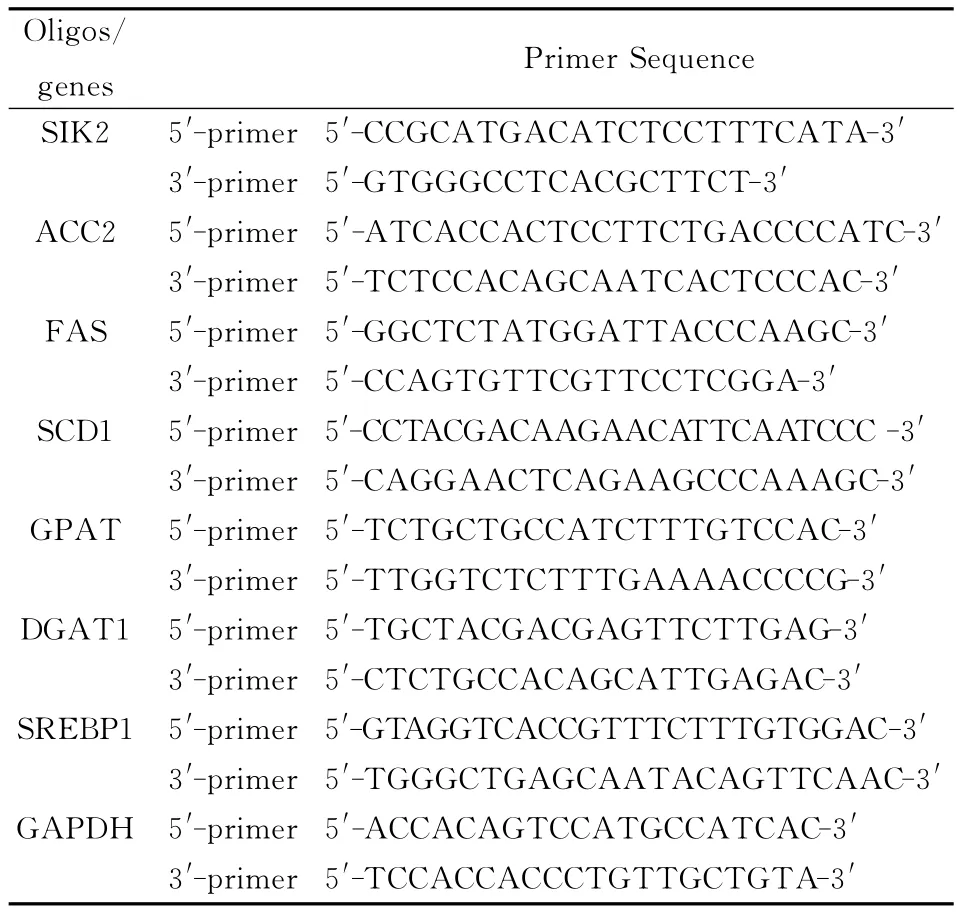
表1 单链oligo引物设计
2.2 SIK2基因高表达对脂肪细胞生脂基因及转录因子表达的影响 实时荧光RT-PCR定量测定脂肪细胞SIK2和脂肪合成有关基因mRNA水平,结果以目标基因与GAPDH基因表达的比值表示,见图2。结果显示SIK2腺病毒载体转染组SIK2 mR NA水平与空载体转染的对照组脂肪细胞比较,表达量明显增加,达到273倍(图A),证实脂肪细胞高效表达腺病毒载体转染的SIK2基因。在SIK2基因转染组,脂肪细胞脂合成代谢相关基因ACC2、FAS、SCD1、GPAT、DGAT1的 mRNA水平与对照组相比分别下降了31%、61%、57%、60%、52%,转录因子SREBP1 mRNA的表达水平减少了28%(P<0.05)(图B)。

图1 SIK2基因高表达对脂肪细胞脂肪合成的作用影响
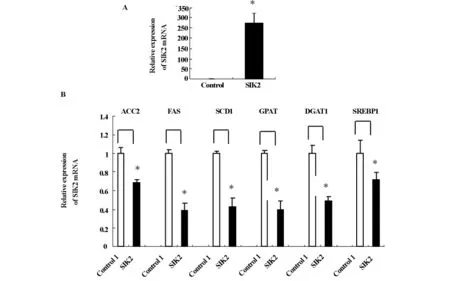
图2 SIK2基因高表达影响脂肪细胞脂代谢有关基因的表达
3 讨论
肥胖的主要原因是机体能量代谢失衡,热量摄入大于消耗而导致机体脂肪的过量沉积。控制肥胖,减少体脂聚集可降低心血管疾病的危险性和发病率。SIK2是新发现的腺苷酸活化蛋白激酶(AMPK)族系的一个成员,SIK2蛋白分子较特异地表达于脂肪组织中。有研究表明SIK2是调节机体脂质代谢过程中的一个重要能量调控蛋白[1],但具体机制尚不清楚。
利用我们构建高效表达SIK2的重组小鼠腺病毒载体[2],通 过 R-T PCR 和 Western Blot证 实3T3-L1脂肪细胞高效表达SIK2 m RNA和蛋白,但SIK2对脂肪细胞功能的影响尚不十分清楚。3T3-L1未分化脂肪细胞是从小鼠Swiss 3T3纤维母细胞克隆出来的,在诱导剂(insulin、IBMX和DEX)作用下,分化为成熟的脂肪细胞[4],通过基因转移技术,用小鼠SIK2重组腺病毒载体转染3T3-L1成熟脂肪细胞获得稳定表达SIK2基因的脂肪细胞株,观察SIK2基因高表达对脂肪细胞脂肪合成的影响。
在脂肪酸生物合成中,ACC、FAS、SCD-1是脂肪酸合成限速酶。ACC催化脂肪酸合成的第一步反应,即乙酰Co A羧化为脂肪酸合成必需的底物丙二酰Co A(MA),然后MA在脂肪酸碳链延长酶系作用下进一步合成长链脂肪酸。最近研究表明,ACC受磷酸化、去磷酸化的调节,AMPK是调节ACC活性的主要物质,使ACC磷酸化和抑制ACC的作用[3]。FAS是脂肪酸合成最后环节的限速酶,催化MA和乙酰Co A合成棕榈酸,调控细胞内内源性脂肪酸的合成。FAS的表达主要在转录水平被调控,动物体脂水平与FAS的表达呈正相关[6]。SCD-1是催化单不饱和脂肪酸合成的限速酶,GPAT和DGAT分别是催化甘油-3-磷酸酯合成甘油三酯的初始和最后步骤的关键调节酶。我们的实验结果显示,SIK2高表达显著降低3T3-L1脂肪细胞内脂肪含量,提示SIK2可抑制3T3-L1细胞的脂肪合成功能,其作用与下调脂肪细胞内脂肪酸合成关键酶 ACC、FAS、SCD-1、GPAT 和 DGAT1 mRNA的表达有关。该结果说明了SIK2作为AMPK家族中的成员,起到了AMPK样的降低ACC活性的作用,同Saha AK报道的一致[5]。
转录因子SREBPs是一类能与胆固醇调节组件1(SRE-1)发生特异性结合的蛋白,包括两种异构体SREBP-1和SREBP-2。SREBP-1可调控脂肪酸和甘油三酯的合成,SREBP-2主要调控胆固醇代谢。SREBP-1在脂肪酸合成中所调控的靶基因有:ACC、FAS、SCD、GPAT 等[7],其中 FAS基因是脂肪酸合成中的关键酶。Kakuma等的研究发现SREBP-1c的过度表达可引起FAS基因转录增加,从而导致FAS活性的增强,并引起脂肪酸合成增多和TG增加,在肝脏等非脂肪组织异常沉积形成脂肪肝[8]。我们的实验发现 SIK2转染组 SREBP-1 m RNA的表达水平相应地降低,提示SIK2抑制脂肪合成代谢的作用与SREBP-1信号传导通路有关,SIK2可能通过降低SREBP-1水平来调节ACC、FAS、SCD、GPAT、DGAT等脂肪合成基因的表达,减少细胞内脂肪含量。
综合所述,本研究从基因水平探讨了SIK2对脂肪细胞能量代谢的影响和机制,其在蛋白水平的作用有待进一步证实。深入研究SIK2这一新的脂代谢调节因子将为探索肥胖病基因治疗的新途径提供理论依据,为寻找新的防治肥胖的药物作用靶点提供基础资料。
[1]Du J,Chen Q,Takemori H,Xu H.SIK2 Inhibits Expression of Lipogenic Genes in Adipocytes[J].Obesity,2008,16(3):531.
[2]杜 静,周 钧,杨 超,等.小鼠SIK2重组腺病毒载体在3T3-L1脂肪细胞中的表达[J].中国实验诊断学杂志,2008,12(11):1355.
[3]Ramirez ZJL,Castro MF,Kuri HW.Quantitation of adipose conversion and triglycerides by staining intracyctoplasmic lipids with Oil red O[J].Histochemistry,1992,97:493.
[4]Joost HG,Schurmann A.Subcellular fractionation of adipocytes and 3T3-L1 cells[J].MethodsMol Biol,2001,155(1):77.
[5]Saha AK,Ruderman NB.Malonyl-CoA and AMP-activated protein kinase:an expanding partnership[J].Mol Cell Biochem,2003,253(1-2):65.
[6]Semenkovich C F.Regulation of fatty acid synthase[J].Progress in Lipid Research,1997,36:43.
[7]Sekiya M,Yahagi N,Matsuzaka T.et al.SREBP-1-independent regulation of lipogenic gene expression in adipacytes[J].J Lipid Res,2007,48(7):1581.
[8]Kakuma T,Lee Y,Higa M,et al.Leptin,troglitazone and the expression of sterol regulatory element binding proteins in liver and pancreatic islets[J].Proc Natl Acad Sci USA,2000,97(15):8536.

