食管癌组织中Dlk-1蛋白的表达及其意义
胡钦勇,黄卫彬
(武汉大学人民医院 肿瘤中心,湖北 武汉430060)
作为全球十大恶性肿瘤之一的食管癌,其发病率高、危害大,世界范围内发病率不断上升[1]。长期以来,食管癌在中国的发病率和死亡率始终保持在很高的水平。迄今,食管癌的病因未明。DLK1(delta-like 1 homologue)亦称 ZOG、FA1或 Pref-1等蛋白,发现于神经母细胞瘤[1],为重要的调节细胞分化的基因[2-3]。研究证实 Dlk-1蛋白在包括急性白血病、小细胞肺癌、成神经细胞瘤及神经胶质瘤等诸多肿瘤中呈现高表达[4]。肿瘤演进过程中Dlk-1可能起到重要作用。Dlk-1在食管癌发生发展过程中的作用的相关研究尚少。我们采用SP免疫组化法检测食管癌组织及癌旁正常组织中Dlk-1蛋白表达的情况,并探讨食管癌临床病理特征与Dlk-1蛋白表达的相关性,为临床防治食管癌和预后判断提供新的思路。
1 材料与方法
1.1 材料
采集2008年7月至2010年7月间在我院行食管癌根治术治疗患者的食管癌标本,共计41例,其中女性8例,男性33例,年龄在35-71(平均63)岁,所有患者术前未施行放、化疗,病例以组织学病理检测明确诊断。临床食管癌TNM分期情况:Ⅰ期、Ⅱ期及Ⅲ期分别为6例、18例与29例。食管癌原发病灶组织学分级统计:低分化10例,中分化13例,高分化18例。区域淋巴结转移状态:阳性8例,阴性33例。其中选择病理组织学检查正常的20例癌旁食管组织为对照组。
1.2 方法与操作步骤
石蜡切片采用柠檬酸抗漂修复缓冲液高温抗原修复法,采用SP免疫组织化学法染色,严格依照试剂盒所附步骤进行检测,同时用已知阳性片比照.采取PBS液代替一抗作空白对照,并与正常癌旁组织进行对照。
1.3 结果判定
Dlk-1蛋白阳性定位在细胞膜或细胞质,呈现显著棕黄染色为阳性。每张标本切片随机选取出5个高倍视野(400倍),计算各视野中阳性细胞数的百分比数作为该视野的阳性细胞百分比,进而算出平均阳性细胞百分比作为该切片的阳性细胞百分比。染色评判标准:据阳性细胞百分比将染色结果判别成3级别:阴性(-)设定为阳性细胞百分比小于10%,阳性(+)设定为百分比位于10%和50%之间者,而大于50%者为强阳性(++),其中,阳性及强阳性标本归入阳性组,两组间进行统计学处理。
1.4 统计学处理
采用SPSS 12.0软件进行统计学分析,用χ2检验分析组间计数资料,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学染色结果
Dlk-1蛋白阳性表达在食管组织切片标本中定位于细胞膜或细胞质内,呈现棕褐色着色,大小不等的颗粒状,阳性细胞呈局灶性或弥漫性分布,细胞核无明显着色。
2.2 Dlk-1蛋白表达在癌旁正常组织和食管癌组织中的情况
在41例食管癌组织中,Dlk-1蛋白阳性表达者24例(58.53%),20例癌旁正常组织中 Dlk-1蛋白表达为阴性。经列联表χ2检验:Dlk-1蛋白在食管癌组织与癌旁正常组织中的表达具有显著性差异(P<0.05)。
2.3 Dlk-1蛋白表达与食管癌病理分级及临床分期之间的关系
在不同组织学级别食管癌组织中,Dlk-1蛋白表达较癌旁正常组织明显升高,低分化、中分化及高分化各组中Dlk-1蛋白阳性表达率分别为80.00%、69.23%、38.88%,随着分化程度的上升,Dlk-1蛋白阳性表达率显著下降;对不同临床TNM分期的食管癌组织的检测结果提示,Dlk-1蛋白在Ⅰ、Ⅱ、Ⅲ期食管癌组织中的阳性表达率分别为37.50%、59.09%、72.72%,临床分期越晚,Dlk-1蛋白阳性表达率越高。见表1。
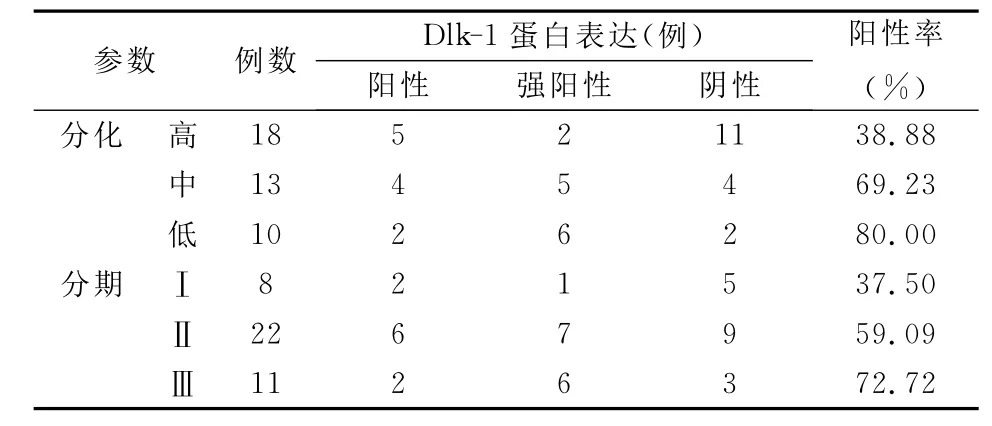
表1 食管癌Dlk-1蛋白表达与肿瘤分化、分期之间的关系
3 讨论
定位于人染色体14q32的DLK1基因,分为细胞内多肽、细胞外区和中间跨膜区三部分,六个EGF样重复片段存在于胞外区域,Dlk-1为一种分泌性跨膜蛋白,是表皮生长因子(epidermal growth factor,EGF)家族成员之一。EGF蛋白族在调节细胞分化等过程中发挥着重要作用。
近年DLK1基因在细胞分化调节等领域的功能为人们关注。其在如神经内分泌细胞分化、脂肪形成、创伤修复、血细胞生成及神经系统的分化等过程中扮演重要角色。Dlk-1可使胚胎细胞保持未分化状态,其对胰腺细胞、骨骼细胞及肝细胞等的分化起着重要作用[5-6]。研究发现在脐带血干细胞维持不分化状态中Dlk-1至关重要。Dlk-1基因敲除小鼠发生肥胖症、生长迟缓及骨骼畸形等,Dlk-1可抑制中胚层分化。Dlk-1在成年细胞中表达较胚胎组织下降,但仍对机体胰腺、血细胞、脂肪及肾上腺生长等起着重要作用。研究表明,Dlk-1在妊娠中期胎儿高表达,与此同时血细胞形成达峰,生成血细胞可被 Dlk-1促进[7,8]。肝基底细胞中 Dlk-1蛋白高表达,促进血细胞产生、肝细胞增殖与分化[9]。Dlk-1高表达通过阻断前脂肪细胞进一步分化成脂肪细胞从而导致脂肪生成减少[10]。有研究者在不同大肠癌细胞系均检测到Dlk-1高表达,并通过对小鼠大肠癌模型的研究,观察到Dlk-1表达也明显异常升高,同样,Dlk-1蛋白高表达亦见于多种肿瘤组织。本组检测结果显示食管癌组织中Dlk-1蛋白表达显著高于其在癌旁正常组织,并和肿瘤分期、级别相关。Dlk-1与食管癌的发生发展可能相关,Dlk-1可能抑制食管癌细胞分化并促使其生长。迄今,人们对Dlk-1介导的信号转导通路知之甚少,其抑制细胞分化的作用可能以类旁分泌等机制得以发挥。
Dlk-1在食管癌的演进过程中可能起到重要作用,且其表达状态与食管癌的预后密切相关,对其深入研究将有助于临床诊治与预后分析。本组对Dlk-1在食管癌中的表达与临床特征之间的关系进行了初步观察,其在食管癌中的具体作用尚需研究。
[1]Laborda J,Sausville EA,Hoffman T,et al.DLk,a putativemammalian homeotic gene differentially expressed in small cell lung carcinoma and neuroendocrine tumor cell line[J].J Biol Chem,1993,268(6):3817.
[2]Ditte CA,Stine JP,Louise HJ,et al.Characterization of dlk1+cells emerging during skeletalmuscle remodeling in response tomyositis,myopathies and acute injury[J].Stem Cells Express,2009,8(1):12.
[3]Samulin J,Berg PR,Sundvold H,et al.Expression of DLK1 splice variantsduring porcine adipocyte development in vitro and in vivo[J].Animal Genetics,2008,40(7):239.
[4]Yanai H,Nakamura K,Hijioka S,et al.Dlk-1,a cell surface antigen on foetal hepatic stem/progenitor cells,is expressed in hepatocellular,colon,pancreas and breast carcinomas at a high frequency[J].Journal of biochemistry,2010,148(1):85.
[5]Larsen JB,Jensen CH,Schroder HD,et al.Fetal antigen 1 and growth hormone in pituitary somatotroph cells[J].Lancet,1996,347(8995):191.
[6]Floridon C,Jensen CH,Thorsen P,et al.Does fetal antigen 1(FA1)identify cells with regenerative,endocrine and neuroendocrine potentials?A study of FA1 in embryonic,fetal,and placental tissue and in maternal circulation[J].Differentiation research in biological diversity,2000,66(1):49.
[7]Tanimizu N,Nishikawa M,Saito H,et al.Isolation of hepato-blasts based on the expression of Dlk/Pref-1[J].Journal of Cell Science,2003,116(Pt 9):1775.
[8]White JD,Vuocolo T,McDonagh M,et al.Analysis of the callipyge phenotype through skeletal muscle development;association of Dlk1 with muscle precursor cells[J].Differentiation research in biological diversity,2008,76(3):283.
[9]Moore KA,Pytowski B,Witte L,et al.Hematopoietic activity of a stromal cell transmembrane protein containing epidermal growth factor-like repeat motifs[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(8):4011.
[10]Smas CM,Chen L,Sul HS.Cleavage of membrane-associated pref-1 generates a soluble inhibitor of adipocyte differentiation[].Molecular and cellular biology,1997,17(2):977.

