新多胺类似物四丁基丙二胺对人肝癌Hep G2细胞增殖及侵袭迁移的影响
杨建林,韩 钰,王 凯,张贺吉,张 军,王艳林*
(1.三峡大学医学院 分 子生物学研究所;湖北 宜 昌443002;2.武汉工程大学,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武 汉430073)
肝癌是常见的恶性肿瘤,5年自然死亡率超过95%。全球每年有超过50万人患有肝癌,其中一半以上在中国。肝癌治疗是医药领域需予面对的强力挑战。现今肝癌治疗仍以手术切除为主,然而从临床实践来看,包括进行术前化、放疗后能够施行完全肝癌切除手术患者比例不到肝癌总例数的10%。其余90%肝癌患者尚无明显疾病缓解或延命效果的治疗手段。
目前针对抗肿瘤新靶点-多胺代谢途径而合成的多胺类似物已成为抗肿瘤新药物研究热点,学者已证实部分多胺类似物显示出良好的临床应用前景[1,2],对非小细胞肺癌、乳腺癌和结直肠癌细胞有很强的细胞毒作用[3,4],提示多胺类似物在肿瘤临床治疗中具有潜在的应用价值。本研究分析了新多胺类似物四丁基丙二胺(tetrabutyl propanediamine,TBP)对人肝癌Hep G2细胞增殖、迁移和侵袭能力的影响,并分析了可能的原因,为抗肝癌新药的研发提供了新思路和探索。
1 材料与方法
1.1 主要试剂及仪器 肝癌Hep G2细胞系购自武汉大学细胞典藏中心,本实验室培养传代保存;多胺类似物四丁基丙二胺(tetrabutyl propanediamine,TBP)由武汉工程大学合成;3-(4,5-二甲基噻唑)-2,5-二甲苯基四氮唑溴盐(MTT)为美国Sigma公司产品;RPMI-1640培养基和新生牛血清为Gibico公司产品;PVDF膜为Millipore公司产品;ECL试剂盒为Thermo公司产品;鼠抗人β-action抗体为Santa Cruz公司产品;鼠抗人SSAT、SMO单克隆抗体为本实验室研发制备,羊抗鼠IgG-HRP为Jackson公司产品。基质胶Matrigel为美国BD公司产品;Transwell培养板为美国Corning公司产品;全波长酶标仪为Thermo公司产品;荧光倒置显微镜为Olympus公司产品;Waters 2690高效液相色谱仪为美国Waters公司产品;EPLCS XL流式细胞分析仪为Becman-Coulter公司产品,Sirius荧光仪为Berthold公司产品。
1.2 方法
1.2.1 细胞培养 将人肝癌 Hep G2细胞在含10%新生牛血清的RPMI-1640培养液中于37℃、5%CO2培养箱中培养,生长至对数生长期时进行细胞学实验。TBP溶于dd H2O,-20℃保存,使用时用RPMI-1640培养液稀释至需要浓度。
1.2.2 MTT法检测TBP对肿瘤细胞生长的影响将Hep G2细胞接种于96孔细胞培养板,每孔加入50μl细胞悬液(含2000个细胞),培养24 h后分别加入50μl/孔不含TBP的RPMI-1640培养液作为正常细胞对照孔和含不同浓度TBP的RPMI-1640培养液(TBP终浓度为10~80μmol/L),每个药物浓度设4个复孔,分别在培养24 h、48 h和72 h后,每孔加终浓度为5 mg/ml的MTT孵育4 h,弃去上清液,加DMSO 150μl/孔,振荡混匀后用酶标仪测波长570 nm的吸光度值(OD值)。肿瘤细胞生存率=(实验孔 OD值/对照孔 OD值)×100%。
1.2.3 Transwell体外迁移实验 将对数生长期Hep G2细胞用80μmol/LTBP预处理48h,然后换为无血清RPMI-1640培养基,饥饿处理4h后消化细胞,用含0.2%BSA的RPMI-1640培养液悬浮,每个培养小室上室内加入200μl细胞悬液(5×104个细胞)。培养小室下孔加入800μl含20%FBS的RPMI-1640培养液,培养18 h。将膜用PBS洗2次,多聚甲醛固定30 min,洗2次,加入苏木精染色,室温10 min,清水浸泡20 min,用棉签轻轻擦拭上室内侧面的细胞,同时清水冲洗3-5遍,用镊子拨下小室的膜,下侧面向上平铺于载玻片,倒置显微镜下随机选取5个视野观察,计数每个视野的细胞数,取平均数。迁移抑制率=(1-实验组穿膜细胞平均数/对照组穿膜细胞平均数)×100%。
1.2.4 Transwell体外侵袭实验 Matrigel放置4℃冰箱使其完全融解,取50μL/孔加入Transwell侵袭小室的上室中,将培养板放置37℃培养箱中孵育过夜,将80μmol/LTBP预处理48 h的Hep G2细胞消化,用无血清的RPMI-1640培养液悬浮,每个培养小室上室内加入200μl细胞悬液(1×104个细胞)。培养小室下室加入500μl含20%FBS的RPMI-1640培养液,培养24 h。取出小室,用PBS洗2次,4%多聚甲醛固定30 min,用棉签小心擦拭去滤膜上的Matrigel胶,PBS洗3次,加入苏木精室温染色10 min,清水冲洗3-5遍,清水浸泡20 min,用镊子拨下小室的膜,下侧面向上平铺于载玻片,倒置显微镜下随机选取5个视野观察,计数每个视野的细胞数,取平均数进行统计学分析。迁移抑制率=(1-实验组穿膜细胞平均数/对照组穿膜细胞平均数)×100%。
1.2.5 流式细胞术检测细胞周期的变化 Hep G2细胞经20、40、80μmol/L的 TBP处理48h后,用4℃预冷的PBS配制的75%乙醇固定过夜,RNA酶37℃消化、碘化丙啶(0.5 mg/m L)避光染色30min,经300目尼龙网过滤后上机检测。
1.2.6 Western blot检测多胺代谢相关蛋白表达
40μmol/L TBP作用HepG2细胞48h后收集细胞,用细 胞 裂 解 液(20 mmol/L Tris-HCl,p H8.0,150 mmol/L NaCl,0.2%NP40)冰上裂解30 min,离心取上清作为检测样品,考马斯亮蓝染色测定蛋白总含量,加入上样Buffer沸水中水浴5 min使得蛋白变性,在12%SDS-聚丙烯酰胺凝胶100V电压下垂直电泳分离蛋白,再将其于60v转印1.5 h到PVDF膜上,5%脱脂奶粉封闭1 h后,分别加鼠抗人SMO、SSAT、ODC、action抗体作用过夜,羊抗鼠IgG-HRP二抗反应2 h,TBST洗涤两遍,ECL显影压胶片。
1.2.7 化学发光法测定SMO活性 Hep G2在12孔细胞培养板中培养致对数生长期,80μmol/LTBP处理24 h后,经PBS缓冲液原位洗涤,用83 mmol/L-1甘氨酸缓冲液(p H8.0)覆盖细胞,每孔200μl。置-80℃低温冰箱冷冻48h后,收集细胞裂解液备用。SMO活性分析采用化学发光法,酶活性单位按相对光强度单位(relative lightuni,t RLU)定义为:RLU·mg-1·min-1。
1.2.8 反相高效液相色谱法测定细胞内多胺含量收集对照和80μmol/LTBP处理48 h的Hep G2细胞,PBS洗涤2次,加入1 ml细胞裂解液(20 mmol/L Tris-HCl,p H 7.5,150 mmol/L NaCl,1%Triton X-100),246.5×g离心后收集上清液备用。取处理好的细胞裂解液800μl,加入1 mmol/L内标己二胺(1,6-diaminohexane,DAH)20μl、2 mol/LNaOH 500μl和苯甲酰氯10μl,混匀后于40℃水浴中保温20 min,用2 ml饱和NaCl溶液终止反应,用2 ml乙醚分别提取3次,合并乙醚提取液,空气干燥,沉淀用1 ml甲醇溶解,微孔滤膜(0.5μm)过滤后经Waters 2690检测,流动相为乙腈-水(38∶62),检测241.3 nm波长处的吸光度单位(absorb unit,AU)。
1.3 统计学分析 应用SPSS 12.0软件对实验数据进行统计学分析。计量资料用x-±s表示,采用单因素方差分析比较。以P<0.05为差异有统计学意义。
2 结果
2.1 TBP有效抑制人肝癌HepG2细胞增殖 不同浓度的TBP作用Hep G2细胞24 h、48 h、72 h后,随着药物浓度的增高和时间的延长,对Hep G2细胞的生长有明显的抑制作用,且呈时间和浓度依赖性,当80μmol/LTBP作用72h时,生长抑制率达38.79%,各时间组与浓度组之间比较差异具有统计学意义(P<0.05)(见表1)。流式细胞术分析显示,Hep G2细胞在TBP作用下,无明显亚凋亡峰出现,而是细胞周期发生显著性改变。低浓度(20μmol/L)药物处理细胞后,处于S期的细胞数略有减少,分裂期G2期细胞数稍有增高;当药物浓度提高到40μmol/L后,大量细胞被阻滞在DNA合成前的G0/G1期,S期的细胞数显著减少,有效抑制肝癌Hep G2细胞生长增殖(表2)。
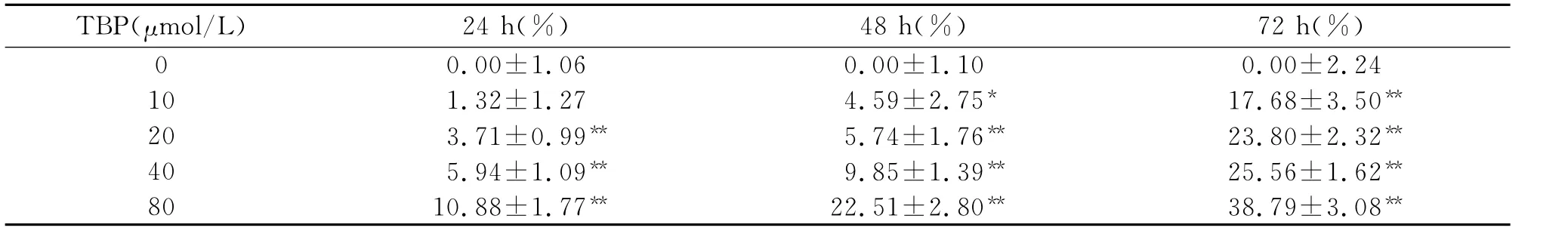
表1 TBP处理对HepG2细胞生长的抑制作用(x—±s,n=3)

表2 TBP对Hep G2细胞周期的影响(x-±s,n=3)
2.2 TBP抑制Hep G2细胞的迁移/侵袭能力 小室迁移/侵 袭 实 验 显 示,80μmol/L TBP 处理Hep G2细胞后,细胞穿过聚碳酸酯膜和Matrigel胶的细胞数明显低于未处理细胞,差异具有统计学意义(P<0.01),提示TBP显著抑制了人肝癌Hep G2细胞的迁移和侵袭能力。与对照组相比,80μmol/L TBP处理细胞组迁移细胞数下降了82.53%,侵袭细胞数减少了89.41%(见表3,图1)。
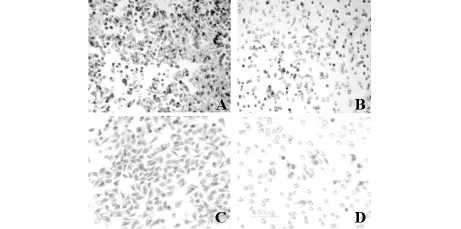
图1 Transwell技术检测TBP对HepG2细胞迁移和侵袭能力的影响×200
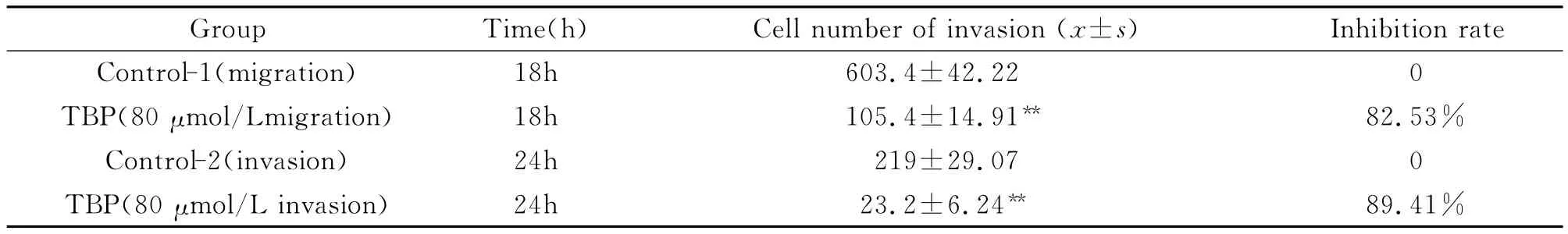
表3 TBP对HepG2细胞迁移、侵袭能力的影响 (x-±s,n=5)
2.3 TBP对Hep G2细胞多胺代谢的影响 Western blot检测结果显示,用80μmol/L TBP处理Hep G2细胞48 h后,细胞中SMO蛋白表达量显著升高(见图2),但检测细胞裂解液中SMO活性发现,SMO活性被抑制,与对照组相比,差异有显著性意义(见图3)。反向高效液相色谱法检测显示TBP显著性增加细胞内腐胺的含量,但对精胺与精脒无明显影响(见表4)。
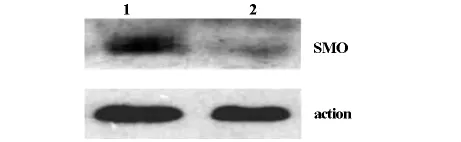
1.用80μmol/L TBP处理48 h的HepG2细胞;2.Hep G2对照细胞
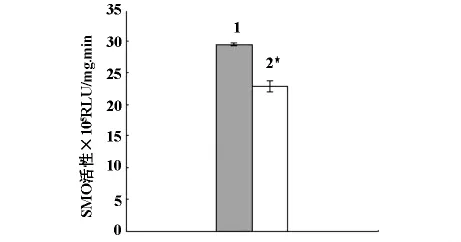
图3 TBP对HepG2细胞内SMO蛋白活性的影响(x—±s,n=3)
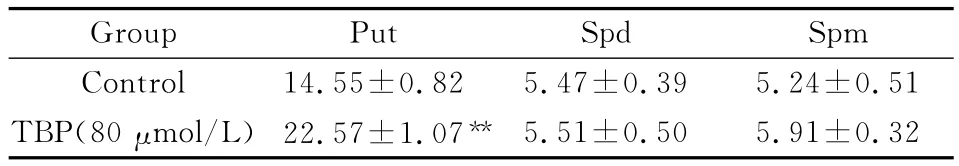
表4 TBP对HepG2细胞内多胺含量的的影响 (μg/mg,x—±s,n=3)
3 讨论
多胺是广泛存在于生物体组织内的一类多价阳离子的小分子化合物,是正常细胞生长所必须,还与肿瘤的发生和快速生长密切相关。多胺代谢途径已经成为抗肿瘤治疗的新靶点[5,6]。目前已经合成一些与天然多胺有相似化学结构的多胺类似物(polyamine ana-logue)用于抗多种肿瘤的基础和前期临床研究[7]。TBP是为一种新合成的腐胺对称性修饰物,我们的前期研究发现,TBP能有效抑制膀胱癌和骨髓瘤细胞生长,并诱导癌细胞程序性凋亡(另文发表)。本研究进一步分析了TBP对人肝癌Hep G2细胞生长的影响,证实了TBP通过阻滞细胞在G0/G1期有效抑制HepG2细胞的生长,抑制效应有一定的量效关系,但不会诱导细胞发生凋亡。SMO是新近被鉴定的主要参与多胺分解代谢途径的关键酶,它氧化天然多胺成分之一的精胺,将其转化为精眯,同时产生具有细胞毒性的活性氧本研究中TBP处理细胞后,细胞中SMO蛋白表达量增加,但酶活性发生显著性降低,同时细胞中精胺含量未见明显改变,因此我们推测TBP可能通过某种机制抑制肝癌Hep G2细胞SMO活性,从而导致代偿性SMO表达量增高。而TBP抑制细胞增殖的同时,细胞中腐胺含量的显著性增加这一现象与以往研究高腐胺含量促进细胞增殖的结果背道而驰,因此我们推断TBP对肝癌细胞的细胞毒作用可能不是我们已知的常见干扰多胺代谢途径的方式,其确切机制有待进一步研究。
转移是恶性肿瘤生物学行为的特征表现,也是肿瘤临床治疗的难题,影响肿瘤患者长期生存的主要因素。据报道,60%以上的恶性肿瘤患者于初次诊断时已经发现有转移,在临床肿瘤患者中,约有80%-90%以上死于肿瘤侵袭和转移。因此抑制肿瘤的侵袭、迁移能力也是抗肿瘤治疗的一种有效途径。本研究通过Trans-well的方法检测了TBP对人肝癌Hep G2细胞侵袭、迁移能力的影响。结果显示TBP能够有效抑制Hep G2细胞的侵袭、迁移能力,药物处理后穿过聚碳酸酯膜和Matrigel胶的细胞数量明显减少,侵袭、迁移抑制率高达82.53%和89.41%。
综上所述,TBP能够有效抑制人肝癌Hep G2细胞增殖、降低Hep G2细胞侵袭、迁移能力,其机制可能与抑制肿瘤细胞DNA合成,改变细胞周期时相分布有关。本实验结果显示TBP是一种很有潜力的抗肝癌药物。
[1]Agostinelli E,Marques MP,Calheiros R,et al.Polyamines:fundamental characters in chemistry and biology[J].Amino Acids,2010,38(2):393.
[2]Birkholtz LM,Williams M,Niemand J,et al.Polyamine homoeostasis as a drug target in pathogenic protozoa:peculiarities and possibilities[J].Biochem,2011,438(Pt2):229.
[3]Choi W,Gerner EW,Ramdas L,et al.Combination of 5-fluorouracil and N1,N11-diethylnorsperminemarkedly activates spermidine/spermine N1-acetyltransferase expression,depletes polyamines,and synergistically induces apoptosis in colon carcinoma cells[J].J Biol Chem,2005,280(5):3295.
[4]Allen WL,Mc Lean EG,Boyer J,et al.The role of spermidine/spermine N1-acetyltransferase in determining response to chemotherapeutic agents in colorectal cancer cells[J].Mol Cancer Ther,2007,6(1):128.
[5]Casero RA,Woster PM.Recent Advances in the Development of Polyamine Analogues as Antitumor Agents[J].Med Chem,2009,52(15):4551.
[6]Chaturvedi R,de Sablet T,Peek R,et al.Spermine oxidase,a polyamine catabolic enzyme that links Helicobacter pylori Cag A and gastric cancer risk[J].Gut Microbes,2012,3(1):48.
[7]Casero RA,Marton LJ.Targeting polyamine metabolism and function in cancer and other hyper proliferative diseases[J].Nat Rev Drug Discov,2007,6(5):373.
[8]Chaturvedi R,Asim M,Romero-Gallo J,et al.Spermine oxidase mediates the gastric cancer risk associated with Helicobacter pylori Cag A[J].Gastroenterology,2011,141(5):1696.

