无机汞诱导人小细胞肺癌NCI_H446细胞凋亡的分子机制研究
李 丹,于 蕾,袁海波,丁 会*
(1.吉林大学第一医院 呼吸科,吉林 长春130021;2.吉林大学白求恩医学院 生理学系)
本研究在发现有机汞具有多途径抗癌效应的基础上[1,2],进一步探讨无机汞对小细胞肺癌(SCLC)细胞系NCI-H446细胞凋亡、凋亡相关基因mRNA转录水平和蛋白质表达的影响。
1 材料与方法
1.1 实验材料 人小细胞肺癌细胞株(NCI-H446)由吉林省肿瘤医院肿瘤研究所赠送。无机汞(IM)(德国,Merck公司),As2O3(美国,Alfar Aesar公司),顺铂(DDP)(山东齐鲁药厂);DMEM细胞培养基(美国,Gibco公司);TrizolRNA提取试剂盒(上海生物工程公司);Taq DNA polymerase(大连宝生物工程公司);AMV逆转录酶(美国,Sigma公司);Rnasin RNA酶抑制剂(美国,Promega公司);间隔100bp DNA分子量标尺,Oligo dT寡核苷酸T(大连宝生物工程公司)。
1.2 主要仪器 550型酶标仪,凝胶成像分析系统(美国,Bio-Rad公 司);PCR 扩 增 仪 (美 国,PE 公司);FACSAN流式细胞仪(美国,BD公司)。
1.3 方法
1.3.1 细胞 取对数生长期 NCI-H446细胞,用0.25%胰酶消化,配制成单细胞悬液,调细胞浓度为1×106/ml,接种至6孔培养板(5×105/孔)。细胞分为IM组、As2O3组、DDP组和对照组。待细胞完全贴壁以后,IM组每孔加入终浓度为5.0μmol/L的IM,终体积均为2.0ml;As2O3组、DDP组和对照组分别加入As2O3、DDP及培养液,终体积为2.0 ml。培养6、12、24、48h后,分别收集细胞。
1.3.2 RT-PCR Trizol法提取细胞总RNA 经紫外分光光度计检测RNA纯度良好后,RNA在AMV逆转录酶作用下合成cDNA。再以cDNA作为模板参与完成PCR反应。PCR扩增的条件为:94℃1min,57℃1min,72℃90s,35个循环,最后1次循环结束后,72℃延伸10min。根据基因cDNA序列设计 Bcl-2、Bax、Caspase-3和β-actin的 PCR引物(由上海生物工程公司合成)。Bcl-2引物序列:正向5′CGCTCTGTGGATGACTGAGT3′,反向5′GATTTGACCATTTGCCTGAAT3′,产 物 长 度389bp。Bax引物序列:正向5′ATTGGAGATGAACTGGATAGC3′,反向5′CCACAAAGATGGTCACTG3′,产物长度337bp[3]。Caspase-3引物序 列:正 向 5′GCACTGGAAT-GTCAGCTCGCAA3′, 反 向 5′ GCCACCTTCCGGTTAACACGAC3,产物长度556bp[4]。β-actin引物序列:正向5′TCTGGATCACCTTCTGCTGG3′,反向5′ATTGCTCAGGA-CATTTCTG3′,产 物 长 度 690 bp[5]。PCR产物在1%琼脂糖凝胶电泳后经凝胶成像系统分析结果。目的基因的表达水平用其与GAPDH相比较的相对平均灰度值表示。
1.3.3 Western Blot NCI-H446细胞总蛋白的提取及定量 不同浓度(0、2.5、5、10及20μM)IM 处理NCI-H446细胞24h后,分别收集细胞,提取总蛋白。于595nm处测定光吸收值,由标准曲线查出待测样品浓度。经电泳、转膜、免疫反应,经胶片显影,测积分光密度值,分析结果。
2 结果
2.1 流式细胞术(FCM)检测细胞凋亡的变化 不同浓度(1.25、2.5、5、10及20μM)IM、As2O3和DDP作用NCI-H446细胞24h后,随着剂量的升高可以看到凋亡率有增加的趋势,其中,IM组在浓度小于5.0μM时,早期凋亡率随药物浓度的增加而增高,于5.0μM达到峰值75.28%,IM的浓度超过5.0μM后,早期凋亡率随药物浓度的增加而呈现下降趋势,而晚期凋亡和坏死率逐渐增多。As2O3和DDP也有同样的规律,但其使细胞达到早期凋亡峰值的浓度是10.0μM,且早期凋亡率的峰值在As2O3组为56.87%,DDP组为61.20%,均低于IM(P<0.001或0.01),其中DDP比 As2O3略高,但无统计学差异。结果见表1-3及图1。
表1 IM作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)

表1 IM作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)
注:与上一剂量组比较 *P<0.001;▲P<0.05;□P<0.01
Late apoptosis Early apoptosis Normal cell Necrotic cell(%)IM(μM)0.0 5.34±0.35 0.09±0.01 94.00±2.1 0.57±0.05 1.25 40.14±1.72* 0.69±0.03* 55.50±1.68 1.72±0.85 2.5 61.91±2.13* 3.85±1.12▲ 32.80±1.68 1.40±0.11 5.0 75.28±1.86* 3.79±0.92 19.34±1.13 2.08±0.45 10.0 51.46±2.37 30.84±2.25* 12.98±1.59 5.47±1.18▲20.0 18.57±1.06 34.96±1.60□ 1.49±2.26 44.96±2.16*
表2 As2O3作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)
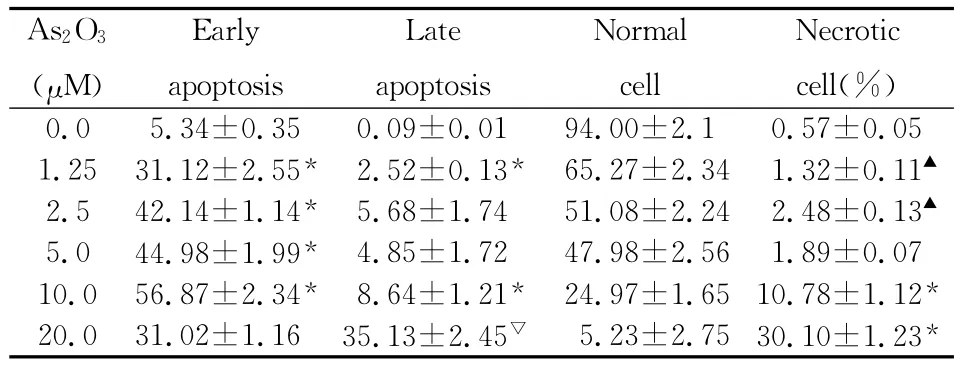
表2 As2O3作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)
注:与上一剂量组比较 *P<0.001,▲P<0.05,▽P<0.01
As2O3(μM)Early apoptosis Late apoptosis Normal cell Necrotic cell(%)0.0 5.34±0.35 0.09±0.01 94.00±2.1 0.57±0.05 1.25 31.12±2.55* 2.52±0.13* 65.27±2.34 1.32±0.11▲2.5 42.14±1.14* 5.68±1.74 51.08±2.24 2.48±0.13▲5.0 44.98±1.99* 4.85±1.72 47.98±2.56 1.89±0.07 10.0 56.87±2.34* 8.64±1.21* 24.97±1.65 10.78±1.12*20.0 31.02±1.16 35.13±2.45▽ 5.23±2.75 30.10±1.23*
表3 DDP作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)
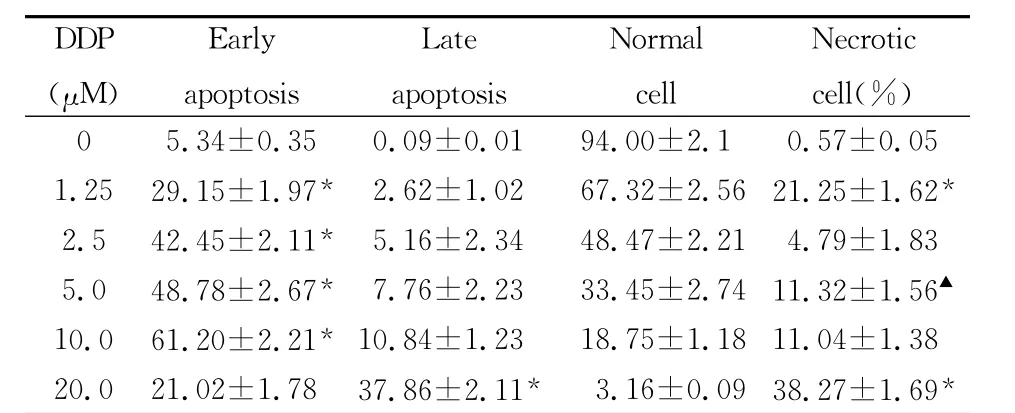
表3 DDP作用NCI-H44624h后对细胞凋亡的影响(n=3,,η%)
注:与上一剂量组比较 *P<0.001;▲P<0.05
DDP(μM)Early apoptosis Late apoptosis Normal cell Necrotic cell(%)0 5.34±0.35 0.09±0.01 94.00±2.1 0.57±0.05 1.25 29.15±1.97* 2.62±1.02 67.32±2.56 21.25±1.62*2.5 42.45±2.11* 5.16±2.34 48.47±2.21 4.79±1.83 5.0 48.78±2.67* 7.76±2.23 33.45±2.74 11.32±1.56▲10.0 61.20±2.21* 10.84±1.23 18.75±1.18 11.04±1.38 20.0 21.02±1.78 37.86±2.11* 3.16±0.09 38.27±1.69*
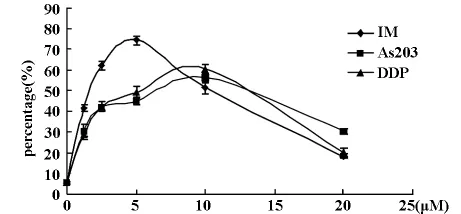
图1 IM、As2O3、DDP 作用 NCI-H446 24h后对早期细胞凋亡的影响
2.2 细胞凋亡相关基因转录水平的变化 采用RT-PCR方法检测5μM IM作用NCI-H446细胞6-48h后Bax mRNA水平的变化。结果显示:IM组细胞Bax mRNA及Caspase-3mRNA水平高于对照组(P<0.001),存在着时间依赖性增高趋势,至24h达到最高;而Bcl-2mRNA水平低于对照组(P<0.001),存在着时间依赖性降低趋势,至24h达到最低。结果见表4。
表4 经5μmol/L IM处理后不同时间点NCI-H446细胞中Bax、Bcl-2及 Caspase-3mRNA 水 平 与 β-actin水 平 的比值(n=3,)

表4 经5μmol/L IM处理后不同时间点NCI-H446细胞中Bax、Bcl-2及 Caspase-3mRNA 水 平 与 β-actin水 平 的比值(n=3,)
*P<0.001vs control group
Time(h) Bax mRNA Bcl-2mRNA Caspase-3mRNA 0 0.55±0.010 1.40±0.024 0.47±0.025 6 0.85±0.028* 1.19±0.020* 0.66±0.035*12 1.14±0.059* 1.10±0.018* 1.22±0.080*24 1.66±0.030* 0.95±0.021* 1.42±0.025*48 0.69±0.023* 0.91±0.014* 1.09±0.013*
2.3 Western Blot法检测 Bcl-2、Bax、Caspase-3蛋白水平变化 采用Western Blot法检测不同浓度(0、1.25、2.5、5及10μM)IM 作用 NCI-H446 24h后,细胞凋亡抑制基因Bcl-2、凋亡促进基因Bax、Caspase-3蛋白水平变化。结果显示:IM各浓度组细胞Bcl-2蛋白水平均低于对照组,且存在着浓度依赖性降低趋势;IM各浓度组细胞Bax蛋白水平均高于对照组,且存在着浓度依赖性增高趋势;各组均可见32kDa的Caspase-3蛋白酶原表达,各实验组在17kDa处可见一裂解的小片段,并随剂量的加大颜色逐渐加深,对照组未检测到17kDa的小片段,表明在IM的作用下Caspase-3蛋白酶原被剪切活化。
3 讨论
本实验选择有开发潜力的IM作为研究对象,选择疗效肯定的顺铂(DDP)和同样具有剧毒的三氧As2O3为对照,探讨IM诱导细胞凋亡的作用及机制。结果表明,IM诱导小细胞肺癌细胞凋亡与As2O3和DDP有同样疗效,且有较低使用浓度和高的早期凋亡率。理想抗癌药就是以最小的剂量产生最大的疗效,诱导细胞产生凋亡而不是坏死。因此IM具备这样的条件,可能成为最有开发潜力的抗癌药物之一。杨惠芬等[6]通过比较氯化汞(HgC12)和As2O3的诱导凋亡作用也证实,汞的诱导凋亡和杀死细胞能力强于砷。哈尔滨医科大学最早生产的癌灵1号(713注射液)以As2O3和HgC12为主要成份。1990年后,因为HgC12不易溶于水,且测不出其浓度,所以不再加入制剂中。然而,去HgC12后,抗癌作用减弱。
细胞凋亡是一个复杂、精密的过程,在诸多调控凋亡的信号转导途径中,线粒体跨膜电位崩解是细胞凋亡特异性早期指标之一,这是由于其通透性转换孔(permeability transition pore,PTP)开放引起线粒体通透性转换的直接后果。本研究检测了调控PTP开放和关闭的两个关键基因Bcl-2和Bax在mRNA及蛋白水平的变化,显示IM组细胞凋亡抑制基因Bcl-2mRNA及蛋白表达水平均低于对照组,而凋亡促进基因Bax mRNA及蛋白表达水平均高于对照组。说明IM在上述基因的转录翻译过程中有重要调控作用。Bax相对量高于Bcl-2,Bax同二聚体的数量增多,促进了PTP的开放,启动了细胞凋亡的线粒体途径,加速了细胞凋亡[7]。此外,蛋白酶家族Caspase在凋亡程序的启动及执行过程中发挥了非常重要的作用。故本实验检测了最具代表性的 Caspase-3蛋白水平的变化,显示IM 组Caspase-3mRNA水平高于对照组,说明IM在转录水平调控了该基因的表达;Western blot结果显示随着浓度的增加,凋亡的进展,活性酶亚基P17的产生愈来愈多,说明IM可使翻译后酶前体活化,即IM在双重水平上调控了Caspase-3。当浓度达到10μmol/L时,活性酶亚基P17却呈下降趋势,这是因为坏死细胞增加,使 Caspase-3的活性下降[8]。上述实验结果说明IM诱导NCI-H446细胞凋亡是通过调控凋亡相关基因表达实现的。它下调Bcl-2表达、上调Bax表达,使得Bcl-2/Bax比例降低,使得PTP孔不可逆的开放,线粒体膜外的小分子可以进入到膜内,使线粒体膜电位消失,外膜破坏,经系列反应进而活化Caspase-3,使其不能修复损伤的DNA,进而细胞发生凋亡。
综上所述,IM在诱导细胞凋亡方面与As2O3和DDP作用相同,但在同等剂量下,IM作用强于后两者,如果结合它的挥发性,则将是吸入治疗中心型肺癌的理想用药,故IM可能成为最有开发潜力的抗癌药物之一。
[1]刘秀花,费秉元,袁长吉,等.甲基汞_L_半胱氨酸共轭物诱导恶性脑胶质瘤凋亡的体外研究[J].中国实验诊断学,2012,16(4):579.
[2]丁 会,许力军,李 丹.氯化甲基汞对小细胞肺癌NCI.H446细胞的增殖抑制作用[J].中国免疫学杂志,2009,25(12):1085.
[3]王 锷,郭曲练,谭秀娟,等.凋亡相关基因 Bcl-2、Bcl-xl和 Bax mRNA在大鼠缺血预处理脑组织中的表达[J].中华麻醉学杂志,2000,20(9):540.
[4]李玉祥,罗小平,廖玲洁,等.高氧对新生大鼠肺Caspase-3和p53基因表达及肺细胞凋亡的影响[J].中华儿科杂志,2005,43(8):585.
[5]赵 平,陈 华,崔建君,等.产前缺氧性适应后胎鼠、新生大鼠脑内凋亡相关基因Bcl-2、Bax mRNA的表达[J].中华麻醉学杂志,2002,22(5):297.
[6]杨惠芬,李明勋,张 鹏.氯化汞、三氧化二砷及阿糖胞苷对K562和 HEL细胞株作用的比较[J].临床血液学杂志,2003,16(5):243.
[7]Thornberry NA,Lazebnik Y.Caspases:Enemies within[J].Science,1998,281 (5381):1312.
[8]Oliver F J,de la Rubia G,Rolli V,et al.Importance of poly(ADP-ri-bose)polymerase and its cleavage in apoptosis.Lesson from an uncleavablemutant[J].J Biol Chem,1998,273(50):335.

