hAP-2α转录因子酵母双杂交诱饵载体的构建及自激活检测
黄前川,杨长亮,曹军皓,丁进亚
(广州军区武汉总医院1.检验科;2.耳鼻喉科,湖北 武汉430070)
AP-2(activator protein 2)为一类转录因子家族,包括5个成员,即 AP-2α,β,γ,δ和ε,分子量约为52kDa,参与发育、分化和凋亡等生理过程[1]。已证实过度表达的HER-2是乳腺癌预后不良及药物治疗靶点[2],HER-2基因启动子上有人 hAP-2α(human activator protein 2alpha,hAP-2α)的结合位点,因而 hAP-2α可以促进 HER-2基因转录[3],免疫组化实验发现人乳腺癌组织中hAP-2α与HER-2表达明显正相关[4],可见 hAP-2α高表达是乳腺癌一个重要的分子标志。最近几年的研究发现一些hAP-2α结合蛋白参与hAP-2α介导的乳腺癌病变过程。这些蛋白包括 DEK[5]和 Yin Yang 1[6]等。它们本身不是转录因子,但是可以结合转录因子而增强其转录活性。本实验旨在构建hAP-2α转录因子酵母双杂交诱饵载体,为进一步系统分析hAP-2α及其相互作用蛋白在乳腺癌发生机制中的作用奠定基础。
1 材料与方法
1.1 材料 酵母双杂交系统的诱饵表达载体质粒pGBKT7、系统阳性对照质粒pGBK7-53,阴性对照质粒pGBKT7-Lam和酵母工程菌株AH109均购自美国Clontech公司;大肠埃希杆菌DH5α为本实验室保存菌株;宫颈癌Hela细胞株由武汉大学基础医学院提供;T4DNA连接酶购自美国Promega公司;限制性内切酶、MulV Reverse Transcriptase均购自加拿大Ferments公司;Trizol试剂购自美国Invit rogen公司;Myc单克隆抗体购自碧云天生物技术研究所;引物由上海生工公司合成。
1.2 方法
1.2.1 hAP-2α表达序列的克隆 常规培养和传代宫颈癌Hela细胞株,使用Trizol裂解法提取细胞总mRNA,逆转录合成cDNA;取1μl cDNA为模板,依次在PCR反应体系中加入反应物:10×缓冲液2.5μl、dNTP 0.5μl、hAP-2α引物各(50mmol/L)0.5μl、Taq酶 0.5μl和ddH2O 19.5μl;PCR反应条件:94℃预变性5min;94℃30s,63℃35s,72℃50s,循环30次;72℃10min。引物设计如下:3’-CGGAATTCATGCTTTGGAAATTGACG G-5’,3’-AGTCGACTCACTTTCTGTGCTTCTC CT-5’,分别在两端引入酶切位点SalⅠ和EcoRⅠ;1.0% 琼脂糖凝胶电泳检测反应产物目的条带。
1.2.2 构建pGBKT7-hAP2α诱饵载体 hAP-2α基因扩增产物和pGBKT7载体用SalⅠ、EcoRⅠ酶切,用 T4DNA 连接酶连接hAP-2α 基因和pGBKT7载体酶切产物,将连接产物转化DH5α感受态细胞后进行培养;挑取阳性克隆,抽提重组质粒,进行测序鉴定及酶切鉴定。
1.2.3 重 组 质 粒 pGBKT7-hAP2α 转 化 酵 母AH109菌株及鉴定 用PEG/LiAc法将诱饵质粒pGBKT7-hAP2α和构建猎物质粒载体pACT2转化入酵母感受态细胞AH109,将转化有重组质粒的感受态细胞涂布于SD-Leu-Trp平板,30℃培养2-3d,将长出的克隆连同阴阳对照一起接种于新的SD-Leu-Trp平板上,30℃维持生长12h,复制至SD-Leu-Trp-His-Ade营养缺陷型平板做自激活活性鉴定。
1.2.4 蛋白质印迹技术分析诱饵质粒pGBKT7-hAP2α蛋白表达 用醋酸锂法将pGBKT7-AP2α转化酵母细胞AH109,在SD-Leu-Trp培养基上进行筛选,挑取2-3mm大小的菌落过夜培养后,提取酵母蛋白质表达产物进行Western免疫印迹分析。由于酵母表达载体pGBKT7的多克隆位点带有人Myc标签,我们所表达的融合蛋白亦带有此标签,所以用抗人Myc单克隆抗体可与之产生免疫反应。同时提取AH109空菌蛋白作为阴性对照。
2 结果
2.1 hAP2α基因的扩增
紫外分光光度计测定总mRNA浓为2.21μg/μl,A260/A280吸光度比值为1.87,说明总 mRNA浓度和纯度均高,反转录为cDNA后成功扩增出目的基因hAP2α,经1%的琼脂糖凝胶电泳可见扩增产物位于1 300bp左右处,与目的基因大小相吻合(图1)。
2.2 pGBKT7-hAP2α诱饵载体构建
将hAP2α基因与载体pGBKT7构建的诱饵载体pGBKT7-hAP2α转化DH5α感受态细胞,摇菌提取质粒,电泳鉴定,可见大小约8 600bp左右的pGBKT7-hAP2α连接产物(图2),并且hAP2α测序正确(结果未显示);用SalI和EcoRI双酶切后鉴定,可见1 300bp的hAP2α基因和7 300bp左右的pGBKT7(图3),条带大小与预期结果一致,说明诱饵载体pGBKT7-hAP2α构建正确。
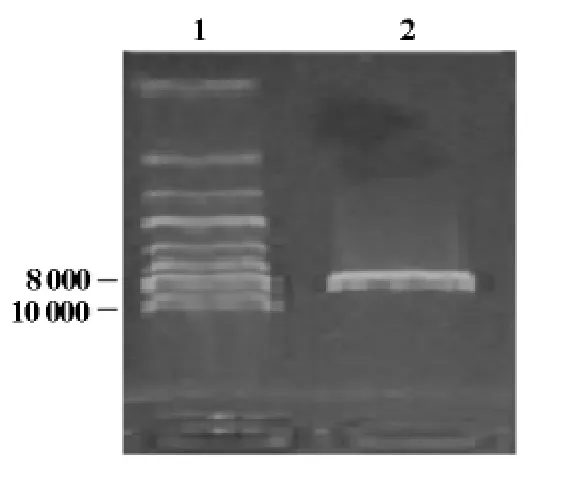
图2 pGBKT7-hAP2α连接产物电泳
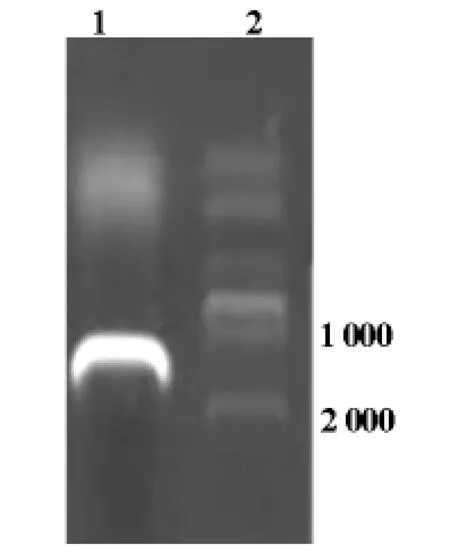
图1 AP2α扩增产物电泳
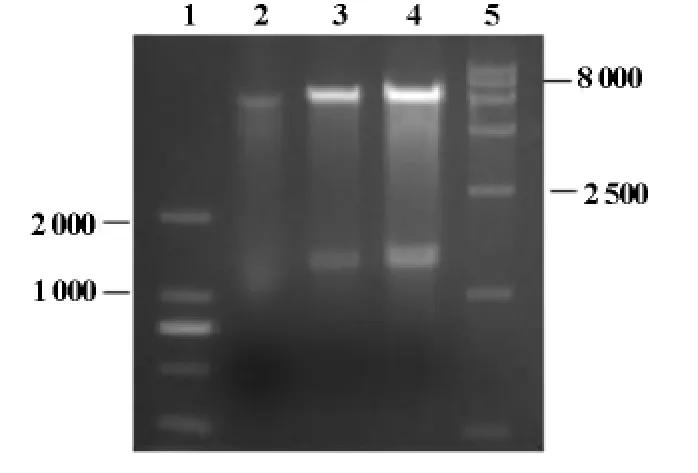
图3 重组质粒pGBKT7-AP2α用SalⅠ和EcoRⅠ双酶切鉴定
2.3 诱饵蛋白自激活检测
转化pGBKT7-hAP2α重组质粒的AH109感受态细胞能够在SD-Leu-Trp选择皿上生长(图4-B),不能在SD-Leu-Trp-His-Ade(图4-C)选择皿上生长,而系统阳性对照转化子可在SD-Leu-Trp-His-Ade选择皿上生长(图4C)),证明没有自身激活报告基因的活性,无需3AT抑制。所用的酵母菌株为Clontech系统的AH109,阳性对照PC为pGADT7-T+ pGBKT7-53,阴 性 对 照 NC 为pGADT7-T+pGBKT7-Lam。
2.4 蛋白质印迹分析pGBKT7-hAP2α诱饵蛋白的表达
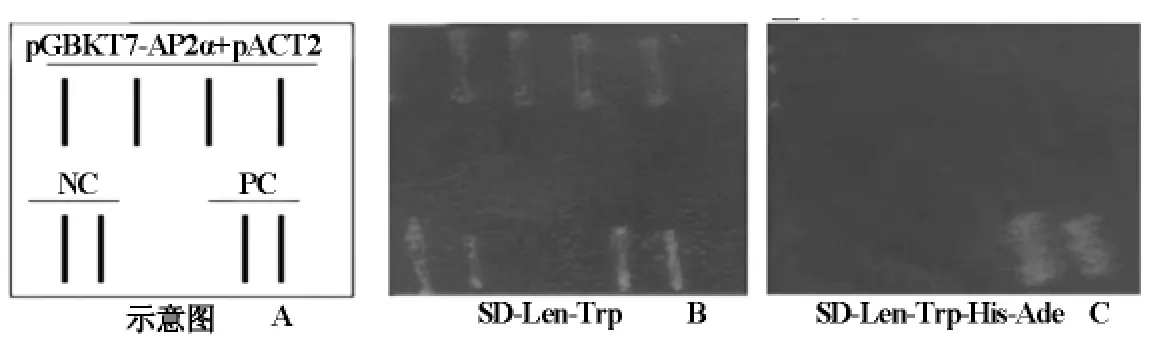
图4 诱饵载体pGBKT7-hAP2α自激活鉴定
提取未转化质粒(对照组)与转化了pGBKT7-hAP2α质粒(实验组)的酵母蛋白质,Western免疫印迹分析结果显示:对照组无表达,而实验组可见明显目的条带且无杂带,该融合蛋白的相对分子质量大小约52KD,条带大小与预期结果相一致,说明该诱饵质粒在AH109酵母细胞中能稳定表达。

图5 pGBKT7-hAP2α在酵母细胞表达的Western blotting结果
3 讨论
hAP转录因子家族与乳腺癌的发生相关,其中hAP-1转录因子在乳腺癌的形成、转移和侵袭中发挥重要作用[7],而hAP-2α转录因子高表达则促进HER-2癌基因的转录而导致乳腺癌。在前期研究中,我们发现抑制乳腺癌细胞中hAP-2α可引起细胞中HER2-mRNA及其蛋白的表达水平显著下降,同时癌细胞的生长受抑制,提示hAP-2α基因在乳腺癌细胞的发生、发展中具有重要作用[8],进一步研究则发现乳腺癌细胞中DEK蛋白促进乳腺癌中hAP-2α对 HER2转录作用[4],DEK 这类自身不是转录因子,却能与hAP-2α形成复合物并增强hAP-2α转录活性的蛋白叫做转录共激活因子[9],具有协同hAP-2α参与乳腺癌的发生。因此,系统地鉴定hAP-2α结合蛋白并探讨它们在乳腺癌发病中的作用将有利于阐明hAP-2α的致癌机制,这些hAP-2α结合蛋白本身也可以成为潜在的肿瘤标志物和药物治疗的靶点,对于乳腺癌的预防和治疗将具有重要意义。
本实验将hAP2α基因克隆于含有Myc标签的pGBKT7载体中,正确构建诱饵质粒pGBKT7-hAP2α,Myc标签单克隆抗体所检测融合蛋白大小与预期的hAP2α融合蛋白质一致(图5),说明hAP2α蛋白在酵母中表达成功,并且无自激活作用(图4),诱饵载体pGBKT7-hAP2α的构建不仅为下一步应用酵母双杂交技术寻找乳腺癌中未知hAP2α作用蛋白奠定了基础,同时也为寻找新的乳腺癌标志物和治疗靶点提供了研究方法。
[1]Thewes V,Orso F,Jäger R,et al.Interference with activator protein-2transcription factors leads to induction of apoptosis and an increase in chemo-and radiation-sensitivity in breast cancer cells[J].BMC Cancer,2010,10(192):1.
[2]Brand FX,Ravanel N,Gauchez AS,et al.Prospect for anti-her2 receptor therapy in breast cancer[J].Anticancer Res,2006,26(1B):715.
[3]Li M,Wang Y,Hung MC,et al.Inefficient proteasomal-degradation pathway stabilizes AP-2alpha and activates HER-2/neu gene in breast cancer[J].Int J Cancer,2006,118(4):802.
[4]Pellikainen J,Naukkarinen A,Ropponen K,et al.Expression of HER2and its asso-ciation with AP-2in breast cancer[J].Eur J Cancer,2004,40(10):1485.
[5]黄前川,曹军皓,季 蒙.癌基因DEK和转录因子AP-2α协同促进乳腺癌中 HER2的高表达[J].基础医学与临床,2010,30(2):175.
[6]Desmond G Powe,Gulfareen Akhtar,Hany o Habashy,et al.Investigating AP-2and YY1protein expression as a cause of high HER2gene transcription in breast cancers with discordant HER2 gene amplification[J].Breast Cancer Research,2009,11(6):1.
[7]殷咏梅,束永前,陈晓锋,等.TNF-α通过JNK和 AP-1途径调节乳腺癌MCF-7细胞VEGF的表达[J].中国肿瘤生物治疗杂志,2009,16(1):12.
[8]黄前川,曹军皓,丁进亚.RNAi干扰 AP-2α对人乳腺癌细胞HER2表达及细胞增殖的影响[J].实用癌症杂志,2009,24(4):345.
[9]Näär AM,Lemon BD,Tjian R.Transcriptional coactivator complexes[J].Annu Rev Biochem,2001,70(1):475.
——一道江苏高考题的奥秘解读和拓展

