AP-2α对基质金属蛋白酶-20作用的研究
赵 娜,王玉民,孙学玲,曲 正,孙 岩,张娟娟,高玉光
(山东:1.潍坊医学院口腔医学研究所,潍坊 261053;2.山东大学附属齐鲁医院口腔科,济南 250012;3.滨州医学院附属医院口腔科,滨州 256603)
AP-2(Activating protein-2,AP-2)是一类具有细胞类型特异性结合DNA的转录因子家族,在哺乳动物胚胎发育和细胞生长、分化以及凋亡中起重要的作用[1]。金属基质蛋白酶-20(matrix metalloproteinase 20,MMP20)主要在成釉细胞分泌期降解釉质蛋白,是一种牙齿特异表达的基质金属蛋白酶,与釉质发育密切相关。分析发现MMP-20基因启动子区含有AP-2结合位点,而且AP-2转录因子家族中 AP-2α 在成釉细胞中表达最强[2-3],本研究拟运用生物信息工具分析与MMP-20启动子特征性序列相互作用的转录因子AP-2α,并通过一系列实验探讨AP-2α对MMP-20基因表达的影响,为进一步研究釉质发育过程中的基因表达调控奠定基础。
1 材料和方法
1.1 主要材料
UNIQ-10柱式DNA胶回收试剂盒、UNIQ-10柱式质粒小量抽提试剂盒、UNIQ-10柱式PCR产物纯化试剂盒(Bio Basic Inc公司,美国);PrimeSTAR HS DNA Polymerase、RNAiso Plus、PrimeScript® RT reagent Kit、siRNA-AP-2α(TaKaRa,日本);HindⅢ、XbaⅠ、BstxI、XhoI、MluI(NEB 公司,美国);Trans-Fast TMTransfection Reagent、Dual-Luciferase® 双萤光素酶报告基因检测系统(Promega公司,美国);SYBR Green PCR Master Mix(Roche公司,瑞士),反转录试剂盒、DNA Marker#SM0331(Fermentas公司,美国);胎牛血清 (杭州四季青公司),胰蛋白酶、DMEM培养基(Hyclone公司,美国),IQ5TM PCR仪(Bio-Rad公司,美国);Protein A Agarose beads(Upstate公司,美国)。
1.2 方法
1.2.1 小鼠 AP-2α 基因克隆及重组质粒 pcDNA3.1/myc-HisA-AP-2α 的构建
小鼠成釉细胞系为日本秋田大学Sugiyama等馈赠。将传至第三代的成釉细胞用RNAiso Plus提取Total RNA,再用M-MLV RTase cDNA Synthesis Kit(宝生物)合成cDNA(小鼠总DNA)作为PCR的模板。根据Genbank中公布的小鼠AP-2α基因序列及引物设原则,利用Primer primer 5.0进行引物设计。上游:5'-GGAAGCTTGGATGTTAGTTCACAGTT-3'(HindⅢ);下 游:5'-GCGGTCTAGACTTTCTGTGTTTCTC-3'(XbaI),由宝生物工程(大连)有限公司合成。预扩增AP-2α mRNA的1293个碱基DNA片段,PCR反应条件为35个循环:98℃ 10 s,59℃ 15 s,72℃ 3 min。经双酶切、连接、转化等构建重组质粒pcDNA3.1/myc-HisA-AP-2α,并进行酶切及测序鉴定(南京金斯瑞公司)。正确者命名为 pcDNA3.1/myc-HisA-AP-2α。
1.2.2 RNA 干扰阻断 AP-2α 表达时 AP-2α 和MMP-20 mRNA 的表达
依据Elbashir等提出的小干扰RNA设计原则设计一对靶向AP-2α基因的特异性双链 siRNA(siRNA-AP-2α)。HPLC 级别纯化的双链 siRNA和作为RNA干扰阴性对照的一对无关siRNA均在TaKaRa公司合成。以双链siRNA瞬时转染60 h后的成釉细胞总RNA逆转录的cDNA为模板,进行实时定量PCR。引物序列:内参对照GAPDH,F:5’-TGTGTCCGTCGTGGATCTGA-3’;R:5’-TTGCTGTTGAAGTCGCAGGAG - 3’;MMP20, F:5’-GGCGAGATGGTGGCAAGAG-3’;R:5’-CTGGGAAGAGGCGGTAGTT-3’;AP-2α,F:5' -GGAGAGCGAAGTCTAAGAATGG-3’;R:5’-TAGTGACGTGAGGAGGGTAACG-3’。反应条件 94℃4 min,94 ℃ 10 s,60℃ 15 s,72℃ 25 s,80℃ 15 s采集荧光,40个循环后72℃延伸1 min。反应在IQ5TMPCR仪进行,每个样本3个复孔,重复3次。CT值由荧光PCR仪在扩增过程中自动读出,所得CT值结果进行2-△△ CT分析[5]。
1.2.3 AP-2α 不同剂量过表达时对 MMP-20 基因启动子转录活性的影响
成釉细胞长至70% ~80%汇合时,按照Trans-FastTM Transfection Reagent说明书进行转染。成釉细胞中转染空质粒pcDNA 3.1/myc-hisA作为阴性对照,pRL40质粒作为内参照,实验分为5组,组1:10 ng pcDNA 3.1/myc-HisA-AP-2α 质粒,390 ng空质粒 pcDNA 3.1/myc-hisA;组 2:50 ng pcDNA 3.1/myc-HisA-AP-2α 质粒,350 ng空质粒pcDNA 3.1/myc-hisA;组3:100 ng pcDNA 3.1/myc-HisA-AP-2α 质粒,300 ng 空质粒 pcDNA 3.1/myc-hisA;组4:400 ng pcDNA 3.1/myc-HisA-AP-2α 质粒,0 ng空质粒 pcDNA 3.1/myc-hisA;组 5:0 ng pcDNA 3.1/myc-HisA-AP-2α 质粒,400 ng空质粒pcDNA 3.1/myc-hisA。每组各加入构建的pGL3 -MMP-20(511 bp)质粒400 ng。参照 Dual-Luciferase®双萤光素酶报告基因检测系统检测萤火虫荧光素酶(Firefly luciferase)激发底物释放荧光的数值(U1)及海肾荧光素酶(Renilla luciferase)激发底物释放荧光的数值(U2)。以每一样品所测U1/U2之比为该质粒报告基因的荧光素酶相对活性。每组3个复孔,重复3次。根据此实验检测结果,将均转染 pcDNA 3.1/myc-HisA-AP-2α 400 ng者用于后续实验。
1.2.4 AP-2α 过表达时不同长度 MMP-20 基因启动子转录活性变化
按照TransFastTM Transfection Reagent说明书进行重组质粒pcDNA 3.1/myc-HisA-AP-2α 瞬时转染小鼠成釉细胞。以转染空质粒pcDNA 3.1/myc-hisA的成釉细胞作为阴性对照(control),pRL40质粒作为内参照,实验分为10组,组1:400 ng空质粒 pcDNA3.1/myc-hisA+400 ng pGL3 -MMP-20(102bp);组 2:400 ng空质粒 pcDNA3.1/myc-hisA+400 ng pGL3-MMP-20(197bp);组 3:400 ng空质粒 pcDNA3.1/myc-hisA+400 ng pGL3-MMP-20(394 bp);组 4:400 ng 空质粒 pcDNA3.1/myc-hisA+400ng pGL3-MMP-20(511bp);组 5:400ng空质粒 pcDNA3.1/myc-hisA+400ng pGL3-MMP-20(1200 bp);组6:400 ng pcDNA 3.1/myc-HisA-AP-2α +400 ng pGL3-MMP-20(102bp);组7:400ng pcDNA3.1/myc-HisA-AP -2α +400 ng pGL3-MMP-20(197bp);组 8:400 ng pcDNA3.1/myc-HisA -AP-2α +400ng pGL3-MMP-20(394bp);组 9:400 ng pcDNA3.1/myc-HisA -AP-2α +400 ng pGL3-MMP-20(511 bp),组 10:400 ng pcDNA3.1/myc-HisA-AP-2α +400 ng pGL3-MMP-20(1200 bp)。参照 Dual-Luciferase® 双萤光素酶报告基因检测系统(Promega公司)进行检测。本研究每组3个复孔,重复3次。根据此实验检测结果,后续实验将对MMP-20启动子511 bp(-488~+23)片段进行研究。
1.2.5 染色体免疫共沉淀技术研究 AP-2α 与MMP-20启动子的相互作用
成釉细胞无血清DMEM培养48 h后,400 nmoL/L PMA刺激30 min。细胞经甲醛交联后,以每5管大约3×107个细胞分装。SDS Lysis Buffer裂解细胞并进行超声处理(200 bp~1000 bp)(取部分用于Input)后,加入适量含1 mmoL/L PMSF的ChIP Dilution Buffer进行稀释,使最终OD260为2。实验组按浓度1∶500滴加兔抗鼠AP-2α抗体(Santa Cruz公司),同时IgG组滴加等浓度的羊抗兔无关抗体,阴性对照不加任何抗体,4℃孵育过夜。实验组和对照组分别加入适量Protein A Agarose/Salmon Sperm DNA,在4℃孵育60 min后,对沉淀进行洗涤并用Elution buffer洗脱。经逆转交联及蛋白消化后,以纯化DNA片段为模板进行PCR反应。利用TFSEARCH、AliBaba 2.1 工具分析得到 AP-2α 与MMP-20结合的特征性序列GCCTGTGGG,对预测的结合位点设计一对引物:上游:5’-ATGTAGGTCCTGGGGAATGAAC-3’,下 游:5’-GCTATGTACAGAAATTGGTATGAGC-3’,预扩增片段为183 bp(大连宝生物公司合成)。分别用 1、2、5、8 μL 的 Input作为模板摸索出相应的PCR条件,并选择一组效果较好的用于最终的PCR检测。PCR反应条件为35个循环:94℃ 30 s,56℃ 30 s,72℃ 20 s。PCR反应结束后,取10 μL反应液进行20 g/L琼脂糖凝胶电泳,观察并拍照。
1.2.6 小鼠 MMP-20基因启动子特征性序列的定点突变
根据以上实验结果并利用生物信息工具,将特征性序列GCCTGTGGG定点突变为GTTTGTAAG,并设计突变引物,上游:5’-GCTTGTTTGTAAGTGCAAATAAAGAG-3’,下游:5’-CTGATGACCTGGGTTCATTCC-3’(大连宝生物公司合成)。然后以本实验室提供的重组质粒 pMD18-T-MMP-20(-488~ +23,511bp)为模板,按照 TaKaRa MutanBEST Kit说明书进行定点突变,并构建小鼠pGL3-MMP-20突变质粒。通过单酶切(MluI酶)和DNA序列分析(南京金斯瑞公司完成)进行鉴定,正确者命名为pGL3-MMP-20突变体。
1.2.7 AP-2α过表达及RNA干扰阻断其表达时野生型和突变型MMP-20基因启动子转录活性变化
重组质粒 pcDNA3.1/myc-HisA-AP-2α 瞬时转染小鼠成釉细胞。pRL40质粒作为内参照,将实验分为 4组,组 1:400 ng空质粒 pcDNA 3.1/myc-hisA+400 ng pGL3-MMP-20(511 bp)野生型;组2:400 ng pcDNA3.1/myc-HisA-AP-2α +400 ng pGL3-MMP-20(511 bp)野生型;组 3:400 ng空质粒 pcDNA3.1/myc-hisA+400 ng pGL3 -MMP -20(511 bp)突变型;组4:400 ng pcDNA3.1/myc-HisA-AP-2α +400 ng pGL3-MMP-20(511 bp)突变型。每组3个复孔,重复3次。继续培养30 h后,双荧光素酶报告基因检测系统检测。
双链siRNA瞬时转染小鼠成釉细胞,48 h后进行野生型MMP-20基因启动子和突变型MMP-20基因启动子瞬时转染。pRL40质粒作为内参照,将实验分为4组,组1:无关siRNA转染情况下400 ng pGL3-MMP-20(511 bp)野生型;组 2:双链siRNA转染情况下400 ng pGL3-MMP-20(511 bp)野生型;组 3:无关 siRNA转染情况下 400 ng pGL3-MMP-20(511 bp)突变型;组4:双链 siRNA转染情况下400 ng pGL3-MMP-20(511 bp)突变型。每组3个复孔,重复3次。继续培养36 h后,双荧光素酶报告基因检测系统检测。
1.3 统计分析
采用SPSS 11.0统计软件进行统计分析,组间比较用配对t检验,检验水准α=0.05。
2 结果
2.1 小鼠AP-2α 基因的克隆
小鼠AP-2α基因PCR扩增产物经琼脂糖凝胶电泳检测,该条带大小与目的片段的大小一致(图1a)。重组质粒 pcDNA3.1/myc-HisA-AP-2α的酶切鉴定如图1b所示:单酶切所得片段大小为6719 bp;双酶切释放的片段为1396 bp,余下的片段为5323 bp,与预测结果一致。经初步鉴定正确的重组质粒 pcDNA3.1/myc-HisA-AP-2α 送由金斯瑞公司进行序列分析,得到的基因测序结果经BLAST分析后,与GenBank中登录基因序列完全一致,无点突变及移码突变发生(图1c)。
2.2 RNA 干扰阻断 AP-2α 表达时 AP-2α 和MMP-20 mRNA表达变化
成釉细胞中转染无关siRNA和siRNA-AP-2α后,60 h时发现AP-2α mRNA表达水平后者比前者下降约30%,表明AP-2α siRNA对AP-2α基因表达的干扰效果较好(P<0.05);MMP-20 mRNA 表达水平后者比前者上升1.9倍,表明小鼠转录因子AP-2α对MMP-20的表达有抑制作用(P <0.05)(图2)。
2.3 AP-2α 不同剂量过表达时对 MMP-20基因启动子转录活性的影响
随着AP-2α转染剂量的增长,MMP-20启动子的荧光素酶活性明显减弱,说明小鼠转录因子AP-2α对MMP-20的表达有抑制作用,并且AP-2α在转染400 ng时对MMP-20启动子表达的抑制作用最强(P <0.05)(图 3a)。因此,将均转染 pcDNA3.1/myc-HisA-AP-2α 400ng用于后续试验。
在检测转录因子AP-2α过表达时不同长度小鼠MMP-20基因启动子转录活性变化发现,400 ng pcDNA3.1/myc-HisA-AP-2α 转染细胞后,与 pcDNA3.1/myc-hisA 比较,小鼠转录因子 AP-2α 对MMP-20启动子(-488~+23)511 bp片段的表达抑制作用最明显(P<0.05)(图3b)。因此,后续实验将对MMP-20启动子511 bp片段进行研究。
2.4 AP-2α 与 MMP-20 启动子的相互作用
超声结束后,取少量进行琼脂糖凝胶电泳,观察超声处理对于基因组DNA的剪切效果。如图4a所示,DNA大部分已断裂成200~1000 bp大小的片段,可继续下步实验。染色体免疫共沉淀实验结果扩增出大小为183 bp的片段,显示模板中含有预测的结合位点,表明小鼠MMP-20启动子序列与AP-2α可能在此位点结合(图4b),并为特征性序列的定点突变提供依据。
2.5 AP-2α过表达及RNA干扰阻断其表达时野生型和突变型MMP-20基因启动子转录活性变化
以实验室提供的重组质粒pMD18-T-MMP-20(-488~+23,511bp)为模板,将特征性序列GCCTGTGGG定点突变为 GTTTGTAAG,PGL3-MMP-20(511 bp)构建突变质粒,经酶切和DNA序列分析进行鉴定,突变体在预期位点发生突变(图5a)。
pcDNA3.1/myc-HisA-AP-2α 400 ng转染细胞后检测结果显示,与pcDNA3.1/myc-hisA比较,野生型 pGL3-MMP-20(511 bp)比突变型pGL3-MMP-20(511 bp)荧光素酶活性下降率高(P<0.05),表明对特征性序列进行突变后,AP-2α对MMP-20启动子511 bp片段的表达几乎无抑制作用(图5b)。成釉细胞中转染siRNA-AP-2α后检测结果显示,与无关siRNA相比较,野生型pGL3-MMP-20(511bp)表达水平升高,而突变型pGL3-MMP-20(511 bp)表达水平则降低(P <0.05)。不仅表明 AP-2α siRNA 对AP-2α 基因表达的干扰效果较好,消除了AP-2α对MMP-20启动子的抑制作用;而且表明了特征性序列突变后,AP-2α siRNA 对 MMP-20启动子的表达水平无显著影响(图5c)。再一次证明了转录因子AP-2α通过与MMP-20基因启动子特征性序列相互作用,从而抑制MMP-20表达。

图1 小鼠AP-2α基因的克隆

图2 RT-PCR检测RNA干扰阻断转录因子 AP-2α 表达时 AP-2α 和 MMP-20 mRNA的表达
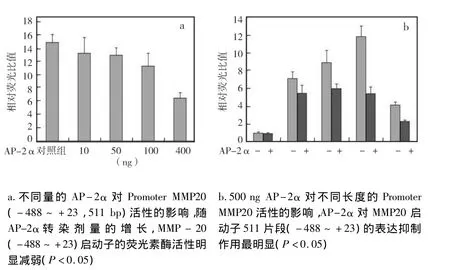
图3 双荧光素酶报告基因检测AP-2α不同剂量过表达时不同长度MMP-20基因启动子转录活性变化

图4 染色体免疫共沉淀研究AP-2α与MMP-20启动子的相互作用
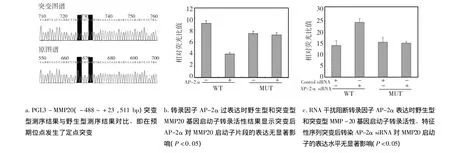
图5 双荧光素酶报告基因检测系统检测野生型(WT)和突变型(MUT)MMP-20基因启动子转录活性
3 讨论
基质金属蛋白酶 (matrix metalloproteinases,MMPs)是一个大家族,是自然进化中高度保守的一类酶,参与降解包括骨在内的全身各种组织细胞外基质(extracellular matrix,ECM)的蛋白酶家族。其中MMP-20的表达始于釉质分泌的早期阶段,是降解釉质基质蛋白的主要蛋白酶[2-3],能促进羟基磷灰石的沉积,利于釉质的矿化。
AP-2是一类具有细胞类型特异性结合DNA的转录因子家族,通过激活基因选择性地表达,参与一系列细胞生命活动,如细胞增殖、分化、凋亡的调控;在哺乳动物的胚胎发育过程中也扮演重要角色。到目前为止,在人类和小鼠中已经发现5个AP-2 家族成员,分别为 AP-2α,AP-2β,AP-2γ,AP-2δ and AP-2ε[1],其中 AP-2 转录因子能双向调节基因转录表达。AP-2通过调控这些基因的转录活动,影响细胞生命活动、细胞间稳态、胚胎发育等[2]。在 AP-2 家族中,AP-2α (activating protein)发现最早,是转录因子AP-2家族中的重要一员,在哺乳动物胚胎发育和细胞生长、分化和凋亡中起重要的作用[3-5],其抑癌效应也最为明确。敲除AP-2α基因的小鼠,可导致神经管、面部、眼和四肢的胚胎形成受到影响[2]。国内外对小鼠AP-2的研究多集中在癌症方面,而关于AP-2对釉质的影响目前尚无较多报道,该方面的研究将是探讨由MMP-20基因引起釉质发育疾病的一个重要切入点。本实验室在对小鼠成釉细胞内AP-2家族成员进行研究的过程中发现,AP-2α的表达最强,因此本实验选用AP-2α进行深入研究,探索其对MMP-20的调节作用,从而对釉质发育的影响。
本研究对小鼠AP-2α基因克隆后,进行RNA干扰阻断转录因子AP-2α表达,通过RT-PCR检测发现小鼠转录因子AP-2α对MMP-20的表达有抑制作用。再利用双荧光素酶报告基因检测系统,检测出小鼠转录因子AP-2α在转染400 ng时对MMP-20启动子表达的抑制作用最强,并且在转染400 ng时对MMP-20启动子511 bp片段的表达抑制作用最明显。根据此实验检测结果,将均转染pcDNA3.1/myc-HisA-AP-2α 400 ng者用于后续实验,并进一步对MMP-20启动子511bp(-488~+23)片段进行深入研究。利用染色体免疫共沉淀技术验证了AP-2α可能与MMP-20启动子特征性序列结合,调控MMP-20表达;进行小鼠MMP-20基因启动子特征性序列的定点突变,利用双荧光素酶报告基因检测系统检测AP-2α过表达和RNA干扰阻断转录因子AP-2α时野生型和突变型MMP-20基因启动子转录活性,结果进一步说明了转录因子AP-2α通过与MMP-20基因启动子特征性序列相结合,从而抑制MMP-20表达。本结果提示,小鼠AP-2α转录因子可与成釉细胞内MMP-20启动子的特征性序列相互作用,从而调控MMP-20的表达水平,在釉质形成过程中发挥作用,对于釉质疾病的预防及治疗具有潜在的指导意义。
[1]Clark IM,Swingler TE,Sampieri CL,et al.The regulation of matrix metalloproteinases and their inhibitors[J].Int J Biochem Cell Biol,2008,40(6 -7):1362 -1378.
[2]SulkaIa M,Larmas M,Sorsa T,et al.The locaIization of matrix metalloproteinases-20(MMP-20,enamelysin)in mature human teeth[J].J Dent Res,2002,81:603 -607.
[3]Turk BE,Lee DH,Yamakoshi Y,et al.MMP-20 is predominately a tooth-specific enzyme with a deep catalytic pocket that hydrolyzes type V collagen[J].Biochemistry,2006,45(12):3863-3874.
[4]Hilger-Eversheim K,Moser M,Schorle H,et al.Regulatory roles of AP-2 transcription factors in vertebrate development,apoptosis and cell cycle control[J].Gene,2000,260(1):1 -12.
[5]Kenneth JL,Thomas DS.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△ CT Method[J].Methods,2001,25(4):402-408.
——一道江苏高考题的奥秘解读和拓展

