两种消毒方法对壳聚糖温敏凝胶物理性能及生物学特性影响的研究
彭 博,臧圣奇,刘敏杰,马志伟,王新文,刘玲侠,王勤涛
(第四军医大学口腔医学院,陕西西安 710032)
牙周病是危害人类口腔和全身健康的主要口腔疾病,其所导致牙周支持组织丧失,是成年人牙齿丧失的主要原因之一。牙周治疗的目标不仅是控制炎症,更在于使已破坏的牙周组织再生以形成新附着。传统的牙周治疗和引导组织再生技术虽取得一定的临床效果,但尚不能达到上述目的。随着组织工程技术的发展,为牙周病的治疗开辟了新的思路和方法,而具有良好生物性能的支架材料一直是组织工程学研究的重点。
壳聚糖温敏凝胶是一种天然来源的聚阳离子生物聚合体,由于其来源广泛,且具有无毒性[1]、良好的生物相容性[2]和可降解性[3-4]、抗菌活性[5]、粘附性[6]以及促进组织再生等良好性能[7],已作为药物缓释系统[8]和支架材料[9]在医学、生物学领域得到了深入的研究和广泛的应用。
然而,传统的消毒方法会导致壳聚糖凝胶的物理性能不稳定,从而限制了在牙周组织工程中的应用,本研究通过改变壳聚糖的消毒方法,检测其凝胶化时间和粘度,并观察人牙周膜细胞在凝胶表面和凝胶浸提液中增殖情况,为其能作为更稳定的牙周组织工程支架材料提供实验室依据。
1 材料和方法
1.1 主要材料和仪器
壳聚糖(448877,DD≥85%,sigma公司,美国);β-甘油磷酸钠(β-GP;医药级,Merck公司,德国);α-MEM 培养基(Hyclone,美国);胎牛血清(北京赛默飞世尔生物化学制品有限公司);电子天平(JY2002,上海良平仪表);0.22 μm 除菌滤器、酶标仪(TECAN sunrise,奥地利);倒置荧光显微镜(Leica DM6000B,德国 )。
1.2 两种消毒方法制备壳聚糖温敏凝胶
1.2.1 传统消毒方法制备壳聚糖温敏凝胶
称取0.2 g壳聚糖粉置于试剂瓶内,室温下逐步加入9 mL稀盐酸(0.1 mol/L),磁力搅拌器搅拌2 h,直至壳聚糖粉完全溶解,配制成的壳聚糖-盐酸液,经高温高压消毒(120℃,10 min)后作为A液;另取0.56 g β-GP溶解于1 mL双蒸水中,配制成浓度为560 g/L的 β-GP液,超净台内用0.22 μm 除菌滤器过滤消毒作为B液;A、B两种溶液冰浴15 min后,超净台内将B液逐滴加入A液中,搅拌10 min,即获得终浓度为20 g/L的壳聚糖温敏凝胶。
1.2.2 改进消毒法制备壳聚糖温敏凝胶
称取0.2 g壳聚糖粉置于试剂瓶内,先单独进行高温高压消毒(120℃/10 min)后,再加入9 mL盐酸液,磁力搅拌器搅拌2 h直至完全溶解配成A液,然后再按1.2.1相同的方法制备B液和温敏凝胶。
1.3 壳聚糖温敏凝胶凝胶化效果观察
凝胶化效果采用倒置法观察,分别将装有不同消毒方法制备的壳聚糖溶胶的烧杯置于37℃水浴箱内,每1 min倒置观察1次,烧杯倒置30 s之内凝胶无流动为凝胶化成功。
1.4 壳聚糖温敏凝胶粘度检测
取两种消毒方法配制的壳聚糖温敏凝胶各10 mL,分别置于粘度测试仪内(Brookfield HBT),将粘度仪温度设为37℃,转子(1号转子)转速设定为 1.0 r/min,分别于 0、1、3、5、10、15、20、30 min各测试一次粘度。
1.5 超微结构观察
分别取两种消毒方法配制的壳聚糖温敏凝胶,梯度脱水、抽真空、冻干、喷金,扫描电镜下观察。
1.6 壳聚糖温敏凝胶生物相容性实验
1.6.1 人牙周膜细胞体外培养
取18岁以上志愿者因正畸减数拔除的前磨牙,刮取根中1/3处牙周膜,采用酶消化法原代培养牙周膜细胞,3 d换培养液1次常规传代后,取生长良好的第三代细胞用于实验。
1.6.2 牙周膜细胞在两种温敏凝胶表面生长情况观察
取生长良好的第3代人牙周膜细胞,以1×104/cm2接种在两种消毒方法制备的凝胶表面,放入孵箱内,37℃,50 mL/L CO2,饱和湿度条件下培养。每3 d换培养液1次,7 d后分别取出凝胶,用40 g/L多聚甲醛液固定,避光条件下DAPI染色,荧光倒置显微镜观察。
1.6.3 两种温敏凝胶浸提液对牙周膜细胞增殖的影响
分别取两种消毒方法制备的壳聚糖温敏凝胶各5 mL,置于50 mL无菌试剂瓶中,加入45 mL含100 mL/L胎牛血清的α-MEM细胞培养液,37℃下浸提24 h后吸取培养液作为浸提液用于实验。
取生长良好的第三代牙周膜细胞,制成细胞密度为1×104/mL的单细胞悬液,以200 μL/孔接种于96孔板,置37℃ 、50 mL/L CO2的培养箱中孵育,24 h后,弃原培养液,并将细胞随机分为2个实验组和1个空白对照组,每组复5个孔。2个实验组分别加入2种消毒方法制备的凝胶浸提液;空白对照组加入含100 mL/L胎牛血清的α-MEM培养液继续培养。3 d换液1次,分别于培养后的1、2、3、4、5、6、7 d 取出各组细胞,于每孔中加入 20 μL MTT液,继续培养4 h后,小心吸去孔内液体,每孔加入150 μL二甲基亚砜,震荡10 min,用酶标仪测定各孔490 nm处的吸光值(OD)。
1.7 统计学分析
2 结果
2.1 两种消毒方法壳聚糖温敏凝胶温敏特性比较
两种消毒方法制备的壳聚糖温敏凝胶pH均在6.8~7.2,凝胶化前均呈微黄色、透明、可流动溶胶状(图1a),置于37℃水浴箱内,常规消毒组凝胶化时间为10~30 min,改进消毒组凝胶化时间为5~6 min,凝胶化后呈微黄色半透明不可流动胶冻状(图1b),两种壳聚糖温敏凝胶凝胶化后均不会变回可流动溶胶状。
2.2 两种消毒方法壳聚糖温敏凝胶粘度比较
改进消毒法组壳聚糖温敏凝胶初始粘度为(9.94 ±0.38)Pa.s,随着在 37 ℃水浴箱内的时间增长,其粘度逐渐升高,10 min时达到峰值(50.25 ±0.96)Pa.s,此后不再随着时间而有明显变化;常规消毒法组壳聚糖温敏凝胶初始粘度为(0.90 ±0.45)Pa.s,在37 ℃水浴箱内,其粘度随时间延长稍有增加,但变化不明显,15 min时仅为(4.05 ±0.72)Pa.s,此后趋于平稳,两组各时间点粘度差异均有统计学意义(P<0.05)(图2)。
2.3 两种消毒法壳聚糖温敏凝胶超微结构
两种消毒方法制备的壳聚糖温敏凝胶均呈三维立体网状多孔结构,内有大量排列不规则的微孔隙,常规消毒法壳聚糖温敏凝胶孔径为10~48.33 μm(图3a);改进消毒法壳聚糖温敏凝胶孔径为0.385 ~2 μm(图3b)。

图1 壳聚糖温敏凝胶凝胶化前后一般性状
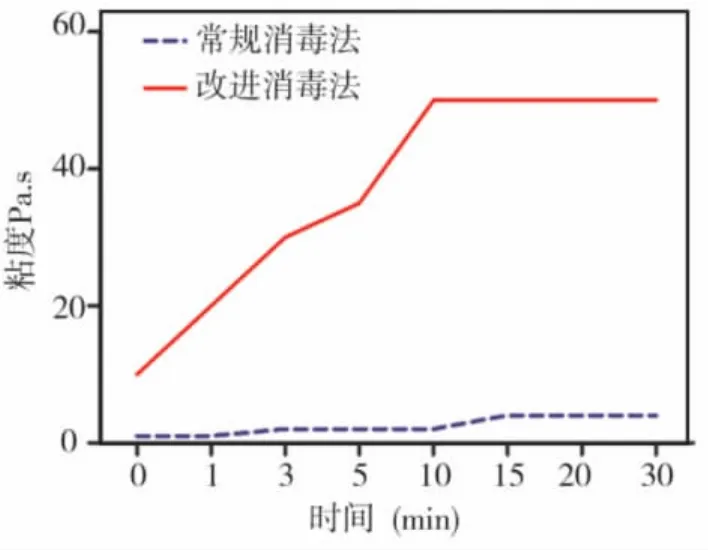
图2 两组壳聚糖温敏凝胶粘度变化曲线

图3 两组壳聚糖温敏凝胶电镜下超微结构(×10000)
2.4 人牙周膜细胞在两种温敏凝胶表面生长情况
在两种消毒法制备的壳聚糖温敏凝胶表面培养7 d的牙周膜细胞,经dapi染色后倒置荧光显微镜下观察,细胞核呈蓝色荧光,胞核大小均一,数量众多(图4),表明生长情况良好,提示两种消毒方法制备的壳聚糖温敏凝胶与牙周膜细胞相容性均良好。

图4 人牙周膜细胞在两组壳聚糖温敏凝胶表面生长情况
2.5 两种温敏凝胶浸提液对人牙周膜细胞增殖的影响
通过MTT检测,两种消毒方法制备的壳聚糖温敏凝胶浸提液组在培养后 1、2、3、4、5、6、7 d 各时间点的增殖情况相近,且均与空白对照组无显著性差异(P >0.05),3组生长曲线均呈“S”形(图5)。

图5 两种温敏凝胶浸提液对人牙周膜细胞增殖的影响
3 讨论
壳聚糖温敏凝胶材料因其具有流动性好,可与生长因子、种子细胞混合,植入时手术创伤小等诸多优点,而成为牙周组织工程领域的一个研究热点[10]。作为温敏型的凝胶材料,其在室温下或者低于室温时可保持流动性,而温度达到体温时则可凝胶化,这种体温固化的自适应性能,是其他支架材料不可比拟的。
壳聚糖温敏凝胶中壳聚糖的浓度多为1.80% ~2.35%,能被 0.1 mol/L 的盐酸液溶解,β-GP液浓度一般为45% ~56%(w/v),壳聚糖温敏凝胶温敏自凝化机制的产生在pH值为6.8~7.2时,一般认为是由于甘油磷酸钠的加入,直接影响了壳聚糖分子链之间的静电力、疏水作用和氢键的结果,甘油磷酸钠的弱碱性和壳聚糖上的胺基相互作用、吸引,使甘油部分暴露,壳聚糖链分解,在室温或者低于室温下,壳聚糖水凝胶保持液态;当温度提高至接近人体体温(37℃)时,由于疏水键和氢键的引力大于链间静电排斥力,壳聚糖分子链间的部分片段发生物理结合,从而出现凝胶化。而pH值较低时由于存在链间静电排斥力,阻碍了氢键形成,使得凝胶化所需的初始温度较高。壳聚糖水凝胶在低温(4℃)时也可以凝胶,只不过凝胶时间很长,最长可达3个月。
目前对壳聚糖温敏凝胶的消毒方法,一般采用将壳聚糖溶解于盐酸液后再高温高压消毒(120 ℃,10 min),β-GP 液用0.22 μm 除菌滤器过滤消毒,然后将再两种溶液混合的方案。Jarry等[11-12]发现壳聚糖盐酸液经高温高压消毒后会导致最终壳聚糖凝胶分子质量损失30%,动态粘度降低3~10倍,力学性能明显降低,虽然添加多元醇可以消除部分高温高压消毒带来的负面影响,添加葡萄糖可以提高凝胶粘度和强度,但程度有限,且不适用于糖尿病病人。本研究发现,采用常规消毒方法制备的壳聚糖温敏凝胶,其凝胶化时间不稳定,甚至有长时间不凝胶化等现象。
壳聚糖的脱乙酰度也是影响壳聚糖温敏凝胶凝胶化的重要因素,关于壳聚糖温敏凝胶文献报道中,壳聚糖脱乙酰度多为 85% ~95%。Chenite[13]、Ruel-Gariepy 等[14]在比较不同脱乙酰度和相对分子量的壳聚糖制备的温敏凝胶流变学特性时发现,脱乙酰度越高则凝胶化温度越低,凝胶化时间缩短,反之则凝胶化所需温度升高,时间延长;而相对分子量对凝胶温度影响不大;此外,脱乙酰度还是影响炎性反应的关键因素,脱乙酰度越低,炎性反应越大,脱乙酰度越高,炎性反应越小。但壳聚糖脱乙酰度为平均值,同批次产品有不同差异,从而导致壳聚糖凝胶化时间不稳定,如果凝胶时间过长,壳聚糖温敏凝胶在体内未凝胶化之前容易被体液或者血液稀释,不易滞留患处,凝胶化后,其力学强度也降低,从而影响支架材料的效果。
本研究对壳聚糖温敏凝胶的消毒方法进行了改进,先单独对壳聚糖粉进行高温高压消毒(120℃,10 min),然后再用盐酸液溶解。用此法制备的壳聚糖温敏凝胶粘度有明显的增加,从初始粘度到终粘度,均较常规消毒法壳聚糖温敏凝胶组有明显提高。这可能由于壳聚糖在高温状况下,链与链之间发生聚合,相对分子质量增大所致。另有文献报道高温高压消毒对壳聚糖的其他理化性质影响不大[15]。改进消毒方法制备的壳聚糖温敏凝胶的凝胶化时间为5~6 min,比传统消毒方法制备的壳聚糖温敏凝胶凝胶化时间(10~30 min)明显缩短,且凝胶时间更加稳定,使材料注入体内后更易驻留,同时还可作为生物粘合剂与其他颗粒状固体材料(如骨移植材料)附合,使植入物更牢固的固定于受植区而不易脱落。
此外扫描电镜观察发现,两种消毒方法制备的壳聚糖温敏凝胶均呈三维立体网状多孔结构,含大量孔隙,但改进消毒方法组壳聚糖温敏凝胶的孔径明显小于常规消毒方法组。
Christiane等[16]报道,人 BMSCs细胞在壳聚糖支架材料表面伸展良好,生长较快。Ashkan等[17]也证实,人成骨细胞和软骨细胞在壳聚糖支架上生长良好。牙周膜细胞是牙周组织的主要功能细胞,在牙周组织再生中起到了重要的作用,是具有多种生物学功能和分化潜能的细胞群,是牙周组织再生修复的重要细胞,本研究分别观察了两种消毒方法制备的壳聚糖温敏凝胶及其浸提液对第三代人牙周膜细胞增殖的影响,结果显示,人牙周膜细胞在两种消毒方法制备的壳聚糖温敏凝胶表面及其浸提液中均生长良好,说明两种消毒方法制备的壳聚糖温敏凝胶均具有良好的生物相容性。采用改进消毒方法制备的壳聚糖温敏凝胶凝胶化时间更短、粘度更大,且与常规消毒方法一样拥有良好的生物相容性。
[1]Rao SB,Sharma CP.Use of chitosan as a biomaterial:studies on its safety and haemostatic potential[J].Biomed Mater Res,1997,34(1):21 -28.
[2]Molinaro G,Leroux JC,Damas J,et al.Biocompatibility of thermosensitive chitosan-based hydrogels:an in vivo experimental approach to injectable biomaterials[J].Biomat,2002,23(7):2717-2722.
[3]Schmitz T,Grabovac V,Palmberger TF,et al.Synthesis andcharacterisation of a chitosan-n-acetyl cysteine conjugate[J].Int J Pharm,2008,347(1):79 -85.
[4]Kim IY,Seo SJ,Moon HS,et al.Chitosan and its derivatives for tissue engineering applications[J].Biotech Adv,2008,26(1):1-21.
[5]Jumaa M,Furkert FH,Muller BW.A new lipid emulsion formulation with high antimicrobial efficacy using chitosan[J].Eur J Pharm Biopharm,2002,53(1):115-123.
[6]Lehr C,Bouwstra J,Schacht E,et al.In vitro evaluation of mucoadhesive properties of chitosan and some other natural polymers[J].Int J Pharm,1992,78(1):43 -48.
[7]马志伟,张勇杰,王荣,等.骨形成蛋白和氯己定双缓释的壳聚糖温敏凝胶用于牙周组织再生的实验研究[J].中华口腔医学杂志,2008,43(5):273 -277.
[8]Bhattarai N,Ramay HR,Gunn J,et al.PEG-grafted chitosan as an injectable thermosensitive hydrogel for sustained protein release[J].Controlled Release,2005,103(4):609 -624.
[9]Cho JH,Kim SH,Park KD,et al.Chondrogenic differentiation of human mesenchymal stem cells using a thermosensitive poly(N-isopropylacrylamide)and watersoluble chitosan copolymer[J].Biomat,2004,25(11):5743 -5751.
[10]吴广升,王勤涛,惠光艳,等.可注射型壳聚糖温敏凝胶物理性能和组织相容性的观察[J].牙体牙髓牙周病学杂志,2010,20(11):614 -617.
[11]Jarry C,Chaput C,Chenite A,et al.Effects of steam sterilization on thermogelling chitosan-based gels[J].J Biomed Mater Res,2001,58(1):127 -135.
[12]Jarry C,Leroux JC,Haeck J,et al.Irradiating or autoclaving chitosan/polyol solutions:effect on thermogelling chitosan-β -glycerophosphate systems[J].Chem Pharm Bull,2002,50(10):1335-1340.
[13]Chenite A,Chaput C,Wang D,et al.Novel injectable neutral solutions of chitosan form biodegrad-able gels in situ[J].Biomat,2000,21(21):2155-2161.
[14]Ruel-gariepy E,Chenite A,Chaput C,et al.Characterization of thermosensitive chitosan gels for the sustained delivery of drugs[J].Int J Pharm,2000,203(1-2):89-98.
[15]Lim LY,Khor E,Ling CE.Effects of dry heat and saturated steam on the physical properties of chitosan[J].Biomed Mater Res,1999,48(2):111 -116.
[16]Christiane H,Sascha H,Anja L,et al.In vitro evaluation of textile chitosan scaffolds for tissue engineering using human bone marrow stromal cells[J].Biomacromolecules,2009,10(5):1305-1310.
[17]Ashkan L,Mshin S,David S,et al.Chitosan supports the expression of extracellular matrix proteins in human osteoblasts and chondrocytes[J].Biomed Mater Res,2000,51(4):586 -595.

