Jun家族蛋白在釉质发育中的表达及对amelogenin的调控作用
徐 畅, 魏亚红, 王玉敏, 张 莉, 韩晓谦, 韩婷婷, 高玉光
(山东 滨州 : 1. 滨州医学院口腔医学院 256603; 2. 潍坊市坊子区人民医院口腔科 261200)
·基础研究·
Jun家族蛋白在釉质发育中的表达及对amelogenin的调控作用
徐 畅1, 魏亚红2, 王玉敏1, 张 莉1, 韩晓谦1, 韩婷婷1, 高玉光1
(山东 滨州 : 1. 滨州医学院口腔医学院 256603; 2. 潍坊市坊子区人民医院口腔科 261200)
目的: 探讨Jun家族蛋白JunB、c- Jun 和JunD在小鼠釉质发育中的作用。方法: 应用免疫组化染色检测JunB、c- Jun 和JunD在不同发育阶段小鼠牙胚成釉细胞中的表达;分别以0.5 μg和2.0 μg的JunB、c- Jun 和JunD转染小鼠成釉细胞后,运用RT- PCR观察其对釉原蛋白amelogenin mRNA表达的影响。结果: 免疫组化染色结果显示:釉质分泌期时,JunB在成釉细胞核中无显著表达,JunD呈弱表达,而c- Jun表达明显; 釉质转型期时,JunB和JunD 表达增强且JunD 早于JunB, c-Jun持续表达明显; 在釉质成熟期时,JunB、c- Jun和JunD均显著表达。RT- PCR检测显示:高剂量JunB可明显抑制amelogenin的表达(P<0.05);低剂量c- Jun可明显促进amelogenin的表达(P<0.05); JunD对amelogenin的表达无显著影响。结论: 在釉质发育早期,c- Jun可通过上调釉原蛋白的表达参与釉质发育。在釉质发育后期,JunB可通过抑制釉原蛋白的分泌促进釉质的成熟。JunD对amelogenin表达无显著影响。
Jun家族蛋白; 釉原蛋白; 免疫组化; RT- PCR
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.09.001
[Chinese Journal of Conservative Dentistry,2015,25(9): 515]
釉质的形成是在成釉细胞合成和分泌的釉质基质上进行的生物矿化过程。釉原蛋白amelogenin是成釉细胞分泌的最主要的特异性釉质蛋白,占釉质发育阶段釉质蛋白的90%,其主要作用是调节釉质晶体的生长和排列方向。釉原蛋白基因定位于性染色体,人类amelogenin基因突变可导致连锁性釉质发育不全[1]。Jun家族蛋白成员JunB、c- Jun和JunD是构成转录激活蛋白AP- 1(activator protein- 1)的重要亚基,广泛参与细胞增殖、分化、凋亡及肿瘤形成等过程[2]。有文献报道,Jun蛋白[3]和釉原蛋白在成釉细胞中均有表达。本研究旨在观察Jun家族成员在釉质发育过程中的时空表达,并探讨其对amelogenin基因的转录调控作用,以期为进一步研究Jun家族在釉质发育中的信号转导通路奠定基础。
1 材料和方法
1.1 主要材料和试剂
小鼠成釉细胞系(ALC,日本秋田大学Sugiyama教授馈赠);DMEM培养基(Hyclone,美国);胰蛋白酶(Gibco,美国);胎牛血清(杭州四季青);RNAiso Plus、RT- PCR试剂盒 (TaKaRa,日本);TrannsFastTMTransfection Reagent (Promega,美国);真核表达载体pcDNA3.1/myc- HisA-JunB、pcDNA3.1/myc- HisA- c- Jun、pcDNA3.1/myc- HisA-JunD(本实验室保存);兔抗鼠JunB、c- Jun和JunD抗体(Santa Cruz,美国);ABC试剂盒(vector,美国);DAB试剂盒(北京中杉金桥)。
1.2 免疫组化检测成釉细胞中JunB、c- Jun和JunD的表达
分别取出生后5、10、15 d小鼠含磨牙牙胚的下颌骨,分别经100 mL/L中性甲醛液固定、 100 g/L EDTA溶液低温脱矿后,常规石蜡包埋,并制作4 μm连续切片。取上述组织切片,参照文献[4]的方法进行免疫组化染色:10 mmol/L枸橼酸钠溶液(pH 6.0)85~90 ℃处理切片30 min;50 mL/L H2O2/甲醇处理15 min以灭活内源性过氧化物酶;正常山羊血清室温封闭20 min;分别滴加JunB(1 ∶200)、c- Jun(1 ∶300)和JunD(1 ∶500)多克隆抗体,4 ℃孵育过夜;采用VECTASTAIN® ABC KIT 检测后,DAB显色、脱水、透明、封片,显微镜下观察并拍照。以 PBS 代替一抗作为阴性对照,以细胞深染成颗粒状棕黄色为阳性表达。
1.3 RT- PCR检测不同剂量JunB、c- Jun和JunD调控下amelogenin mRNA的表达水平
小鼠成釉细胞常规复苏后,以2×106/mL的密度接种于6孔板,并加入含100 mL/L FBS的DMEM培养基置于37 ℃、50 mL/L CO2、饱和湿度条件下进行培养。待细胞融合达70%~80%时将细胞随机分为3组(每组复3孔):1组为2 μg pcDNA3.1/myc-HisA、2组为0.5 μg pcDNA3.1/myc- HisA- JunB/c- Jun/JunD+1.5 μg pcDNA3.1/myc- HisA、3组为2 μg pcDNA3.1/myc- HisA- JunB/c- Jun/JunD;然后按照TransFastTMTransfection Reagent 说明书对各组成釉细胞进行瞬时转染。转染完成后分别提取各组细胞的总RNA,并逆转录合成cDNA,然后以cDNA为模板、GAPDH为内参照,进行实时定量PCR。PCR反应条件为95 ℃ 4 min,94 ℃ 20 s, 59 ℃ 30 s,72 ℃ 30 s 采集荧光,40个循环后72 ℃ 延伸5 min。Ct值由荧光PCR仪在扩增过程中自动读出,对各组所得Ct值进行2-△△CT分析,并计算出各组amelogenin基因的mRNA表达水平。所用PCR引物见表1。

表1 PCR引物及其扩增的目的片段长度
1.4 统计学分析
采用 SPSS 13.0 统计软件,对实时定量RT-PCR结果用配对t检验进行比较分析,检验水准α=0.05。
2 结果
2.1 JunB在成釉细胞中的表达及不同剂量JunB对amelogenin mRNA表达的调控
不同发育阶段小鼠的磨牙牙胚经JunB抗体免疫组化染色显示,JunB釉质分泌期的成釉细胞核中无显著表达(图1a),随着釉质发育的成熟其表达逐渐增强(图1b),釉质成熟期呈显著表达(图1c)。Real- Time PCR结果显示,成釉细胞中转染0.5 μg的 pcDNA3.1/myc- HisA- JunB时,对amelogenin基因的表达未见显著影响,与对照组相比无统计学差异(P>0.05);当JunB的转染增加至2 μg时,成釉细胞中的amelogenin mRNA表达水平明显下降,与对照组相比差异有统计学意义(P<0.05),表明高剂量JunB可抑制成釉细胞中amelogenin mRNA的表达(图2)。

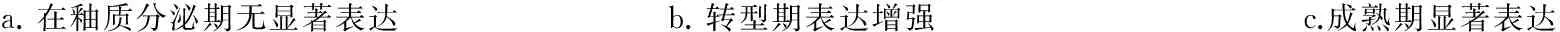
a.在釉质分泌期无显著表达b.转型期表达增强 c.成熟期显著表达
s-am:分泌期成釉细胞; t-am:转型期成釉细胞; m-am:成熟期成釉细胞; od:成牙本质细胞; e:釉质; es:釉质间隙
图1 JunB在小鼠磨牙牙胚成釉细胞中的表达(IHC,×100)
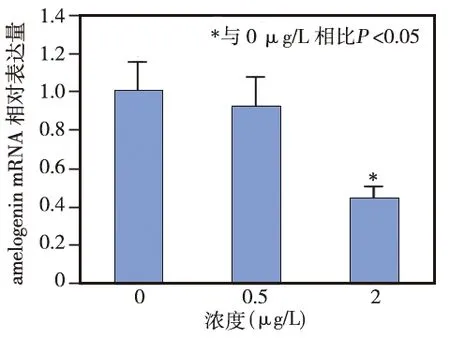
图2 JunB对amelogenin mRNA表达水平的影响
2.2 c- Jun在成釉细胞中的表达及不同剂量c- Jun对amelogenin mRNA表达的调控
免疫组化染色显示,c- Jun在小鼠釉质发育过程中的表达较早,其在釉质分泌期的成釉细胞核中即明显表达(图3a),并持续到转型期(图3b)和釉质成熟期(图3c)。RT- PCR结果显示,当成釉细胞核中转染低剂量(0.5 μg)的c- Jun时,可明显促进amelogenin mRNA的表达(P<0.05);而当c- Jun的转染剂量增加至2 μg时,对amebgenin mRNA表达的促进作用不明显,与对照组相比无统计学差异(P>0.05) (图4)。
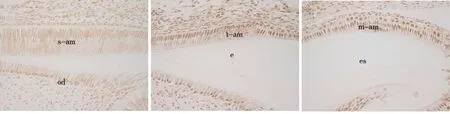
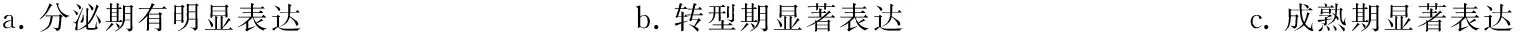
a.分泌期有明显表达 b.转型期显著表达 c.成熟期显著表达
s-am:分泌期成釉细胞;t-am:转型期成釉细胞;m-am:成熟期成釉细胞;od:成牙本质细胞;e:釉质;es:釉质间隙
图3 c-Jun 在小鼠磨牙牙胚成釉细胞中的表达(IHC,×100)
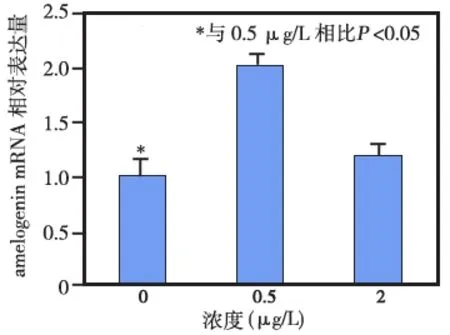
图4 c-Jun对amelogenin mRNA 表达水平的影响
2.3 JunD在成釉细胞中的表达及不同剂量JunD对amelogenin mRNA表达的调控
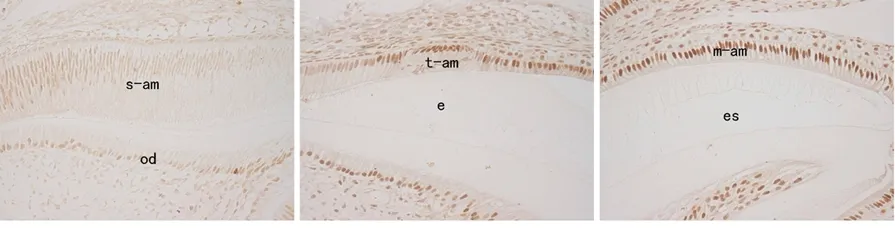
免疫组化染色显示,JunD在分泌期成釉细胞核中呈弱阳性表达 (图5a),到转型期时JunD的表达明显增强(图5b),而在釉质发育成熟期则持续呈强阳性表达(图5c)。RT- PCR结果显示,成釉细胞中转染0.5、2 μg不同剂量的JunD时,对成釉细胞中amelogenin mRNA表达均无显著影响(P>0.05)(图6)。
a.在釉质分泌期呈弱表达b.转型期表达增强 c.成熟期显著表达
s-am:分泌期成釉细胞;t-am:转型期成釉细胞;m-am:成熟期成釉细胞;od:成牙本质细胞;e:釉质;es:釉质间隙
图5 JunD在小鼠磨牙牙胚成釉细胞中的表达(IHC,×100)

图6 JunD对amelogenin mRAN表达水平的影响
3 讨论
釉质发育分为分泌期、转型期和成熟期3个连续过程[5]。本实验中JunB在成釉细胞中的表达特征提示,JunB的主要作用是通过抑制釉质蛋白的分泌而促进釉质发育的成熟;免疫组化结果表明c-Jun在釉质分泌期显著表达,而RT-PCR检测提示低剂量c-Jun促进釉质基质蛋白amelogenin的表达。这一研究结果提示c-Jun在釉质分泌期通过上调釉质蛋白的分泌而促进釉质发育。JunD在成釉细胞中的表达特征(在釉质发育不同阶段均有表达,且随釉质发育成熟表达逐渐增强)提示,JunD参与了釉质发育的过程,但RT- PCR结果显示JunD对amelogenin的表达无显著影响,说明JunD在釉质发育中的作用与釉质蛋白的表达无显著关联。Jun家族蛋白成员JunB、c- Jun和JunD之间可通过形成同源二聚体或与Fos蛋白形成异源二聚体构成AP- 1,然后与DNA的特异性序列相结合,并在转录水平上对靶基因的表达进行调控,从而参与细胞的增殖、分化、凋亡等[6]。有研究表明,AP- 1可通过作用于Mmp20启动子的AP- 1结合位点而调节基因的表达[7]。amelogenin作为釉质基质蛋白的主要成分,在釉质分泌期表达逐渐增强,转型期表达显著下降[8]。有研究显示,人类amelogenin基因突变可导致连锁性釉质发育不全[1]。鉴于amelogenin基因的启动子区含有AP- 1位点,本实验通过RT- PCR观察了不同剂量JunB、c- Jun和JunD对amelogenin基因表达的调控作用。RT- PCR结果显示,JunB、 c- Jun以及JunD在釉质发育中的作用显著不同;免疫组化染色结果显示, JunB、 c- Jun以及JunD在釉质发育中的时空表达亦不同。因此我们认为,JunB、c- Jun和JunD在釉质发育各个阶段的作用不同,可能是3者通过不同的分子作用机制参与了釉质的发育过程。
总之,Jun家族蛋白成员具有不同的时空表达顺序,提示3者在釉质形成中发挥着不同的作用,共同参与了釉质发育过程。但由于蛋白结构的复杂性、调控机制的多样性,这些基因是如何受控开放和关闭的,尚有待进一步探索。
[1]Oliveira FV, Gurgel CV, Kobayashi TY,etal. Amelogenesis imperfecta and screening of mutation in amelogenin gene [J].CaseRepDent, 2014,2014:319680.
[2]Jochum W, Passegue E,Wagner EF. AP- 1 in mouse development and tumorigenesis [J].Oncogene, 2001, 20(19): 2401-2412.
[3]Nishikawa S. Localization of transcription factor AP- 1 family proteins in ameloblast nuclei of the rat incisor [J].JHistochemCytochem, 2000, 48(11): 1511-1520.
[4]Gao Y, Ganss BW, Wang H,etal. The RING finger protein RNF11 is expressed in bone cells during osteogenesis and is regulated by Ets1 [J].ExpCellRes, 2005, 304(1): 127-135.[5]Bartlett JD. Dental enamel development: proteinases and their enamel matrix substrates [J].ISRNDent, 2013,16;2013:684607.
[6]Hess J, Angel P,Schorpp- Kistner M. AP- 1 subunits: quarrel and harmony among siblings [J].JCellSci, 2004, 117(25): 5965-5973.
[7]曲政, 王玉敏, 李博涵, 等. EGF/EGFR/ErbB2调控成釉细胞MMP- 20基因表达的研究 [J]. 牙体牙髓牙周病学杂志, 2013, 23(7): 417-423.
[8]魏亚红, 孙岩, 张娟娟, 等. 釉成熟蛋白和釉原蛋白基因在小鼠牙胚发育过程中的时空表达研究 [J]. 牙体牙髓牙周病学杂志, 2009, 19(9): 497-502.
The expression of Jun family proteins in enamel development and the effect on amelogenin
XU Chang*, Wei Ya- hong, WANG Yu- min, ZHANG Li, HAN Xiao- qian, HAN Ting- ting, GAO Yu- guang
(*SchoolofStomatology,BinzhouMedicalUniversity,Binzhou256603,China)
AIM: To investigate the role of Jun family proteins in enamel development of mouse. METHODS: Immunohistochemical staining was applied to detect the expression of JunB, c- Jun and JunD in mouse tooth germ ameloblasts. RT- PCR was employed to evaluate the effect on the mRNA expression of amelogenin after transfection of the ameloblasts by JunB, C-Jun and JunD at 0.5 μg and 2.0 μg respectively. RESULTS: At the secretion stage, JunB was not expressed and JunD was weakly expressed in ameloblasts nuclei, but c- Jun was obviously expressed. At the transition stage, JunB and JunD expression were increased and JunD was earlier than JunB. c- Jun continuously exhibited strong expression. At the maturation stage, all of the proteins were strongly expressed. Transfection results showed that high dose of JunB inhibited the expression of amelogenin. Low dose of c-Jun evidently enhanced the expression of amelogenin JunD had no significant effect on amelogenin expression. CONCLUTION: c- Jun may up- regulate the expression of amelogenin at the early stage of enamel development. JunB may suppress the secretion of amelogenin and promote the maturation of enamel at the late stage of enamel development. JunD has no significant effect on amelogenin.
Jun family proteins; amelogenin; immunohistochemistry ; RT- PCR
2015-01-23
国家自然科学基金资助项目(81170927)
徐 畅(1992-), 女,汉族,山东东营人。本科生(导师:高玉光)
高玉光, E-mail : gaoyuguang@yahoo.com
R780.2
A
1005-2593(2015)09-0515-05

