淫羊藿苷对人牙髓干细胞增殖及骨向分化的作用
麻丹丹, 吴补领
(广东 广州 510515: 1. 南方医科大学口腔医学院; 2. 南方医科大学南方医院口腔科)
淫羊藿苷对人牙髓干细胞增殖及骨向分化的作用
麻丹丹1,2, 吴补领1,2
(广东 广州 510515: 1. 南方医科大学口腔医学院; 2. 南方医科大学南方医院口腔科)
目的: 探讨淫羊藿苷对人牙髓干细胞(hDPSCs)增殖及骨向分化的影响。方法:MTT检测10-2~10-10mol/L淫羊藿苷对hDPSCs增殖能力的影响,并筛选出最佳浓度(10-5mol/L);然后以10-5mol/L的淫羊藿苷作用于hDPSCs,并对其进行矿化诱导。诱导培养21 d后,用Real- time PCR检测hDPSCs中ALP、DMP- 1、DSPP各矿化相关基因的表达水平;茜素红染色观察hDPSCs矿化结节的能力。结果:与对照组相比,10-2~10-3mol/L 的淫羊藿苷对hDPSCs增殖有一定的抑制作用(P<0.05),而10-5mol/L和10-6mol/L的淫羊藿苷均能明显促进hDPSCs的增殖(P<0.05),其中以10-5mol/L最好;Real- time PCR检测及茜素红染色观察结果显示,10-5mol/L淫羊藿苷可明显促进hDPSCs中各矿化相关基因的表达和矿化结节的形成。结论: 一定浓度范围的淫羊藿苷可促进hDPSCs的增殖和骨向分化。
淫羊藿苷; 牙髓干细胞; 增殖; 骨向分化
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.09.003
[Chinese Journal of Conservative Dentistry,2015,25(9):524]
干细胞矿化是形成组织工程牙齿的重要环节,近年来随着组织工程学的发展,参与牙齿矿化的干细胞已逐一被发现并认识,牙髓干细胞就是形成牙髓牙本质复合体的重要种子细胞。Gronthos等(2000)首次利用酶消化法成功分离、培养出了牙髓干细胞(human dental pulp stem cells,hDPSCs),并发现DPSCs较骨髓基质干细胞具有更高的克隆形成能力和增殖率,在体外诱导条件下,其不仅能形成分散而高密度的钙化结节,同时还能分化为成牙本质细胞样细胞;将集落生长的DPSCs移植到免疫耐受小鼠体内,能形成典型的牙本质/牙髓复合体样结构[1]。目前的研究已证实,DPSCs可向骨组织、软骨组织、神经组织、脂肪组织、黑素细胞、角膜组织等方向分化[2-7]。在组织工程牙齿形成过程中,种子细胞、生物支架材料、生长因子是3个至关重要的因素。因此,在体外条件下要想使牙髓干细胞分化为牙本质细胞并形成牙本质乃至牙本质/牙髓复合体,则需要有与体内相似的生长因子微环境和三维生物学功能支架材料。特别是寻找有效的生长因子微环境以促进hDPSCs增殖和分化尤为重要,并已成为研究的热点。
淫羊藿苷是从淫羊藿的皂苷类物质中提取的单体,也是淫羊藿的主要和有效的药理成分,并可在临床上用于治疗骨质疏松。体外研究发现,淫羊藿苷可以促进成骨细胞的骨向分化[8],但其对牙髓干细胞的骨向分化是否也有促进作用,目前尚未见相关研究报道。本研究旨在探讨淫羊藿苷对hDPSCs的增殖及骨向分化是否存在促进作用,以期为牙髓组织修复及牙组织再生工程研究中寻找新的生长因子提供新的思路。
1 材料和方法
1.1 主要仪器和试剂
淫羊藿苷(北京中国药品生物制品检定所);低糖DMEM培养基、胎牛血清(Hyclone,美国);青/链霉素、胰蛋白酶(Gibco,美国);I型胶原酶、dispase、MTT粉末(Sigma, 美国);Trizol、Prime-Script RT reagent Kit、SYBR Premix DimerEraser kit (Takara, 美国);超净工作台(Esco Airstream,新加坡);酶联免疫检测仪(Tecan,瑞典);CO2培养箱、离心机(Beckman Coulter,美国);Stratagene MX3000P实时荧光定量PCR反应仪(Agilent,美国)。
1.2 hDPSCs的分离、培养和纯化
于我院颌面外科门诊选取18~25岁志愿者(知情同意)因正畸治疗或阻生拔除的完整、健康第三磨牙,超净工作台内劈开牙齿,无菌条件下取出牙髓并剪去其根尖端2 mm后,置于PBS缓冲液中反复漂洗至少3次。用眼科剪将牙髓组织剪成1 mm×1 mm×1 mm大小的组织块后,参照文献[9]报道的改良组织块酶消化法分离培养hDPSCs:首先将牙髓组织块置于4 g/L胶原酶消化液中,37 ℃消化10 min使组织松散后,800 r/min离心10 min,弃上清;加入少量DMEM培养液,轻轻吹打使细胞悬液与松散组织混匀后,将其转移至6孔板内铺平,并用盖玻片压于组织之上;然后补充DMEM培养液体至适量,并置于37 ℃ CO2培养箱中进行培养。每隔3 d换液1次,待细胞生长汇合至80%时进行传代培养。最后采用有限稀释法纯化hDPSCs,并将改良组织块酶消化法分离培养的hDPSCs以1~2/孔的密度接种96孔板,常规培养7~14 d, 至出现细胞克隆后进行扩大培养。
1.3 淫羊藿苷促进hDPSCs增殖的最佳浓度筛选
取第3代hDPSCs以4×103/孔的密度接种于96孔板,常规条件(37 ℃、50 mL/L CO2)下培养至细胞贴壁后,弃原培养液,并将细胞随机分为10组(1个对照组和9个实验组),每组复4孔。其中对照组加入不含淫羊藿苷的DMEM培养液;9个实验组分别加入含淫羊藿苷终浓度为10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10mol/L的DMEM继续培养。培养24 h后分别于每孔中各加入20 μL MTT(5 mg/mL),37 ℃培养箱中孵育4 h;然后弃去孔内上清,并于每孔中各加入200 μL DMSO,摇床振荡10 min至结晶充分溶解后,用酶联免疫检测仪测量各孔490 nm 波长的吸光值(OD)。实验至少重复3次。
1.4 10-5mol/L的淫羊藿苷对hDPSCs增殖能力影响的观察
取第3代人hDPSCs,以4×104/孔的密度接种于96孔板中,常规条件下培养至细胞贴壁后,弃原培养液,并将细胞随机分为2组(对照组和实验组)。其中对照组加入不含淫羊藿苷的DMEM培养液;实验组根据1.3的实验结果加入含淫羊藿苷终浓度为10-5mol/L的DMEM继续培养。分别于培养后1、2、3、4、5、6、7 d各时间点取各组细胞(每组每个时间点各4孔),并于每孔中各加入20 μL MTT(5 mg/mL)继续孵育4 h;然后弃去孔内上清,并于每孔中各加入200 μL DMSO,摇床振荡10 min至结晶充分溶解后,用酶联免疫检测仪测量490 nm波长处的吸光值(OD)。实验至少重复3次。
1.5 10-5mol/L淫羊藿苷对hDPSCs骨向分化能力影响的观察
1.5.1 分组处理和矿化诱导
取第3代对数生长期hDPSCs接种于35 mm的细胞培养皿,并将其随机分为2组(实验组和对照组)。其中实验组加入含淫羊藿苷终浓度为10-5mol/L的DMEM培养基;对照组加入正常DMEM培养基,一并置于37 ℃、50 mL/L CO2培养箱中进行培养;待细胞生长密度达70%左右时,分别换用矿化诱导液(含10 mmol/L β-甘油磷酸钠、5 mg/mL维生素C磷酸酯、10-5mol/L地塞米松)的DMEM进行诱导培养。每隔3 d换液1次,连续诱导培养21 d。
1.5.2 Realtime-PCR检测矿化相关基因的表达
取上述矿化诱导21 d的各组hDPSCs,分别经Trizol裂解后提取细胞总RNA,并运用Prime-Script RT reagent Kit将RNA逆转录为cDNA。然后以cDNA为模板,GAPDH为内参照,用Stratagene MX3000P实时荧光定量PCR反应仪分别检测各组ALP、DMP-1、DSPP各矿化相关基因的表达。PCR反应体系及参数均严格按照产品说明书,所用引物由上海生工生物公司合成,具体引物序列见表1。

表1 PCR引物序列
1.5.3 茜素红染色观察矿化结节形成情况
取上述矿化诱导21 d的各组hDPSCs,用40 g/L多聚甲醛室温下固定10 min,并经PBS冲洗2遍后,用20 g/L 茜素红染色10 min;PBS冲洗5次,倒置显微镜下观察矿化结节形成情况并拍照。
1.6 统计学分析
2 结果
2.1 淫羊藿苷促hDPSCs增殖的最佳浓度筛选结果
MTT法分别检测10-2~10-10mol/L 9个浓度的淫羊藿苷对hDPSCs增殖能力的影响,结果显示:10-2、10-3mol/L两个浓度组的OD值均明显低于对照组(P<0.05),说明这两个浓度的淫羊藿苷对hDPSCs的增殖能力均有一定抑制作用;10-5、10-6mol/L两个浓度组的OD值均明显高于对照组(P<0.05),说明这两个浓度的淫羊藿苷对hDPSCs的增殖能力均有一定促进作用,其中以10-5mol/L组最好,故以该浓度的淫羊藿苷用于后续实验;而其余各浓度组的OD值与对照组相比,差异均无统计学意义(P>0.05)(图1)。
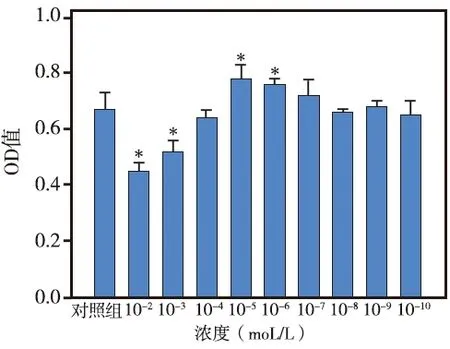
*与对照组相比P<0.05
2.2 10-5mol/L淫羊藿苷对hDPSCs增殖能力的影响
以10-5mol/L的淫羊藿苷分别作用于hDPSCs 1~7 d,MTT检测结果显示:淫羊藿苷作用组(实验组)和对照组的OD值均随着培养时间延长而逐渐升高,其中以实验组升高最明显,从第3天开始其各时间点的OD值均明显高于对照组(P<0.05),说明10-5mol/L浓度的淫羊藿苷在7 d观察期内对hDPSCs增殖具有促进作用(图2)。
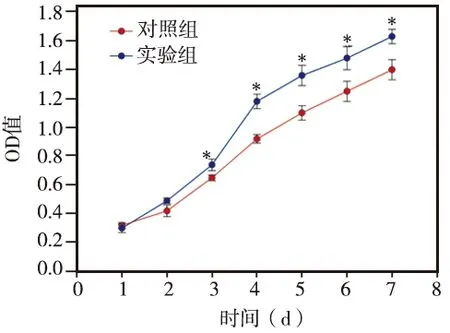
图2 10-5 mol/L淫羊藿苷对hDPSCs增殖
2.3 10-5mol/L淫羊藿苷对hDPSCs骨向分化能力的影响
10-5mol/L淫羊藿苷作用组(实验组)和对照组hDPSCs经矿化诱导21 d后,Real- time PCR显示,实验组hDPSCs中各矿化相关基因(ALP、DSPP、DMP- 1)的表达水平均明显高于对照组(P<0.05)(图3)。茜素红染色结果显示,实验组hDPSCs所形成的矿化结节较对照组更大、更致密(图4)。以上结果说明,10-5mol/L的淫羊藿苷对hDPSCs的骨向分化具有促进作用。
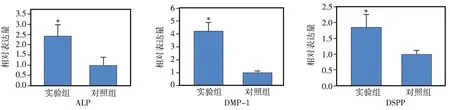
图3 10-5 mol/L淫羊藿苷对hDPSCs中矿化相关基因(ALP、DMP- 1、DSPP)表达的影响(*P<0.05)
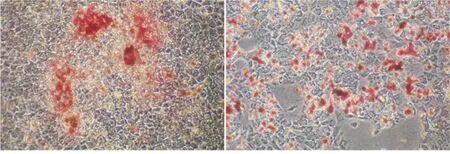
实验组 对照组
图4 10-5mol/L淫羊藿苷对hDPSCs形成矿化结节的影响(×4)
3 讨论
人体中的硬组织,如牙齿、骨骼,都是生物矿化过程的产物。在体内生理条件下,通过细胞的参与、调节,以及各种生物活性因子的有序作用,即可生成具有特殊形态和功能的硬组织(矿化组织)。而在体外利用物理或化学的方法,只能合成类似的矿化物,且需要相当苛刻的条件。因此,在生理条件下的矿化过程中,细胞和各种生物活性因子的调控起着决定性作用。但如何在体外条件下重现细胞及各种生物活性因子的调控作用,一直是生物矿化研究领域密切关注并亟待解决的问题。自Gronthos等[1](2000)发现牙髓干细胞以来,学者对其展开了深入研究,并以牙髓干细胞为模型寻找促进矿化的方法,探讨矿化机制。细胞因子是牙组织工程的重要组成部分,寻求有效廉价的细胞生长因子对实现牙组织再生尤为关键。
本实验结果显示,一定浓度范围的淫羊藿苷对hDPSCs的增殖具有促进作用,与文献报道的淫羊藿苷对其他细胞的增殖有促进作用相符合。Pei等发现,淫羊藿苷对人牙周膜细胞的增殖作用存在浓度依赖性和时间依赖性[10]。Cao等发现,淫羊藿苷可明显增加MC3T3- E1细胞的S期比例,并使其 G1期的比例降低,提示淫羊藿苷可以促进该细胞的增殖[11]。Fan等发现,淫羊藿苷在10-9~10-6mol/L浓度范围内可以促进BMMSCs的增殖,当其浓度超过10-5mol/L时则会对细胞产生毒性作用[12]。本实验结果显示,淫羊藿苷的浓度为10-5mol/L 和10-6mol/L 时,对hDPSCs的增殖均有促进作用,其中10-5mol/L尤为明显,说明不同细胞对淫羊藿苷的耐受性有差异。
ALP是参与骨、牙齿等硬组织形成、代谢和再生的一种重要物质,其在硬组织形成过程中促进钙化的作用较为肯定;一般认为,ALP主要是通过提供磷酸根和去除钙化抑制物而促进钙化进行的。有研究发现,ALP在牙髓干细胞向成牙本质细胞分化过程中会明显升高,诱导后的牙髓细胞中ALP的表达量与成骨细胞相当,且明显高于非矿化组织;提示, ALP可以作为监测hDPSCs成牙本质向分化的一个标志[13]。DSPP和DMP- 1目前被认为是hDPSCs成牙本质向分化时的相对特异性标志物,其不仅参与调控牙本质的发育,同时还能诱导牙本质中矿物晶体成核,并调控晶体生长的形态、速度和尺寸。本结果显示,10-5mol/L的淫羊藿苷可上调hDPSCs中矿化相关基因(ALP、DSPP、DMP- 1)的表达,说明一定浓度的淫羊藿苷可明显促进牙髓干细胞的成牙本质向分化。Wu等发现,淫羊藿苷可以明显提高骨髓间充质干细胞(BMMSCs)的骨向分化能力,淫羊藿苷作用后的BMMSCs中碱性磷酸酶活性,以及I型胶原、骨钙素、骨桥素等矿化相关基因的表达水平均升高;同时还发现,淫羊藿苷是通过影响ERK、p38和JNK MAPK等分子通路而影响BMMSCs矿化能力的[14]。Luo等发现,淫羊藿苷可以恢复切除卵巢大鼠的BMMSCs的矿化能力,并能提高雌激素相关通路因子如雌激素受体α、孕酮受体trefoil 因子等的表达[15]。该结果提示,淫羊藿苷可能通过调控雌激素通路而恢复切除卵巢大鼠的BMMSCs的矿化能力。Sun等从类固醇相关性股骨头坏死病人的骨头中分离出BMMSCs,经研究发现,该BMMSCs的增殖、骨向分化能力均明显减低,而氧自由基水平及脂肪向分化能力均增加;经淫羊藿苷作用后,不仅可提高该BMMSCs的骨向分化能力,同时还能有效减低其氧自由基的水平[16]。Pei等报道,淫羊藿苷可以提高人牙周膜细胞中骨桥素、核心结合因子α1及骨钙素的表达水平;下调细胞核因子κB受体活化因子配基的含量[10]。本实验通过茜素红染色观察发现,10-5mol/L的淫羊藿苷可促进牙髓干细胞形成矿化结节,进一步证实了淫羊藿苷对牙髓干细胞成骨向分化的促进作用。
综上所述,本研究发现了淫羊藿苷在10-2~10-3mol/L浓度范围内对hDPSCs的增殖能力有一定的抑制作用,而当浓度为10-5~10-6mol/L时则对牙髓干细胞的增殖能力具有一定的促进作用,并能促进牙髓干细胞表达成骨相关基因(ALP、DMP-1、DSPP)及形成矿化结节的能力,但具体分子机制仍需进一步探讨。
[1]Gronthos S, Mankani M, Brahim J,etal. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo[J].PNASUSA, 2000,97(25):13625-13630.
[2]Paino F,Ricci G,De Rosa A,etal. Ecto-mesenchymal stem cells from dental pulp are committed to differentiate into active melanocytes[J].EurCellMater, 2010,20: 295-305.
[3]Gomes JA,Geraldes Monteiro B, Melo GB,etal. Corneal reconstruction with tissue- engineered cell sheets composed of human immature dental pulp stem cells[J].InvestOphthalmolVisSci, 2010,51(3): 1408-1414.
[4]Arthur A, Rychkov G, Shi S,etal.Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues[J].StemCells, 2008,26(7):1787-1795.
[5]Yang X, Zhang W, van den Dolder J,etal.Multilineage potential of STRO- 1+ rat dental pulp cells in vitro [J].JTissueEngRegenMed, 2007,1(2):128-135.
[6]Cordeiro MM, Dong Z, Kaneko T,etal.Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth[J].JEndod, 2008,34(8):962-969.
[7]Sakai VT, Zhang Z, Dong Z,etal.SHED differentiate into functional odontoblasts and endothelium[J].JDentRes,2010,89(8):791-796
[8]Zhao J, Ohba S, Shinkai M,etal.Icariin induces osteogenic differentiation in vitro in a BMP- and Runx2-dependent manner [J].BiochemBiophysResCommun, 2008,369(2):444-448.
[9]麻丹丹,高杰,吴补领. 改良组织块酶消化法培养人龋损牙髓干细胞的实验研究[J]. 牙体牙髓牙周病学杂志, 2011,21(7):371-374.
[10]Pei Z, Zhang F, Niu Z,etal.Effect of icariin on cell proliferation and the expression of bone resorption/formation-related markers in human periodontal ligament cells [J].MolMedRep, 2013, 8(5):1499-1504.
[11]Cao H, Ke Y, Zhang Y,etal.Icariin stimulates MC3T3- E1 cell proliferation and differentiation through up-regulation of bone morphogenetic protein-2 [J].IntJMolMed, 2012, 29(3):435-439.
[12]Fan JJ, Cao LG, Wu T,etal.The dose- effect of icariin on the proliferation and osteogenic differentiation of human bone mesenchymal stem cells[J].Molecules, 2011,16(12):10123-10133.
[13]Goseki M, Oida S, Nifuji A,etal. Properties of alkaline phosphatase of the human dental pulp[J].JDentRes, 1990,69 (3): 909-912.
[14]Wu Y, Xia L, Zhou Y,etal.Icariin induces osteogenic differentiation of bonemesenchymal stem cells in a MAPK- dependent manner [J].CellProlif, 2015,48(3):375-384.
[15]Luo Z, Liu M, Sun L,etal. Icariin recovers the osteogenic differentiation and bone formation of bone marrow stromal cells from a rat model of estrogen deficiency-induced osteoporosis[J].MolMedRep, 2015,12(1):382-388.
[16]Sun ZB, Wang JW, Xiao H,etal. Icariin may benefit the mesenchymal stem cells of patients with steroid-associated osteonecrosis by ABCB1- promoter demethylation: a preliminary study [J].OsteoporosInt. 2015,26(1):187-197.
The effect of icariin on the proliferation and osteogenic differentiation of human dental pulp stem cells
MA Dan- dan*, WU Bu- ling
(*SchoolofStomatology,SouthernMedicalUniversity,Guangzhou510515,China)
AIM: To explore the potential role of icariin in the regulation of proliferation and osteogenic differentiation of human dental pulp stem cells (hDPSCs). METHODS: hDPSCs were treated by icariin at 10-2mol/L~10-10mol/L respectively. MTT assay was employed to evaluate the proliferative effect of icariin on hDPSCs. Real time-PCR and Alizarin Red S were performed to examine the impact of icariin on osteogenic differentiation of hDPSCs. RESULTS: 10-2mol/L~10-3mol/L icariin inhibited the proliferation of hDPSCs. 10-5mol/L icariin promoted the proliferation of hDPSCs. In addition, 10-5mol/L icariin could up-regulate osteogenic differentiation related genes and could promote mineralized nodule formation. CONCLUSION: Icariin can enhance proliferation and osteogenic differentiation of hDPSCs at a certain concentration range.
icariin; dental pulp stem cells; proliferation; osteogenic differentiation
2015-05-19
国家自然科学基金青年项目(81400495)
麻丹丹(1982-),女,汉族,黑龙江人。博士,医师
吴补领,E-mail: bulingwu@aliyun.com.cn
R780.2
A
1005-2593(2015)09-0524-05

