溴乙锭对出芽短梗霉的诱变作用
胡洪森,叶 斌
(武汉生物工程学院生物技术系,湖北 武汉 430415)
溴乙锭对出芽短梗霉的诱变作用
胡洪森,叶 斌
(武汉生物工程学院生物技术系,湖北 武汉 430415)
采用溴乙锭对出芽短梗霉进行诱变,得到一株不产色素的变异菌种BM2-5,液体发酵细胞全部呈酵母态,在以大米酶解葡萄糖为碳源的液体培养基中于27℃、200 r·min-1摇瓶培养72 h得到白色的普鲁兰粗多糖,最高产量达68.06 g·L-1。
出芽短梗霉;诱变;溴乙锭;普鲁兰
普鲁兰(Pullulan)是由α-1,4糖苷键形成的麦芽三糖和极少量麦芽四糖以α-1,6糖苷键连接而成的直链多糖,在出芽短梗霉(Aureobasidium pullulans)的培养物中被发现并分离提纯出来[1]。普鲁兰为白色非结晶粉末,易溶于水,安全无毒,低热值,具有可塑性好、成膜性好、膜隔气性好等特性,在医药、食品、化妆品、生物医学等领域有广泛的应用前景[1,2]。对普鲁兰进行化学修饰,根据不同需要制备普鲁兰衍生物,可进一步拓展普鲁兰的应用范围[3]。
出芽短梗霉在产生普鲁兰多糖的同时也产生色素,使多糖提纯困难。目前,已有分离[4]、诱变[5,6]低产色素或不产色素菌株以及菌株发酵条件[7~9]的报道,但尚未见工业化应用。溴乙锭诱导酵母细胞产生限制线粒体呼吸作用的变异菌株[10],增加酵母态细胞数量[11],能有效提高普鲁兰多糖的合成效率,溴乙锭在诱变处理中对细胞无致死作用,不改变细胞代谢途径。作者采用溴乙锭对出芽短梗霉进行诱变处理,得到一株变异菌株,并研究了其产普鲁兰粗多糖情况。
1 实验
1.1 菌种
出芽短梗霉3.2756,由武汉生物工程学院发酵工程实验室提供。
1.2 培养基及培养方法
PDA培养基:马铃薯(去皮)200 g,葡萄糖20 g,琼脂15 g,水1000 m L。
改良PDA培养基:马铃薯(去皮)100 g,葡萄糖10 g,琼脂15 g,水1000 m L。
液体培养基:葡萄糖2.5~10 g,(NH4)2SO40.1 g,K2HPO40.2 g,酵母膏0.04 g,NaCl 0.1 g,Mg-SO4·7 H2O 0.04 g,FeSO4·7H2O 0.001 g,加水至100 m L,p H 值6.5,0.1 MPa灭菌15 min。
培养方法:培养温度为(27±2)℃,斜面活化和平板培养用PDA培养基,斜面培养48 h后4℃冰箱保存。用含葡萄糖2.5%的液体培养基试管培养48 h后,接入装有45 m L含葡萄糖10%的液体培养基的250 m L三角瓶中,接种量2%,200 r·min-1摇瓶培养24 h。
1.3 诱变处理
取摇瓶培养液10 m L,加入到90 m L含40μg溴乙锭的液体培养基中,25~27℃下分别:(1)200 r·min-1培养4 h;(2)200 r·min-1培养4 h后静置48 h。将培养液用生理盐水梯度稀释,取稀释度为10-3、10-4、10-5、10-6的培养液涂布平板,菌落编号转入斜面培养。
1.4 粗多糖的提取
取发酵液于4000 r·min-1离心30 min,分离菌体,上清液加入3 BV乙醇沉淀,于3000 r·min-1离心15 min,沉淀用去离子水溶解后再用3 BV乙醇沉淀,过滤烘干至恒重,得普鲁兰粗多糖。菌体用去离子水洗涤,再用0.45μm膜过滤,滤渣用去离子水洗涤,烘干至恒重为菌体干重。按下式计算多糖转化率:

2 结果与讨论
2.1 出发菌株的培养与优化
不同的出芽短梗霉菌株菌落外观、发酵液和多糖的色泽各有不同[12],普遍认为菌株3.2756、3.3984有较好的产普鲁兰潜力。出芽短梗霉生长过程有多种细胞形态[13],酵母态细胞是生成普鲁兰的主要细胞形态[14]。
菌株3.2756液体培养形成菌丝和大小不一的酵母态细胞,并形成菌丝团和菌体球,表面覆盖粘状物,摇瓶培养120 h后,平板培养菌落表面皱缩,即开始生成厚垣孢子。
液体培养普鲁兰粗多糖产量随葡萄糖含量增加而升高,粗多糖转化率随葡萄糖含量不同而变化。用含葡萄糖10%的液体培养基培养72 h,粗多糖产量最高为11.07 g·L-1(图1)。发酵液深褐色至黑色,发酵终p H值2.5~2.7,粗多糖黑色。
对菌株3.2756用PDA平板反复分离筛选,得到一株自然突变株BE1-6,菌落由初期的深褐色逐渐变为深黄绿色至黑色,之后全部转化为黑色。摇瓶培养酵母态细胞增加,发酵液灰白色,发酵终p H值4.5~4.7,粗多糖黑色。用含葡萄糖10%的液体培养基培养,粗多糖产量27.13 g·L-1。
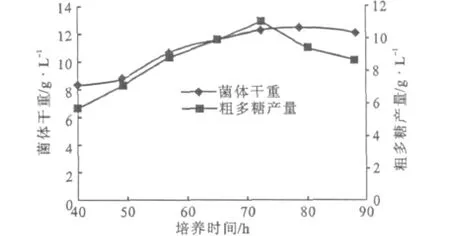
图1 菌株3.2756培养时间与菌体干重及粗多糖产量的关系Fig.1 The relationship between culture time and dry cell weight,crude polysaccharide production for strain 3.2756
2.2 溴乙锭诱变处理结果
将菌株BE1-6用溴乙锭诱变处理,(1)法处理获得菌株粗多糖产量比BE1-6略高,其它无明显差异;(2)法处理后分离得到一株变异株BM2-5,菌落呈白色,有时泛浅粉红色,4℃保藏7 d后逐渐出现黑色,1个月后菌落全部转变为黑色。用改良PDA培养基保藏,菌落出现黑色时间推迟。菌株BM2-5发酵液细胞全部为酵母态,细胞大小不到原酵母态细胞的1/10,发酵液白色,发酵终p H值4.5~4.7,粗多糖白色。用含葡萄糖10%的液体培养基培养,粗多糖产量47.82 g·L-1。用不同含量葡萄糖发酵,多糖转化率差异不明显。连续培养8次以上,粗多糖产量差异不明显。3株菌的特征及粗多糖产量比较见表1。

表1 不同菌株的特征及粗多糖产量比较Tab.1 The comparison of characteristic and crude polysaccharide production of different strains
2.3 诱变菌株BM2-5发酵产糖结果
以大米酶解葡萄糖为碳源或以玉米浆代替酵母膏,多糖产量均有提高。菌株BM2-5在大米酶解葡萄糖10%、(NH4)2SO40.1%、K2HPO40.2%、玉米浆0.1%、NaCl 0.1%、MgSO4·7H2O 0.04%、FeSO4·7H2O 0.001%、自然p H 值的培养基中,200 r·min-1摇瓶培养72 h,粗多糖产量最高,为66.37 g·L-1。
菌株用改良PDA培养基保藏时间不超过5 d、活化斜面保藏时间不超过24 h,200 r·min-1摇瓶培养72 h,粗多糖产量最高,为68.06 g·L-1(图2)。

图2 菌株BM2-5培养时间与菌体干重及粗多糖产量的关系Fig.2 The relationship between culture time and dry cell weight,crude polysaccharide production for strain BM2-5
用2 L发酵罐装料1 L,培养基为淀粉糊精(DE35)10%、K2HPO40.2%、蛋白胨 0.2%、NaCl 0.1%、MgSO4·7H2O 0.04%,在通风量为0.5 L·min-1、搅拌转速为350 r·min-1、(27±1)℃、罐压为0.1~0.65 kPa的条件下,粗多糖产量为47.8 g·L-1。
3 结论
在自然育种的基础上用溴乙锭对出芽短梗霉进行诱变,得到菌落及细胞外观差异明显、普鲁兰粗多糖产量大幅提高的诱变株BM2-5,在大米酶解葡萄糖10%、(NH4)2SO40.1%、K2HPO40.2%、玉 米 浆0.1%、NaCl 0.1%、MgSO4·7H2O 0.04%、FeSO4·7H2O 0.001%、p H 值自然的培养基中,摇瓶培养72 h,得到白色的粗多糖,产量最高为68.06 g·L-1。
[1] Leathers T D.Biotechnological production and applications of pullulan[J].Appl Microbiol Biotechnol,2003,62(5-6):468-473.
[2] 曹新志.普鲁兰的生产与应用研究进展[J].四川理工学院学报(自然科学版),2006,19(4):60-62.
[3] Shingel I.Current knowledge on biosynthesis,biological activity,and chemical modification of the exopolysaccharide,pullulan[J].Carbohydr Res,2004,339(3):447-460.
[4] 谷才恩.短梗茁霉胞外多糖的研究Ⅰ.菌种的筛选[J].微生物学通报,1985,12(2):67-69.
[5] 贺红星,张永茂,史久英,等.高产低色素普鲁兰生产菌株的复合筛选[J].食品工业科技,2008,29(9):145-148.
[6] 朱永强,方尚玲,覃敬羽,等.短梗霉多糖菌的复合诱变筛选及培养基优化[J].食品与发酵科技,2010,46(1):47-51.
[7] 于航,童群义.培养基对短梗霉多糖产量及其发酵液颜色的影响[J].食品科技,2007,32(4):24-26.
[8] 于航,童群义.低色素出芽短梗霉G-58发酵的初步研究[J].食品研究与开发,2006,17(11):65-68.
[9] 潘素娟,王建军,焦成谨,等.低色素出芽短梗霉 W2003发酵条件研究[J].天水师范学院学报,2010,30(2):59-62.
[10] Slonimski P P,Perrodin G,Croft J H.Ethidium bromide induced mutation of yeast mitochondria:Compelete transformation of cells into respiratory deficient non-chromosomal"Petites"[J].Biochemical and Biophysical Research Communication,1968,30(3):232-239.
[11] Kelly P J,Catley B J.The effect of ethidium bromide mutagenesis on dimorphism,extracelluler metabolism and cytochrome levels inAureobasidium pullulans[J].Journal of Genreral Microbiology,1977,102(2):249-254.
[12] 邓长江,李长清,朱希强,等.产普鲁兰糖出芽短梗霉菌株的初步筛选[J].食品与药品,2007,9(2A):18-20.
[13] Dominguez J B,Goi F M,Uruburu F.The transition from yeastlike to chlamydospore cells inPullularia pullulans[J].Journal of General Microbiology,1978,108(1):111-117.
[14] Heald P J,Kristiansen B.Synthesis of polysaccharide by yeastlike forms ofAureobasidium pullulans[J].Biotechnology and Bioengineering,1985,27(10):1516-1519.
Ethidium Bromide Induced Mutation ofAureobasidium Pullulans
HU Hong-sen,YE Bin
(Department of Biotechnology,Wuhan Biotechnology Institute,Wuhan430415,China)
Aureobasidium pullulanswas mutagenized by ethidium bromide,and a pigment-free mutant BM2-5 was obtained,for which the cells were of yeast-like form in liquid fermentation.When BM2-5 was cultured at 27℃and 200 r·min-1for 72 h in the liquid culture medium with enzymatic hydrolyzed rice glucose as carbon source,the maximum pullulan polysaccharide production was 68.06 g·L-1.
Aureobasidium pullulans;mutagenesis;ethidium bromide;pullulan
TS 261.1
A
1672-5425(2012)11-0061-03
10.3969/j.issn.1672-5425.2012.11.017
2012-08-06
胡洪森(1966-),男,湖北鄂州人,高级工程师,研究方向:食品发酵技术,E-mail:huhsm@163.com。

