荧光光谱法研究氢化可的松与牛血清白蛋白的结合作用
徐 科,黄亚励,刘 红,徐 红
(贵阳医学院化学教研室,贵州 贵阳 550004)
荧光光谱法研究氢化可的松与牛血清白蛋白的结合作用
徐 科,黄亚励,刘 红,徐 红
(贵阳医学院化学教研室,贵州 贵阳 550004)
模拟人体p H值,在不同温度下采用荧光光谱和同步荧光光谱研究了氢化可的松与牛血清白蛋白(BSA)的相互作用及对其同步荧光的影响。结果表明,在p H值7.37的Tris-HCl缓冲溶液中,氢化可的松和BSA彼此扩散和碰撞达到动态平衡导致BSA荧光猝灭,属于动态猝灭机制。计算得到BSA与氢化可的松在25℃和37℃下动态猝灭的猝灭常数分别为1.98105×107L·mol-1·s-1和2.05933×107L·mol-1·s-1。根据热力学方程得出氢化可的松与BSA相互作用的参数,ΔH<0、ΔS>0,说明氢化可的松与BSA相互作用以静电引力为主。氢化可的松加入后,BSA同步荧光光谱(Δλ=60 nm)的最大发射波长发生红移,表明色氨酸残基所处环境的极性增加。
氢化可的松;牛血清白蛋白;动态猝灭;热力学参数
氢化可的松是人工合成也是天然存在的糖皮质激素,属于甾族化合物,是一种常用的消炎药,主要用于治疗类风湿性关节炎、风湿性发热、痛风、支气管哮喘、过敏性皮炎、脂溢性皮炎、瘙痒症及肾上腺功能不全所引起的疾病等。但是长期大量服用会引起柯兴氏症、水钠潴留、精神症状、消化系统溃疡、骨质疏松、生长发育受抑制等病症。
近年来,研究药物分子与血清白蛋白相互作用已成为热门课题之一[1~3],对于阐明药物的作用机制和药代动力学,提高用药科学性意义重要。但氢化可的松与牛血清白蛋白(BSA)之间相互作用的研究尚未见报道。作者讨论了在模拟人体生理条件下,氢化可的松与BSA之间的相互作用及对BSA同步荧光的影响。
1 实验
1.1 试剂与仪器
牛血清白蛋白(BSA),Sigma公司;氢化可的松(国产);其它试剂均为市售分析纯;实验用水为二次蒸馏水。
Cary eclipse型荧光分光光度计,美国瓦里安公司;CY-100μL型微量注射器,北京青云卓立精密设备有限公司。
1.2 方法
氢化可的松储备液的配制:准确称量氢化可的松0.2025 g,用乙醇溶解并定容至100 m L,即得浓度为5.587×10-3mol·L-1的储备液。
配制BSA的储备液,用p H值7.37的Tris-HCl缓冲溶液定容,得浓度为0.724 mg·m L-1的BSA溶液,置于4℃冰箱中保存。
在10 m L比色管中依次加入0.5 m L BSA溶液、1.0 m L 0.5 mol·L-1的 NaCl溶液、5.00 m Lp H 值7.37的Tris-HCl缓冲溶液,用微量注射器依次加入体积(m L)为 0、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20、0.22的氢化可的松储备液,用二次蒸馏水定容。荧光比色皿为1 cm,固定激发波长为230 nm,入射和出射狭缝为5 nm,分别于25℃和37℃测定荧光光谱和同步荧光光谱。
2 结果与讨论
2.1 氢化可的松与BSA结合的荧光光谱
固定BSA的浓度不变,改变加入的氢化可的松的浓度,扫描混合溶液的荧光光谱,结果见图1。

图1 氢化可的松对BSA荧光光谱的影响Fig.1 Fluorescence quenching of BSA by hydrocortisone
从图1可以看出,在不同温度下,随着氢化可的松浓度的增大,BSA在343 nm处的荧光发射峰强度明显减弱,出现典型的荧光猝灭现象,说明两者之间存在着相互作用。
2.2 荧光猝灭常数的测定
广义上说,任何使荧光强度降低的作用都可以称为荧光猝灭。导致BSA荧光猝灭的过程通常存在动态猝灭和静态猝灭两种。动态猝灭是化合物和蛋白质的激发态分子间的相互碰撞而导致的荧光猝灭,并不影响蛋白质的结构和生理活性。静态猝灭则通常是由于发生了配合反应,对蛋白质的构象产生影响,并可能影响其生理活性。动态荧光猝灭遵循Stern-Volmer方程[4]:
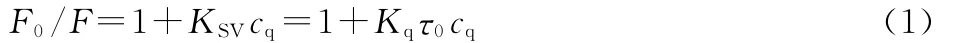
式中:F0和F分别为不加入和加入猝灭剂时体系的相对荧光强度;KSV为动态猝灭常数(即Stern-Volmer猝灭常数);cq为猝灭剂的浓度;Kq为荧光猝灭速率常数,猝灭剂对生物大分子的最大Kq一般为2.0×1010L·mol-1·s-1;τ0为荧光物质的平均寿命,生物大分子的荧光平均寿命一般为10-8s[5]。
以不同温度下BSA的荧光强度F0/F比值对猝灭剂浓度作图,见图2。
从图2可以看出,随着猝灭剂氢化可的松浓度的增大,F0/F逐渐增大,线性拟合方程的相关系数分别为0.9981(25℃)和0.9979(37℃),呈良好的线性关系。计算得到25℃和37℃下荧光猝灭速率常数Kq分别为1.98105×107L·mol-1·s-1和2.05933×107L·mol-1·s-1,因此可以判断BSA的荧光猝灭是由于BSA和氢化可的松之间彼此扩散和碰撞引起的动态猝灭。
2.3 结合常数和结合位点数的测定
对于动态猝灭,荧光强度与猝灭剂的关系可由结合常数表达式[6]推导求出:

图2 BSA与氢化可的松相互作用的Stern-Volmer曲线Fig.2 The Stern-Volmer plot of hydrocortisone combined with BSA

式中:n为结合位点数;KA为结合常数。
根据25℃和37℃下实验体系的测量数据,以lg[(F0-F)/F]对lgcq作图,见图3。
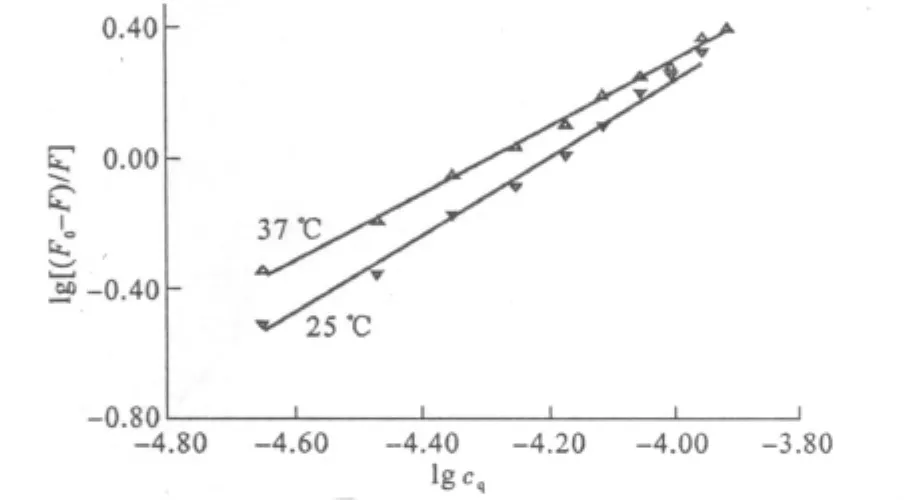
图3 lg[(F0-F)/F]与lg cq 关系曲线Fig.3 The relationship plot of lg[(F0-F)/F]and lg cq
图3中直线的线性拟合方程以及由直线的斜率和截距求得的不同温度下氢化可的松和BSA作用的KA和n,见表1。

表1结合常数、结合位点数和热力学参数Tab.1 Binding constant,binding sites and thermodynamic parameters
2.4 氢化可的松与BSA结合的热力学参数
氢化可的松与BSA的动态猝灭结合常数KD可依据Lineweaver-Burk双倒数函数关系式[7]求得:

以(F0-F)-1对cq-1作图,求取KD。由于温度变化不大,将焓变ΔH作为常数,根据热力学公式求出结合反应的自由能变ΔG、焓变ΔH、熵变ΔS,见表1。

Ross等[8]根据大量实验结果,总结了生物大分子与小分子作用力类型的热力学规律,从氢化可的松与BSA作用的热力学参数看出,ΔH<0、ΔS>0,可以推测该体系的作用力以静电引力为主。
2.5 氢化可的松对BSA同步荧光光谱的影响
对于BSA的同步荧光光谱,Δλ=15 nm时为酪氨酸残基的荧光,Δλ=60 nm时则为色氨酸残基的荧光,因残基的最大吸收波长与其所处环境的极性有关,故由发射波长的改变可判断BSA构象的变化:若最大发射波长红移,表明残基所处环境的极性增加,蓝移则表明疏水性增加。实验表明,氢化可的松的加入对Δλ=15 nm时BSA的同步荧光光谱没有明显的影响。氢化可的松加入后Δλ=60 nm时BSA的同步荧光光谱见图4。
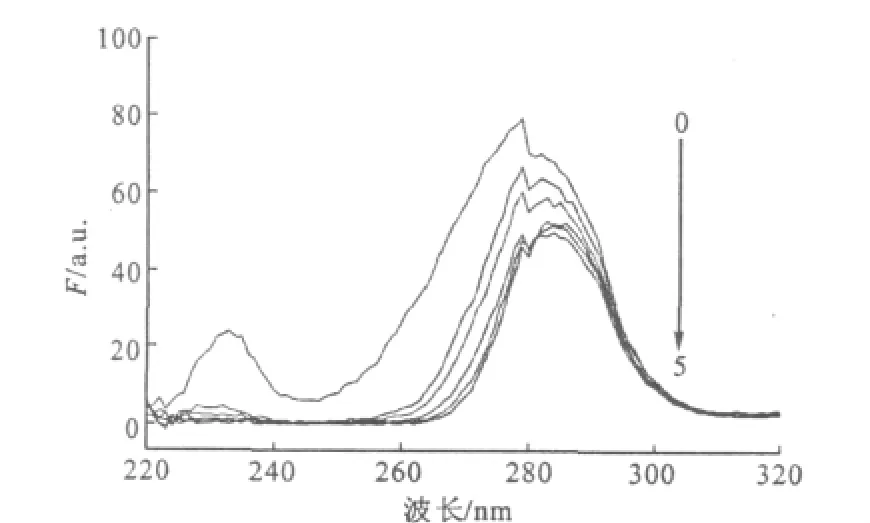
图4 氢化可的松存在下BSA的同步荧光光谱(Δλ=60 nm,25℃)Fig.4 The BSA synchronous fluorescence spectra in the presence of hydrocortisone(Δλ=60 nm,25℃)
从图4可以看出,在不同温度下,随着氢化可的松浓度的增大,色氨酸残基的荧光强度降低,BSA同步荧光光谱的最大发射波长发生红移,表明色氨酸残基所处环境的极性增加。
3 结论
模拟人体p H值,在不同温度下采用荧光光谱和同步荧光光谱研究了氢化可的松与BSA的相互作用。结果表明,在p H值7.37的Tris-HCl缓冲溶液中,氢化可的松和BSA彼此扩散和碰撞达到动态平衡导致BSA荧光猝灭,属于动态猝灭机制。计算得到BSA与氢化可的松在25℃和37℃下动态猝灭速率常数分别为1.98105×107L·mol-1·s-1和2.05933×107L·mol-1·s-1。根据热力学方程得出氢化可的松与BSA相互作用的参数,ΔH<0、ΔS>0,说明氢化可的松与BSA相互作用以静电引力为主。加入氢化可的松后,BSA同步荧光光谱(Δλ=60 nm)的最大发射波长发生红移,表明色氨酸残基所处环境的极性增加。
[1] 徐科.氨苄青霉素与牛血清蛋白结合作用的研究[J].化学试剂,2010,32(8):694-696.
[2] 徐科,刘红.荧光分光光度法研究氯霉素与蛋白质的相互作用[J].化工时刊,2010,24(4):52-54.
[3] 潘祖亭,刘义庆,刘小玲.药物荧光分析法研究进展[J].武汉大学学报(自然科学版),2000,46(6):674-680.
[4] Braun A M,Maurette M T.Photochemical Technology[M].New York:Oliveros,E Wiley,1991:41.
[5] Lakowicz J R,Weber G.Quenching of fluorescence by oxygen.A probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21):4161.
[6] 冯喜增,金瑞祥,何锡文,等.各种离子对血卟啉与牛血清蛋白相互结合反应的影响研究[J].高等学校化学学报,1996,17(6):866-869.
[7] 杨频,杨曼曼,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(9):734-739.
[8] Ross P D,Subramanran S.Thermodynamic of protein in association reaction:Force contribution to stability[J].Biol Chem,1981,20(11):3096-3102.
Study on Binding of Hydrocortisone with Bovine Serum Albumin by Fluorescence Spectroscopy
XU Ke,HUANG Ya-li,LIU Hong,XU Hong
(Department of Chemistry,Guiyang Medical College,Guiyang550004,China)
The binding characteristics of hydrocortisone and bovine serum albumin(BSA)were studied by fluorescence and synchronous fluorescence spectroscopy at different temperatures in simulated human body p H value.The results showed that hydrocortisone had a powerful ability to quench the BSA fluorescence via a diffusion and impact energy transfer mechanism in the Tris-HCl buffer system with a p H value of 7.37.The quenching rate constants,the binding constants and the binding sites of the dynamic quenching were calculated at different temperatures.And according to the thermodynamic parameters calculated,the binding of BSA atΔλ=60 nm and hydrocortisone was mainly attributed to the electrostatic attraction force.The maximum emission wavelength of the synchronous fluorescence spectrum of BSA had a red shift in the presence of bydrocortisone,indicating that it enhanced the polarity of the environment in which Trp residues existed.
hydrocortisone;bovine serum albumin(BSA);dynamic quenching;thermodynamic parameter
O 642.1
A
1672-5425(2012)11-0032-04
10.3969/j.issn.1672-5425.2012.11.009
黔科合SY字[2011]3128项目资助
2012-07-27
徐科(1978-),女,贵州人,硕士,副教授,研究方向:分析化学及生物无机化学,E-mail:lilykxu@163.com。

