钛柱撑蒙脱石光催化降解甲基橙的性能研究
梁 凯
(韶关学院环境工程系,广东 韶关 512005)
钛柱撑蒙脱石光催化降解甲基橙的性能研究
梁 凯
(韶关学院环境工程系,广东 韶关 512005)
以钛酸丁酯为前驱体、钠基蒙脱石为载体,采用溶胶-凝胶法制备了二氧化钛柱撑蒙脱石(TiO2-MMT)纳米复合材料。采用X-射线衍射仪、透射电子显微镜、全自动比表面积及中孔、微孔分析仪(BET)等分析手段对TiO2-MMT进行了表征,并研究了其对甲基橙的光催化降解活性。结果表明:TiO2-MMT主要由锐钛矿型TiO2和蒙脱石组成,呈层片状结构,TiO2柱撑到蒙脱石层间,并使其(001)晶面间距明显增大。在中性和碱性条件下,TiO2-MMT对甲基橙的光催化降解能力较弱;在酸性条件下,TiO2-MMT对甲基橙的降解率远远高于中性和碱性条件下的降解率。TiO2-MMT光催化降解甲基橙的优化条件为:p H值4、甲基橙初始浓度30 mg·L-1、TiO2-MMT投加量10 g·L-1,在优化条件下光照2 h,TiO2-MMT对甲基橙的催化降解率为99.4%。
二氧化钛;蒙脱石;TiO2柱撑蒙脱石;光催化降解;甲基橙
二氧化钛柱撑蒙脱石(TiO2-MMT)纳米复合材料是颇受关注的硅酸盐矿物复合材料之一。它是将聚合羟基钛离子引入蒙脱石层间,经煅烧后形成,TiO2负载于蒙脱石层间。这既可充分利用蒙脱石对有机物的强吸附能力,又可充分发挥TiO2的光催化特性,纳米TiO2分散于蒙脱石表面,能最大限度地体现纳米材料的小尺寸效应、比表面效应和量子尺寸效应,达到既提高TiO2光催化降解性能,又可回收TiO2的目的[1]。
众所周知,层状矿物材料经“柱撑”后,其层间距、稳定性、比表面积、表面酸碱性及催化性能均可获得不同程度的提高。柱撑蒙脱石因具有颗粒尺寸小、比表面积大、酸性高、吸附性及催化活性较好等特点,被广泛用作催化剂及催化剂载体、吸附剂。研究表明,各种有机或无机的改性剂通过柱撑、插层或酸化等处理得到的蒙脱石,在环境保护方面有很好的应用前景[2~7]。近年来,TiO2柱撑蒙脱石作为光催化剂降解废水中污染物的报道较多,在光催化降解有机物方面发挥了重要作用[8~10]。
已有的文献报道中,对TiO2柱撑蒙脱石在光催化降解方面的研究多侧重于催化剂自身特征与性能的关系,对降解环境及条件等方面的因素考虑较少。作者采用溶胶-凝胶法制备了TiO2柱撑蒙脱石纳米复合材料,对其结构进行了表征,并考察了其对甲基橙的光催化降解性能,拟为TiO2柱撑蒙脱石纳米复合材料的实际应用提供参考依据。
1 实验
1.1 试剂与仪器
钠基蒙脱石(Na-MMT),浙江三鼎科技有限公司。
钛酸丁酯,上海美兴化工有限公司;浓硝酸,浙江中星化工试剂有限公司;无水乙醇,杭州高精细化工有限公司;浓盐酸,衢州巨化试剂有限公司;氢氧化钠、甲基橙,国药集团化学试剂有限公司;以上试剂均为分析纯。去离子水。
电子天平,上海精密科学仪器有限公司;数显控温磁力搅拌器,杭州瑞佳精密科学仪器有限公司;高速离心机,湖南湘仪公司;101-5型数显电热鼓风干燥箱,上海锦屏仪器仪表有限公司;电阻箱,洛阳西格马仪器制造有限公司;数控超声仪,昆山舒美超声仪器有限公司;紫外分析仪,日本岛津公司;X′Pert PRD型X-射线衍射仪,荷兰PANalytical公司;Tecnai G2 F 30 STwin型300 k V高分辨透射电子显微镜(TEM),荷兰Philips-FEI公司。
1.2 方法
1.2.1 TiO2柱化剂的制备
将一定量的钛酸丁酯与无水乙醇混合,得到溶液A;将一定浓度的硝酸与无水乙醇混合,得到溶液B。在剧烈搅拌下,将溶液A滴加到溶液B中,滴毕继续搅拌0.5 h,即得到清澈透明的TiO2柱化剂。
1.2.2 TiO2-MMT的制备
配制好一定质量浓度的Na-MMT土浆,持续搅拌1 h,在一定温度下将TiO2柱化剂缓慢滴加到Na-MMT土浆中,滴毕继续搅拌3 h,得到TiO2柱撑蒙脱石悬浮液,经陈化、洗涤、抽滤,再经烘干、煅烧、研磨,即得到 TiO2柱撑蒙脱石(TiO2-MMT)。1.2.3 TiO2-MMT光催化活性的测试
室温下,配制一定浓度的甲基橙模拟废水,测定其初始吸光度A0。取一定量的样品置于甲基橙溶液中,放入超声仪内,打开紫外灯并持续光照2 h(光照过程中每隔10 min超声1 min),离心分离,测定上清液在甲基橙最大吸收波长(酸性条件λ=508 nm、碱性条件λ=463 nm)处的吸光度值A t。甲基橙的降解率η按下式计算:
η=[(A0-At)/A0]×100%
1.2.4 样品的表征
样品晶相组成表征采用X-射线衍射仪(XRD),Cuκα靶,管流40 m A,管压45 k V,步长0.04°,扫描速度2.4°·min-1。样品形貌和微结构特征分析采用高分辨透射电子显微镜。样品比表面积及孔隙度分析采用全自动比表面积及中孔、微孔分析仪(BET),并根据BET结果计算材料改性前后的比表面积变化。
2 结果与讨论
2.1 XRD分析
Na-MMT和TiO2-MMT的XRD图谱见图1。
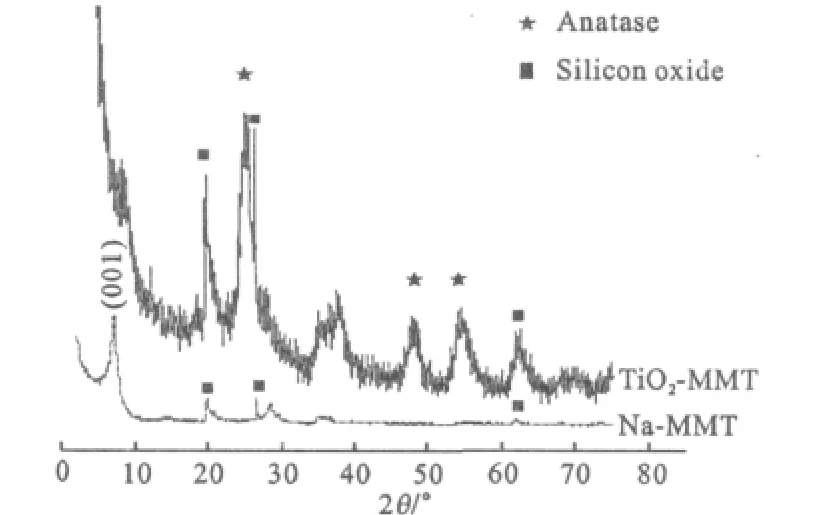
图1 Na-MMT和TiO2-MMT的XRD图谱Fig.1 XRD Patterns of Na-MMT and TiO2-MMT
由图1可看出,Na-MMT的蒙脱石(001)面的特征衍射峰(2θ=7.3°)清晰可见。根据Bragg公式,计算出 Na-MMT(001)面的层间距为1.247 nm;TiO2-MMT出现了一些新衍射峰,其中2θ为25.31°、48.04°和55.06°处的衍射峰可归属为锐钛矿型 TiO2(00-012-0204)。这说明柱撑后样品主要由锐钛矿型TiO2和蒙脱石组成。TiO2-MMT的蒙脱石(001)面的衍射峰宽化了,衍射曲线的背景增强。这是由于纳米TiO2的插入使得蒙脱石晶体结构受到了一定程度的破坏。TiO2-MMT小角度XRD图谱见图2。
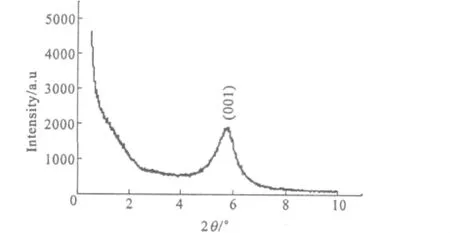
图2 TiO2柱撑蒙脱石小角度XRD图谱Fig.2 XRD Pattern of small angle of TiO2-MMT
由图2可看出,柱撑后蒙脱石(001)面衍射角向小角度偏移。根据Bragg公式,计算出其(001)面层间距为1.526 nm,大于 Na-MMT的1.247 nm。这说明TiO2柱撑导致蒙脱石层间距增大。
2.2 TEM 分析(图3)
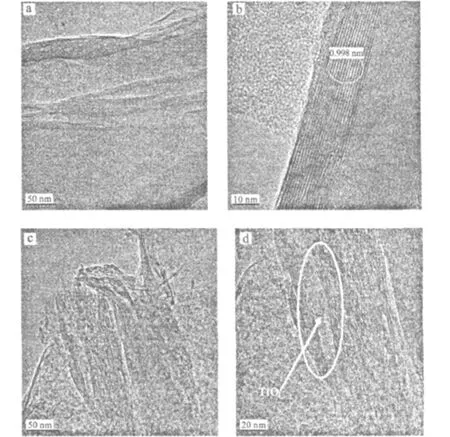
图3 Na-MMT和TiO2-MMT的TEM照片Fig.3 TEM Images of Na-MMT and TiO2-MMT
由图3b可看出,Na-MMT具有清晰的层状结构,其晶面间距为0.998 nm。由图3d可看出,经柱撑后,TiO2-MMT仍是层状结构;蒙脱石层间分布着许多细小的颗粒。结合XRD分析结果,这些颗粒应为锐钛矿型TiO2。
2.3 BET分析(表1)
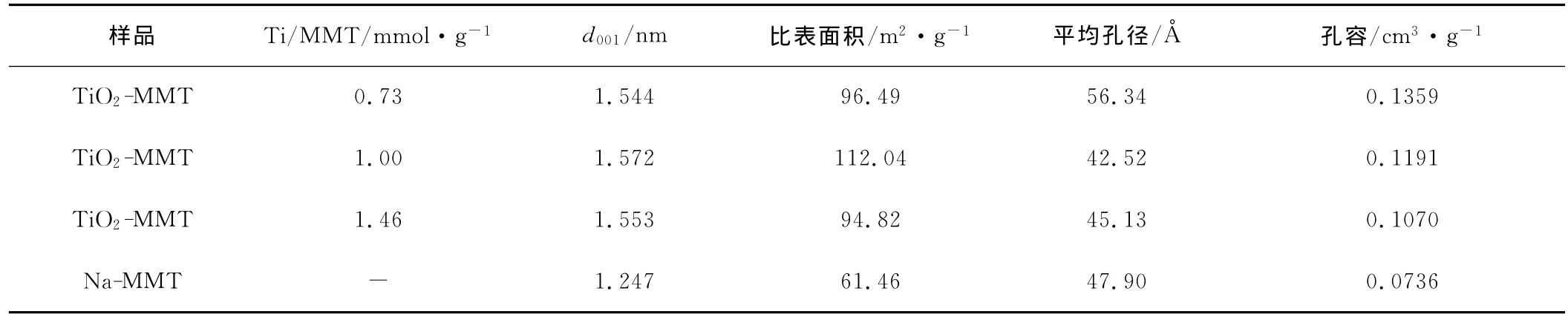
表1 样品的比表面积、孔径及孔容Tab.1 Specific surface area,pore diameter and pore volume of the samples
由表1可看出,与Na-MMT相比,柱撑后TiO2-MMT的比表面积、孔容明显增大,但孔径的变化没有规律,有的增大,有的减小。这可能是因为煅烧过程中TiO2颗粒不均匀长大所致。由表1还可看出,比表面积大的样品,其蒙脱石(001)面的层间距也较大。这表明TiO2-MMT的比表面积与蒙脱石(001)面的层间距呈正相关关系。
2.4 影响TiO2-MMT光催化性能的因素
2.4.1 p H 值
图4为甲基橙溶液分别在酸性、中性和碱性条件下的紫外可见吸收光谱。
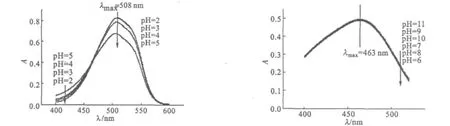
图4 甲基橙溶液在酸性、中性和碱性条件下的紫外可见吸收光谱Fig.4 UV-Vis Spectra of methyl orange solution under acidic conditions,neutral conditions and alkaline conditions
由图4可看出,在p H值为2~5的条件下,在甲基橙最大吸收波长(λ=508 nm)处的吸光度值变化较大,且吸光度曲线出现双肩峰。这说明在双肩峰范围内,甲基橙溶液对光的吸收较好;在p H值为6~11的条件下,在甲基橙最大吸收波长(λ=463 nm)处的吸光度值变化不明显,吸光度曲线均为单峰。这是由于甲基橙在酸性条件下是醌式结构[11],导致其在p H值为2~5时对紫外光的最大吸收波长在508 nm处;在弱酸性、中性和碱性条件下甲基橙是偶氮结构[11],致使其在p H值为6~11时对紫外光的最大吸收波长在463 nm处。
在10 m L浓度为10 mg·L-1的甲基橙溶液中加入0.02 g TiO2-MMT和 TiO2,分别用1.0 mol·L-1的HCl溶液和1.0 mol·L-1的NaOH溶液将甲基橙溶液的p H 值调为2、3、4、5、6、7、8、9、10、11,考察p H值对TiO2-MMT和TiO2光催化降解甲基橙的影响,结果如图5所示。
由图5a可看出,当溶液p H 值为4时,TiO2-MMT对甲基橙的降解率最高,达到94.1%;当溶液p H值分别为3和5时,对甲基橙的降解率也较高,分别达到92.3%和93.3%;而当溶液p H值大于5后,对甲基橙的降解率急剧下降,中性和弱碱性范围内的降解率最低;当溶液p H值大于10后,降解率又有所上升,但也远远低于酸性条件下(p H=2~5)的降解率。说明酸性条件有利于TiO2-MMT对甲基橙的光催化降解,从而也可间接说明甲基橙的醌式结构比偶氮结构更易降解[11]。
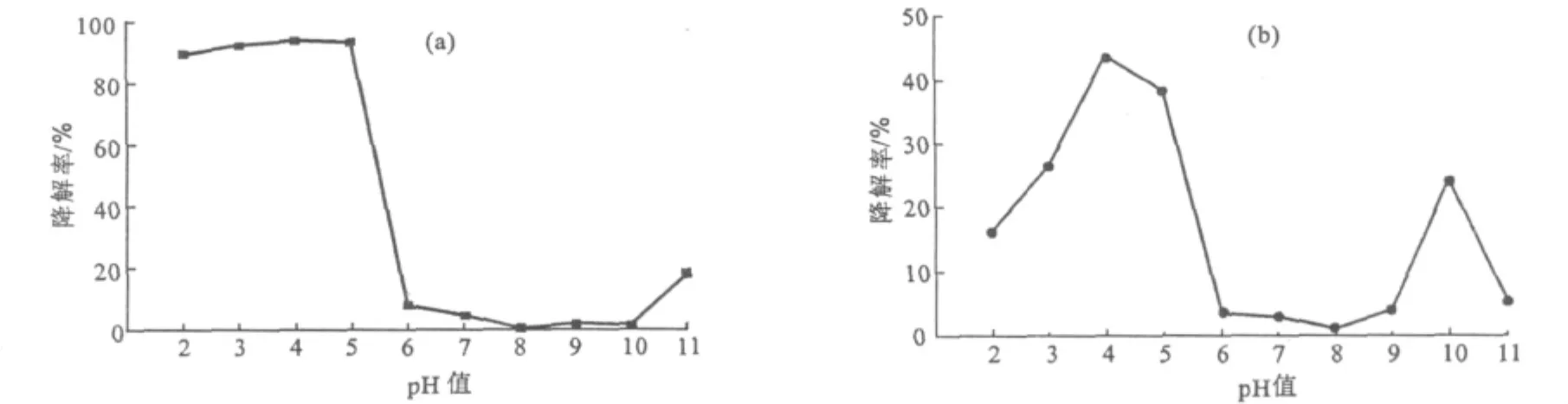
图5 不同p H值下TiO2-MMT(a)和TiO2(b)对甲基橙的光催化降解率Fig.5 Photocatalytic degradation rate of methyl orange by TiO2-MMT(a),TiO2(b)at different p H values
由图5b可看出,TiO2对甲基橙的降解效果也是酸性条件好于弱酸性、中性及碱性条件。在不同p H值条件下,TiO2对甲基橙的降解效果均不是很高;当p H值为4时,降解率最高,也只有43.7%,远远低于TiO2-MMT对甲基橙的降解率。
2.4.2 甲基橙初始浓度
将0.02 g TiO2-MMT分别加入到p H值为4且初始浓度分别为10 mg·L-1、20 mg·L-1、30 mg·L-1、40 mg·L-1、50 mg·L-1的10 m L甲基橙溶液中,考察甲基橙初始浓度对TiO2-MMT光催化性能的影响,结果如图6所示。

图6 甲基橙初始浓度对降解率的影响Fig.6 The effect of methyl orange initial concentration on degradation rate
由图6可看出,随着甲基橙初始浓度的增大,TiO2-MMT对甲基橙的降解率先升高后降低;当甲基橙初始浓度为30 mg·L-1时,降解率最高,达到95.3%;这说明TiO2-MMT对甲基橙有一个最大降解容量。当降解率为95.3%时,TiO2-MMT对甲基橙的降解容量为1.43 g·g-1,即1 g TiO2-MMT可降解1.43 g甲基橙,当超过这一降解容量时,TiO2-MMT的活性位被甲基橙占据,就像“催化剂中毒”一样,光催化性能降低。由此可认为,当催化剂的加入量和光强度一定时,TiO2-MMT只对一定浓度范围内的甲基橙进行有效的光催化降解。
2.4.3 TiO2-MMT投加量
在p H值为4、初始浓度为10 mg·L-1的10 m L甲基橙溶液中,分别加入 TiO2-MMT或 Na-MMT 0.02 g、0.04 g、0.06 g、0.08 g、0.10 g、0.15 g、0.20 g和0.25 g,考察TiO2-MMT投加量对光催化性能的影响,结果如图7所示。
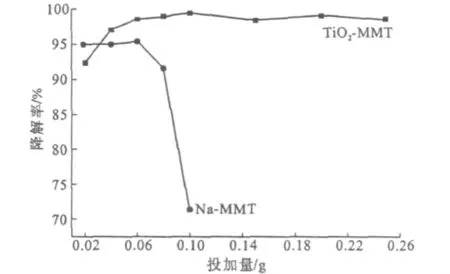
图7 催化剂投加量对甲基橙降解率的影响Fig.7 The effect of catalyst dosage on degradation rate of methyl orange
由图7可看出,随着TiO2-MMT投加量的增加,甲基橙的降解率先升高后降低;当投加量为0.10 g时,降解率最高,达到99.4%。这说明TiO2-MMT的光催化性能与其在降解体系中的投加量有关。投加量过低则不能充分地降解目标物,投加量过高造成不必要的浪费。这是因为,在甲基橙初始浓度一定的条件下,随着光催化降解的进行,甲基橙浓度越来越低,低到一定程度时,由于受传质与扩散的制约,剩余甲基橙被光催化降解的几率越来越小了。
由图7还可看出,当Na-MMT投加量小于0.06 g时,随着投加量的增加,降解率变化不大;而当Na-MMT投加量大于0.06 g时,降解率急剧下降。与TiO2-MMT相比,Na-MMT降解甲基橙的效果较差。这可能是由于Na-MMT降解甲基橙只有吸附过程,没有光催化降解过程。TiO2-MMT既利用了蒙脱石的吸附性能,又体现了TiO2的光催化降解性能,较好地体现了两者的协同效应。
3 结论
(1)以钛酸丁酯为前驱体、钠基蒙脱石为载体,采用溶胶-凝胶法制备了TiO2柱撑蒙脱石纳米复合材料;在复合材料中,蒙脱石仍然保持较完整的层状结构,TiO2颗粒位于蒙脱石层间,并使蒙脱石层间距扩大。
(2)TiO2柱撑蒙脱石复合材料对甲基橙的光催化降解不仅与其特性有关,更与实际降解过程中环境的酸碱度、投加量和甲基橙的初始浓度有关。其优化的降解条件为:p H值4、甲基橙初始浓度30 mg·L-1、催化剂投加量10 g·L-1。在上述优化条件下光照2 h,TiO2柱撑蒙脱石复合材料对甲基橙的光催化降解率可达99.4%。这充分说明TiO2和蒙脱石构成柱撑复合材料后,两者对甲基橙的光催化降解具有良好的协同效应。
[1] 陶龙骧.层柱粘土及其在催化反应中的应用[J].矿物岩石地球化学通报,2002,21(4):221-224.
[2] 高斌,徐仲燕,王晓蓉,等.有机粘土在工业废水处理中的应用[J].工业水处理,2002,22(4):29-34.
[3] 吴平霄,叶代启,明彩兵.柱撑粘土矿物层间域的性质及其环境意义[J].矿物岩石地球化学通报,2002,21(4):228-233.
[4] 罗道成,刘俊峰,陈安国.改性膨润土的制备及其对电镀废水中Pb2+、Cr3+、Ni2+的吸附性能研究[J].中国矿业,2003,12(11):53-55.
[5] 刘转年,周安宁,金奇庭.粘土吸附剂在废水处理中的应用[J].环境污染治理技术与设备,2003,4(2):54-58.
[6] 梁云,贾德民.蒙脱土的改性研究进展[J].化工矿物与加工,2004,33(2):1-5.
[7] 周艳,蔡长庚,郑小瑰,等.蒙脱土的有机改性概述[J].材料科学与工程学报,2003,21(6):927-929.
[8] 孙振世,杨晔,陈英旭.TiO2柱撑膨润土复合光催化剂的合成及其光催化活性[J].太阳能学报,2003,24(5):703-707.
[9] 王丽娟,廖立兵,韩琳.TiO2-蒙脱石光催化降解苯酚的实验研究[J].矿物岩石地球化学通报,2004,23(4):310-313.
[10] 张明,曹明礼,车涛.微波加热法制备TiO2/膨润土复合光催化材料[J].工业催化,2004,12(12):42-45.
[11] 王怡中,符雁,汤鸿宵.TiO2悬浆体系太阳光催化降解甲基橙研究[J].环境科学学报,1999,19(1):63-67.
Photocatalytic Degradation Performance of Titania Pillared Montmorillonite for Methyl Orange
LIANG Kai
(Department of Environmental Engineering,Shaoguan University,Shaoguan512005,China)
Titania pillared montmorillonite(TiO2-MMT)composite was prepared by a sol-gel approach,using butyl titanate as precursor and Na-montmorillonite as support.The samples were characterized by X-ray diffraction,transmission electron microscopy,BET.Its photocatalytic degradation performance for methyl orange(MO)was investigated by UV-Vis absorption spectrum.The results showed that the crystal phase of TiO2-MMT was composed of anatase and MMT,anatase particles lay in the interlayer space of MMT,and the lattice distance of the(001)plane of MMT was enlarged evidently.Photocatalytic degradation rate of TiO2-MMT for MO under acidic condition was much higher than that under neutral and alkaline conditions.The optimal photocatalytic degradation conditions of TiO2-MMT for MO were as follows:p H value of MO aqueous solution of 4,MO initial concentration of 30 mg·L-1and TiO2-MMT dosage of 10 g·L-1.Irradiated for 2 h under above conditions,the photocatalytic degradation rate of MO was 99.4%.
titanium dioxide;montmorillonite;titania pillared montmorillonite;photocatalytic degradation;methyl orange
TQ 424.2
A
1672-5425(2012)11-0071-05
10.3969/j.issn.1672-5425.2012.11.020
广东省自然科学基金资助项目(粤科基办【2009】3号)
2012-07-06
梁凯(1968-),男,内蒙古人,博士,研究方向:环境工程,E-mail:liangkaire12345@163.com。

