回转条件下微生物产酶表征
钞亚鹏,杨 敬,黄 兵,黄 英,钱世钧
(中国科学院微生物研究所 传感技术国家联合重点实验室
微生物资源前期开发国家重点实验室,北京 100101)
回转条件下微生物产酶表征
钞亚鹏,杨 敬,黄 兵,黄 英,钱世钧
(中国科学院微生物研究所 传感技术国家联合重点实验室
微生物资源前期开发国家重点实验室,北京 100101)
选定3株高产淀粉酶、蛋白酶、纤维素酶的细菌(枯草芽孢杆菌)、放线菌(链霉菌)和丝状真菌(里氏木霉)作为模式菌株,研究了在回转条件下单独发酵产酶及混合培养产酶过程及能力。结果表明,枯草芽孢杆菌、链霉菌和里氏木霉在p H值6.0~7.9之间都可生长。在回转条件下发酵30 d,枯草芽孢杆菌维持一定产淀粉酶和蛋白酶能力;链霉菌能够产少量的蛋白酶和淀粉酶;里氏木霉除了具有一定的产纤维素酶能力外,也能产少量的蛋白酶和淀粉酶。将3株菌进行分步混合培养,发酵过程中均能保持较高的淀粉酶活力和蛋白酶活力,在20 d和30 d的发酵液中检测不到纤维素酶活力。
回转条件;微生物;淀粉酶;蛋白酶;纤维素酶
随着我国载人航天事业的发展,深入开展受控生态生命保障系统(CELSS)研究,以实现封闭环境下的物质供给、废物处理和循环使用,已成为该领域面临的重要课题[1]。建立未来CELSS的重要条件之一是实现其中有机废物的降解和循环使用。在CELSS中,植物、动物的生命活动会产生大量的有机废弃物,而淀粉、蛋白、纤维素是这些有机废弃物的主要成分。在处理这些废弃物的过程中,利用特定微生物进行高效降解并实现循环利用具有条件温和、功能多样的优点[2]。
目前对于微重力条件下单一微生物的形态、生理性状报道较多[3~5],尚未见对微生物混合培养的报道。根据CELSS对微生物处理废弃物的潜在需求,本研究选用实验室已有的3株高效产酶的模式菌株:产中性蛋白酶的细菌枯草芽孢杆菌As 1398(同时具有较高淀粉酶活性)、具有较高降解特殊蛋白能力的放线菌链霉菌AS 4.412[6]、产纤维素酶的丝状真菌里氏木霉Trichoderma reeseiRUT C30(TR)[7],分析其在模拟微重力效应的简单回转条件下单独及混合产酶的特征,拟为CELSS中复杂有机废物的高效处理筛选和研制降解能力较强、作用效果持久的酶类,进而为设计适用于太空微重力环境下微生物酶深度处理有机废弃物的生物反应器和运行工艺提供参考。
1 实验
1.1 菌株
枯草芽孢杆菌As 1398,链霉菌AS 4.412,里氏木霉Trichoderma reeseiRUT C30(TR)。
1.2 仪器和回转培养条件
SM-Z1型单轴回转仪,中国科学院空间科学与应用研究中心。
回转培养条件:回转转速10 r·min-1,回转半径0.10 m。
1.3 培养基
蛋白酶培养基:可溶性淀粉5 g,K2HPO40.5 g,酪蛋白4 g,纯水定容到1 L,p H值8.0。
淀粉酶培养基:可溶性淀粉10 g,酵母粉5 g,蛋白胨1.5 g,纯水定容到1 L,p H值自然。
纤维素酶培养基:微晶纤维素33 g,玉米浆27 g,硫酸铵5 g,磷酸二氢钾6 g,硫酸镁1 g,甘油2.5 m L,吐温-80 2 m L,纯水定容到1 L,p H值4.5。
固体培养基:于上述液体培养基中加入15 g琼脂。用硫酸或氢氧化钠调节p H值,制备不同p H值梯度平板。
混合培养基:上述各产酶培养基的配方加倍,纯水定容到1 L,p H 值7.0。
如无特殊说明,后续实验中培养枯草芽孢杆菌用淀粉酶培养基,链霉菌用蛋白酶培养基,里氏木霉用纤维素酶培养基。
1.4 方法
1.4.1 细胞/孢子种子液制备
枯草芽孢杆菌种子液制备:从生长24 h的牛肉汁斜面挑取1环菌苔,接入液体培养基中于37℃培养12 h,用血球计数板在显微镜下计数后,稀释成106~107个·m L-1悬液。
链霉菌种子液制备:从生长6 d的高氏1号斜面用接种铲抠下一块菌苔,按10%的接种量接入液体培养基中于30℃培养72 h。
里氏木霉种子液制备:从生长7 d的PDA平板刮取孢子于无菌水中,涡旋振荡2 min,二层无菌滤纸过滤除去碎片,用血球计数板在显微镜下计数后,稀释成106~107个·m L-1悬液。
1.4.2 回转条件下平板培养
将枯草芽孢杆菌、链霉菌、里氏木霉细胞/孢子种子液分别在淀粉酶培养基、蛋白酶培养基、纤维素酶培养基固体培养基平板上点样1.5μL,每平板4个点;待种子液晾干后将一个平板固定在回转仪上,另一相同平板于地面1 g重力对照条件下静置培养,其它条件均相同,培养温度均为28℃。观察菌落形态和水解圈大小。
再将3株菌分别在p H值为6.0、6.5、7.0、7.5、7.9的梯度平板上培养,分别于3 d、6 d观察生长情况。
1.4.3 菌株单独液体发酵的回转培养
种子培养:枯草芽孢杆菌在淀粉酶液体培养基中培养24 h制备种子;链霉菌在蛋白酶液体培养基中培养2 d制备种子;里氏木霉在纤维素酶液体培养基中培养24 h制备种子。
在50 m L的螺口离心管中分别加入20 m L淀粉酶、蛋白酶和纤维素酶液体培养基,接种2 m L相应的种子培养物。每组做3个平行,一组于回转条件下培养,一组于1 g重力对照条件下静置培养。分别于4 d、8 d、20 d、30 d取样分析淀粉酶、蛋白酶、纤维素酶活力,实验数据为3管样品的平均值。
1.4.4 菌株混合发酵的回转培养
将1 m L里氏木霉种子接种于10 m L纤维素酶液体培养基中,分别在回转条件和1 g重力对照条件下培养,每组做3个平行。在第5 d、10 d、15 d的培养物中,加入等体积的混合培养基,并接入As 1398种子0.1 m L和AS 4.412种子2 m L。在同等条件下继续培养,并于第20 d、第30 d取样,测定3种酶活力,同时镜检3株菌在发酵液中的存活情况。
1.4.5 菌株存活情况的分析
取第30 d的单菌/混合培养样品200μL,分别涂布于LB和PDA平板上。于28℃培养3~7 d,观察生长情况。
1.4.6 分析与检测
1.4.6.1 蛋白酶活力测定
采用 Folin-Ciocalteu 法测定,略 有改动[6]。取1 m L适当稀释的酶液,加入到1.5 m L 1% 酪蛋白(用50 mmol·L-1Tris-HCl溶解)悬液中,置于40℃水浴中保温15 min,在反应液中加入3 m L 10% 三氯乙酸终止反应,室温静置30 min。然后于8000 r·min-1离心10 min,取1 mL上清液于干净的管子中,向其中加入5 mL 0.55 mol·L-1Na2CO3溶液,再加入1 mL Folin-Ciocalteu试剂,将混合液置于40℃水浴中保温15 min。在680 nm波长下测吸光度。酶和底物保温之前加入三氯乙酸作为对照,其它操作不变。
1个蛋白酶活力单位定义为:和对照相比,每分钟使吸光度增加10%所需的酶量。
1.4.6.2 淀粉酶活力测定
参照文献[8]进行。取0.4 m L 0.2%可溶性淀粉(菱糊牌)40℃预热15 min,加入0.1 m L适当稀释的酶液,在加酶液之前加入1.5 m L 0.1 mol·L-1HCl作为对照,40℃保温10 min,样品管加入1.5 m L HCl终止反应。样品管和对照管分别加入3 m L 1 mol·L-1I2-KI液及5 m L H2O,摇匀,在700 nm波长下测定吸光度。
1个淀粉酶活力单位定义为:和对照相比,每分钟使吸光度减少10%所需的酶量。
1.4.6.3 纤维素酶活力测定
按照轻工部的标准进行测定[9]。在试样管中加入1 m L缓冲溶液和1张滤纸条于50℃水浴中平衡3 min,加入0.5 m L酶液,保温1 h,加入3 m L DNS试剂,混合,沸水浴中煮10 min,自来水冷却。加蒸馏水10 m L,混合,在540 nm波长下测吸光度。对照管不加酶液保温1 h,加入3 m L DNS试剂后再加酶液,其它与样品管相同。
1个纤维素滤纸酶活力(FPAU)单位定义为:每分钟催化产生1μmol葡萄糖所需的酶量。
1.4.6.4 蛋白含量测定
采用Bradford方法进行[10]。将100μL发酵液加入到2.5 m L CBB中,以不加发酵液的CBB为对照,595 nm波长比色,OD值除以0.99即为蛋白含量,单位 mg·m L-1。
2 结果与讨论
2.1 平板培养
3株菌在淀粉酶培养基平板、蛋白酶培养基平板、纤维素酶培养基平板上的生长形态和产酶情况见图1、表1。

图1 3株菌在平板上的生长形态和产酶情况Fig.1 Morphology and enzyme production of three strains on agar plates
由图1可知,枯草芽孢杆菌As 1398能够较好地在淀粉酶培养基平板和蛋白酶培养基平板上产生水解圈,在纤维素酶培养基平板上也能够生长。链霉菌AS 4.412在淀粉酶培养基和蛋白酶培养基平板上也有明显的水解圈产生,但不能在纤维素酶培养基平板上生长。里氏木霉TR在淀粉酶培养基平板、蛋白酶培养基平板及纤维素酶培养基平板上都能生长,且形成晕状圈。

表1 3株菌在平板上的生长情况Tab.1 The growth of three strains on agar plates
由表1可知,回转条件下,As 1398的菌落直径略小于地面1 g重力对照条件;AS 4.412的情况正好相反;而TR在培养第4 d时回转条件下生长稍微快一些,8 d后看不出差异。
实验发现,3株菌均能在p H值6.0~7.9的平板上生长,但 AS 4.412在p H 值6.0、6.5的平板上生长较缓慢,3 d时未见生长,其余平板上3 d时3株菌都已明显生长,6 d时3株菌在p H值6.0~7.9的平板上均生长良好。
2.2 单菌发酵产酶特征
3株菌在液体培养条件下的单菌发酵产酶特征见表2。
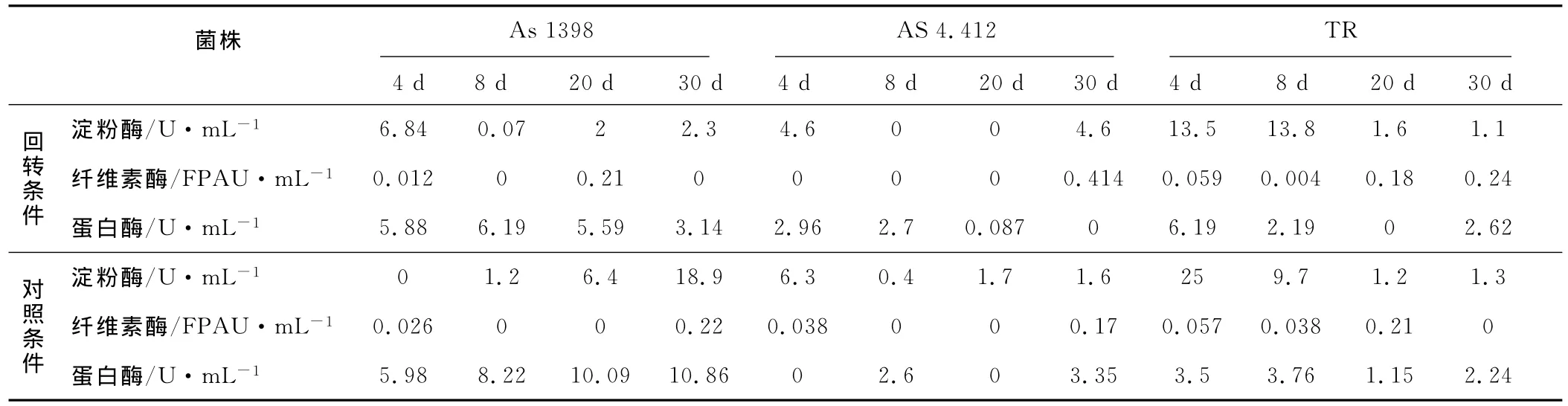
表2 单菌发酵产酶特征Tab.2 Enzyme production of single culture of each strain
由表2可知,枯草芽孢杆菌As 1398在回转条件下的淀粉酶活力、蛋白酶活力都较高,第4 d时分别为6.84 U·m L-1和5.88 U·m L-1;但是和对照条件相比,回转条件下30 d时的酶活力要低得多。链霉菌AS 4.412在回转和对照条件下的淀粉酶活力、蛋白酶活力均较低。虽然如此,由于该菌能够产生一定量的蛋白酶,所以在较难降解蛋白废弃物的处理中仍会有用处。里氏木霉TR在回转条件下维持较低的纤维素酶活力,同时也维持一定的淀粉酶活力和蛋白酶活力。
总之,在两种培养条件下,As 1398和TR均比较稳定地具有三种(或其中的两种)酶活,搭配使用可以满足对可能的淀粉、蛋白、纤维素类有机废弃物的分解。考虑到人类活动中会产生少量的角蛋白类废物,链霉菌AS 4.412的产一定量蛋白酶的能力,使其具有用于降解有机废物中少量角质类蛋白的潜力。
2.3 分步混合发酵产酶特征(表3)
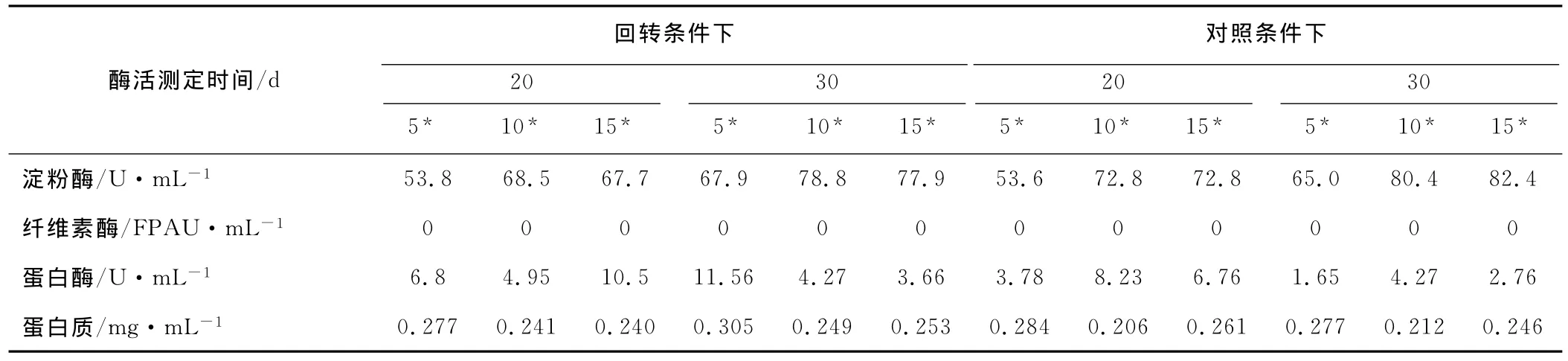
表3 混合发酵产酶特征Tab.3 Enzyme production of mixed culture of three strains
由表3可知,不管是对照条件还是回转条件下,淀粉酶都维持了较高的活力水平;蛋白酶也有较为稳定的持续表达。说明在混合培养体系中,如果有淀粉类和蛋白类的废弃物,微生物产生的酶将具备持续的降解能力。
纤维素酶的情况比较特殊,在混合体系中20 d和30 d时都没有检测到明显的酶活力。对比单菌培养中里氏木霉TR的产酶特点,可能性之一是细菌和放线菌的蛋白酶将纤维素酶水解了,导致纤维素酶活力丧失。为验证这一可能性,取发酵好的纤维素酶液和蛋白酶液按1∶1混合,于28℃放置4.5 h,测定纤维素酶活力。结果发现发酵液中蛋白酶对纤维素酶本身没有显著的降解作用。另一种可能性是3株菌之间存在拮抗作用,以及在培养保温过程中原有酶活力缓慢丧失所致。通过平板对峙实验,发现枯草芽孢杆菌对里氏木霉有显著的拮抗能力(结果未显示),这可能导致混合发酵过程中出现比较复杂的产酶情况,故先单独培养里氏木霉有利于废弃物中纤维素的降解。
2.4 回转发酵后菌株的存活分析
发酵液的平板培养检查表明,单菌培养30 d后各株菌都有生长,说明3种菌单菌回转发酵后都可以较好存活;混合培养30 d后,平板检测发现枯草芽孢杆菌大量生长,基本未见真菌生长,可能原因是真菌受到枯草芽孢杆菌拮抗而无法生长,而放线菌生长缓慢,可能也受到了细菌的抑制。
2.5 讨论
根据文献报道,微生物在微重力条件下某些酶产量出现提高的现象,如淀粉酶、纤维素酶均有效价提高的报道,但都仅限于纯培养菌株的产酶特征。本实验不但检测了回转条件下纯培养的产酶特征,同时检测了混合培养下的产酶特征。尽管本实验是在地面上利用回转器粗略研究微生物产酶特征,但从实验结果来看,不同菌株的产酶特征并不一致,有提高也有降低;同种酶在纯培养条件下的效价与混合培养条件下的效价也存在差别。这表明微生物的产酶特征与培养条件紧密相关,回转条件使微生物的产酶特征出现一定变化。
对地面回转单一因素的产酶特征研究表明,某些微生物的酶产量及混合培养的酶总量高于地面1 g重力对照,这在一定程度上说明在模拟微重力条件下用微生物酶及混合培养总酶处理的应用前景较好,预示着产降解酶的微生物菌株在太空微重力条件下具有潜在的应用价值。另外,针对不同性状的有机废物需采用不同的处理策略:(1)对于主要生活废弃物,其主要残余有机物为淀粉、蛋白等成分,可以直接用细菌和放线菌处理;(2)对于含有少量纤维素但同时含有大量淀粉、蛋白类的废弃物,可采用先用真菌处理,再用细菌和放线菌处理;(3)对于木质纤维素类废弃物(如农业废弃物),可主要采用真菌处理。
3 结论
(1)3株菌在回转条件下的产酶特点:细菌枯草芽孢杆菌As 1398具有较高产淀粉酶和蛋白酶能力;放线菌链霉菌AS 4.412能够产少量的蛋白酶和淀粉酶;丝状真菌里氏木霉TR除了具有一定的产纤维素酶能力外,也能产生一定量的蛋白酶和淀粉酶。
(2)混合培养发酵液中几乎检测不到纤维素酶活力,而能够长时间维持较高的淀粉酶活力和蛋白酶活力。可见本实验条件下混合培养对木霉的生长和产纤维素酶不利。
在未来的太空CELSS应用环境下,由于同时存在微重力及宇宙辐射等多种空间因素,菌株的产酶特征与地面模拟微重力及地面正常重力条件下可能还有差异,菌株的产酶可能还会受到其它因素的影响,这有待利用未来太空搭载试验和我国载人空间站科学实验平台进行深入研究。
[1] 郭双生,尚传勋.国外生命保障系统的概念研究进展[J].航天医学与医学工程,1995,8(1):75-77.
[2] Williams D W,Kull R,Schwartzkopf S H.Anaerobic treatment of organic wastes from controlled ecological life support system[A].SAE Technical Paper Series No.921272,22nd International Conference on Environmental Systems,Seattle,WA,1992.
[3] 王伟,薛小平,杨慧,等.模拟微重力环境对大肠杆菌形态与表面超微结构的影响研究[J].化学与生物工程,2011,28(2):14-17.
[4] 刘桂兰,刘宁,阮继生,等.模拟微重力对链霉菌生长和代谢的影响[A].中国空间科学学会第七次学术年会会议手册及论文集[C],2009.
[5] Rosenzweig Jason A,Abogunde Ohunene,Thomas Kayama,et al.Space flight and modeled microgravity effects on microbial growth and virulence[J].Appl Microbiol Biotechnol,2010,85(4):885-891.
[6] Xie F H,Chao Y P,Yang X Q,et al.Purification and characterization of four keratinases produced byStreptomycessp.strain 16 in native human foot skin medium[J].Bioresource Technology,2010,101(1):344-350.
[7] Wu G H,He R L,Jia W D,et al.Strain improvement and process optimization ofTrichoderma reeseiRUT C30 for enhanced cellulase production[J].Biofuels,2011,2(5):545-555.
[8] 淡家林,徐纯锡,任永娥.软腐芽孢杆菌D20产CGTase的条件和酶性质[J].微生物学报,1988,28(2):136-142.
[9] 钟键,杨敬,钞亚鹏,等.高效酶解中性汽爆玉米秸秆的工艺优化[J].化工学报,2011,62(10):2867-2876.
[10] Bradford M M.A rapid and sensitive method for the quatitation of microgram quatities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1):248-254.
Enzymatic Characteristics of Microbial Fermentation Under Clinostat Rotation
CHAO Ya-peng,YANG Jing,HUANG Bing,HUANG Ying,QIAN Shi-jun
(State Key Laboratory of Transducer Technology,State Key Laboratory of Microbial Resources,Institute of Microbiology,Chinese Academy of Sciences,Beijing100101,China)
Bacillus subtilis,StreptomyceteandTrichoderma reeseiwere selected for production of amylase,proteinase(keratinase)and cellulase under clinostat rotation.It was found that the three strains could grow on plates with in the p H range from 6.0 to 7.9.Bacillus subtilisandStreptomycetemaintained low level of amylase and proteinase,respectively.Trichoderma reeseicould produce all three kinds of enzymes.When mixing the three microbes together as a co-culture,both amylase and proteinase were produced at a high level during 20 d or 30 d under clinostat rotation,while no cellulase was detected.The above results provided possible strategies for the degradation of organic wastes from the life system in the future CELSS.
clinostat rotation;microorganism;amylase;proteinase;cellulase
Q 93
A
1672-5425(2012)11-0013-05
10.3969/j.issn.1672-5425.2012.11.004
中国科学院知识创新工程项目(KJCX2-YW-L08)
2012-08-15
钞亚鹏(1974-),男,山西临县人,博士,副研究员,主要从事工业酶制剂开发应用和酶工程研究;通讯作者:黄英,博士,研究员,E-mail:huangy@im.ac.cn。

