2型糖尿病大鼠肾脏活性氧物质与NO关系的探讨
刘 萍,邱明才,何兰杰
(1.天津医科大学总医院内分泌科 300052;2.宁夏医科大学总医院内分泌科,银川750004)
2型糖尿病大鼠肾脏活性氧物质与NO关系的探讨
刘 萍1#,邱明才1△,何兰杰2
(1.天津医科大学总医院内分泌科 300052;2.宁夏医科大学总医院内分泌科,银川750004)
目的研究糖尿病大鼠肾脏活性氧物质与一氧化氮(NO)系统的关系。方法制备高脂高糖加小剂量链脲佐菌素(35mg/kg)诱导的2型糖尿病大鼠模型。将大鼠分为正常对照组10只和糖尿病组20只;观察糖尿病大鼠肾脏氧化应激状态及NO系统的表达,肾功能改变及抗氧化指标与NO的相关性分析。结果糖尿病大鼠成型12周时SOD,SOD/MDA降低,MDA升高,与正常对照组比较差异有统计学意义;NO、总NOS、iNOS、cNOS均较正常对照组明显升高。肾脏肥大指数、尿微量清蛋白、基质比、肾小球截面积与SOD/MDA呈负相关,与NO、总NOS呈正相关;SOD/MDA与总NOS、NO之间存在负相关。结论
氧化应激,NO均参与糖尿病肾病的发生、发展,它们之间的平衡可能是抗氧化治疗在糖尿病肾病中的关键。
糖尿病肾病;活性氧物质;一氧化氮
糖尿病肾病(DM)是糖尿病常见并发症,活性氧产物(reactive oxygen species,ROS)和一氧化氮(nitric oxide,NO)证实均参与其发生、发展,但抗氧化治疗及NO的变化在糖尿病肾病的研究中仍存在很多争议,现就两者在糖尿病肾病中的关系作一探讨。
1 材料与方法
1.1 实验动物及试剂
1.1.1 动物及饲料 清洁级近交系雄性Sprague-Dawley大鼠,8周龄,体质量180~220g。
1.1.2 试剂 链脲佐菌素(STZ)购自Sigma公司;尿微量白蛋白(mALB)试剂购自Beckman公司,由美国Beckman公司ARRAY 360-Protein System(特种蛋白分析仪)测定。超氧化物歧化酶(SOD)测定试剂购自南京建成生物工程研究所,采用黄嘌呤氧化酶法测定SOD活力,批间CV:3.52%,批内CV:1.7%,回收率:103%;丙二醛(MDA)测定试剂购自南京建成生物工程研究所,采用硫代巴比妥酸缩合法(TAB法),批间CV:4.11%,批内CV:3.5%,回收率:104%。NO试剂盒购自南京建成生物工程研究所,采用硝酸还原酶法,批间CV:5.19%,批内CV:2.0%,回收率:103%;一氧化氮合成酶(nitric oxide synthase,NOS)分型试剂盒购自南京建成生物工程研究所,批间CV:5.95%,批内CV:1.9%,回收率:102%。
1.2 标本收集及检测
1.2.1 分组与收集标本 将SD大鼠随机分为对照组10只(常规饲料喂养),实验组20只(高脂高糖饲料喂养)。高脂高糖喂养8周后,实验组大鼠空腹腹腔注射STZ 35mg/kg(以pH 4.4,0.1mmol/L枸橼酸缓冲液配制成20g/L浓度);对照组仅注射等容积的枸橼酸缓冲液。注射STZ后1周,用微量血糖仪(罗氏公司提供)监测大鼠尾尖血糖,以血糖大于7.8 mmol/L作为糖尿病成型标准。于糖尿病成型12周时处死大鼠进行标本收集。
1.2.2 仪器 尿微量清蛋白(mALB)由美国Beckman公司ARRAY 360-Protein System(特种蛋白分析仪)测定。
1.2.3 肾脏指标检测 制备肾脏组织匀浆,测定肾脏SOD、MDA含量、NO、总 NOS、iNOS、cNOS含量。
1.2.4 肾脏组织病理检查 取右侧肾脏,去除肾包膜,4℃生理盐水充分洗涤,滤纸吸去表面水分,称重。相对肾重(也称肾肥大指数,肾重/体质量)。于4℃生理盐水玻璃器皿中将肾脏自肾门冠状面纵行剖开,存放于10%中性甲醛液中固定,常温避光保存,行普通病理HE染色及PAS染色,应用北航CMIAS多功能真彩色病理图像分析系统中的肾小球分析模块进行肾小球面积及肾小球基质比的分析。
1.3 统计学处理 应用SPSS11.0统计软件进行数据处理分析。所有计量资料均以±s表示。两组资料比较采用t检验,以P<0.05为差异有统计学意义。各指标的相关性分析采用多因素相关回归分析。
2 结 果
2.1 糖尿病大鼠肾脏氧化应激状态的观察 STZ注射糖尿病大鼠成型12周时,SOD、SOD/MDA均较正常对照组降低,MDA升高,见表1。
2.2 糖尿病大鼠肾脏NO系统的观察 STZ注射糖尿病大鼠成型12周时,实验组肾脏NO、总NOS、iNOS、cNOS均较正常对照组明显升高(表2)。
2.3 糖尿病大鼠肾脏功能及形态学定量分析的观察 STZ注射糖尿病大鼠成型12周时实验组肾肥大指数、尿微量清蛋白、肾小球截面积、肾小球基质面积均较正常对照组明显增高(表3)。
表1 两组大鼠肾脏氧化应激状态的比较(±s)
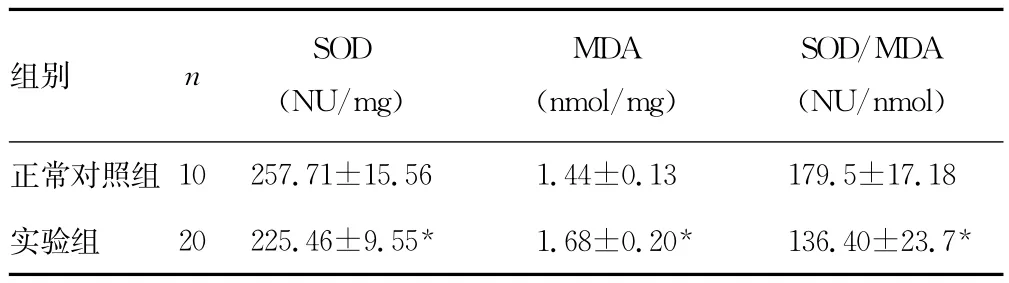
表1 两组大鼠肾脏氧化应激状态的比较(±s)
*:P<0.01,与正常组比较。
组别nSOD(NU/mg)MDA(nmol/mg)SOD/MDA(NU/nmol)正常对照组10 257.71±15.56 1.44±0.13 179.5±17.18实验组 20 225.46±9.55*1.68±0.20*136.40±23.7*
表2 两组大鼠肾脏NO、NOS的比较(±s)
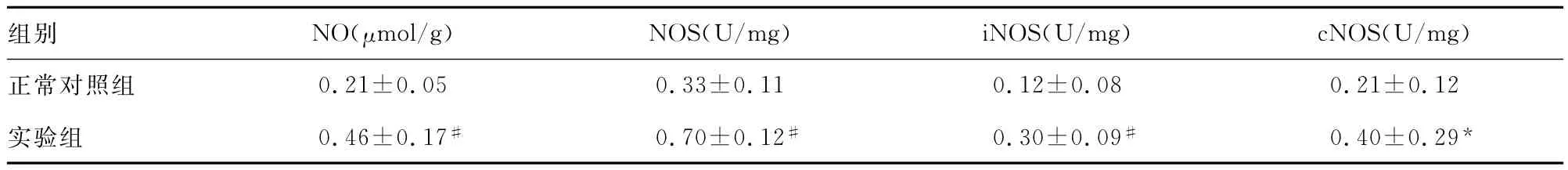
表2 两组大鼠肾脏NO、NOS的比较(±s)
*:P<0.05,#:P<0.01,与正常对照组相比。
组别 NO(μmol/g) NOS(U/mg) iNOS(U/mg) cNOS(U/mg)正常对照组0.21±0.05 0.33±0.11 0.12±0.08 0.21±0.12实验组 0.46±0.17#0.70±0.12#0.30±0.09#0.40±0.29*
±s)表3 两组大鼠肾脏功能及形态学定量比较(

±s)表3 两组大鼠肾脏功能及形态学定量比较(
*:P<0.01,与正常对照组比较。
组别 肾肥大指数(mg/g) 尿mALB(mg/L) 肾小球截面积(μm2) 肾小球基质面积(μm2)正常对照组 3.37±0.26 2.23±0.50 6 058.94±327.36 1 876.16±164.46实验组 5.47±0.67*8.45±2.80*10 422.13±1 001.51*4 502.09±471.94*
2.4 肾脏影响因素 肾脏肥大指数、尿微量清蛋白、基质比、肾小球截面积与SOD/MDA呈负相关,与NO、总NOS呈正相关;SOD/MDA与总NOS、NO之间呈负相关(表4)。
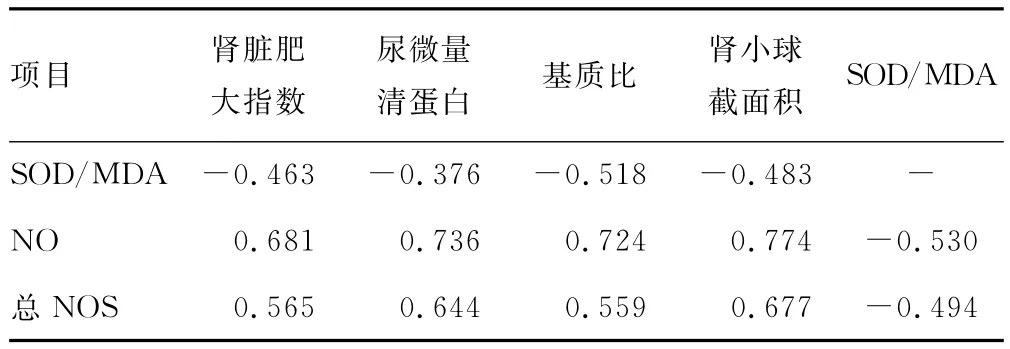
表4 肾脏影响因素相关性分析
3 讨 论
氧化应激是指ROS超出局部的抗氧化能力所表现的细胞毒作用,对蛋白质、脂肪和核酸均具有损害作用[1]。糖尿病时以糖代谢紊乱为主的多种因素介导的氧自由基产生过多在机体各组织中均有反应。肾组织中的氧化/还原平衡状态被破坏,造成肾脏氧化应激反应[2-3]。Hiroki等[4]研究表明糖尿病大鼠肾脏SOD1、SOD3的表达下调在糖尿病肾病的发病中起重要作用。本实验结果显示糖尿病成型12周时SOD明显降低,MDA升高,SOD/MDA降低,与正常大鼠相比存在显著性差异,说明糖尿病大鼠肾脏存在氧化应激。肾脏抗氧化能力与肾功能指标相关性分析表明SOD/MDA与mALB、肾肥大指数、基质比、肾小球截面积呈显著负相关,进一步证明氧化应激参与了糖尿病肾病的发生、发展。
NO是一种具有广泛生理活性的旁分泌调节剂,在血管收缩、抗血栓形成、细胞调控、神经介质传递、信号转导、炎症反应过程中发挥重要作用。NO产生于L-精氨酸(L-Arg)的末端,反应需要NOS的催化。NOS有3种亚型,即神经元型NOS(ncNOS)、内皮型 NOS(ecNOS)和诱导型 NOS(iNOS)。ec-NOS和ncNOS合称为结构型NOS(cNOS),为Ca2+/钙调素依赖性在生理状态下催化生成少量NO,主要参与中枢或外周对血管的舒张调节作用。iNOS为非Ca2+依赖性,(尽管在Ca2+存在的情况下也能增强iNOS活性),在病理情况下当受到内毒素和某些细胞因子的刺激时能诱导生成大量NO,参与炎症反应过程[5-6]。NO作为较强的血管舒张因子在血流动力学方面已作了大量的研究,然而学者们在对NO与糖尿病肾病的关系探讨中却得到很多相互矛盾的结论.有学者报道糖尿病肾病患者肾脏内皮型NOS表达增高,从而NO活性是被激活的,参与了肾小球高滤过状态及系膜基质的增生[7-8]。而Ishii等[9]和Tessari等[10]却得到糖尿病肾病时NOS的表达是下降的结论。Atul等[11]学者也对高脂喂养2周再注射小剂量STZ后6周的糖尿病大鼠进行研究表明,大鼠体内的NO水平是降低的,而且是通过影响解偶联的内皮型NOS的作用来实现的。Radko和Anderson[12]通过对大量研究结果的荟萃分析提出:体内实验得出NO升高或下降的结论与所观察的DM的特定时期有关,NO升高者多处于DM早期,而NO下降者则多表现在DM的晚期,进而推断DM内皮源性舒张功能紊乱随糖尿病病程而改变,表现为初期升高-中期代偿性正常-晚期下降的趋势。本实验表明高脂高糖加STZ诱导糖尿病大鼠12周时,肾脏总NOS、iNOS、cNOS及NO较正常组均明显增高,总NOS、NO与mALB、肾肥大指数、基质比、肾小球截面积呈正相关。结合尿mALB、肾脏形态学改变判定糖尿病大鼠12周时,尚处于糖尿病肾病早中期,仍以肾脏高血流量、高滤过为主,与NO,NOS的表达相一致,证明NOS、NO参与了糖尿病肾病早期的发病,且iNOS、cNOS均参与了NO的生成。随着病程的发展,可能会出现Radko和Anderson[12]总结的NO双相调节机制。
高血糖诱导ROS的产生,ROS能够激活NOS产生NO,同时解偶联的NOS在生成NO的时候,也产生超氧阴离子,因此解偶联的NOS是糖尿病血管ROS产生的重要来源,加重氧化应激状态[13]。当局部NO浓度升高又可与周围的氧自由基等反应而生成活性氮族(reactive nitrogen species,RNS),此反应速度极快,且反应不可逆,只要两者相遇即可生成ONOO-,速度是超氧歧化酶的6倍,NO是ROS强大的清除剂,与此同时NO的水平也是下降的,因此RNS和ROS的生成和清除是重叠的,且彼此是互相调节的[14-15]。本实验显示SOD/MDA与总NOS、NO之间存在负相关提示肾脏抗氧化能力减低与NOS、NO有关。这可能与不同生理病理状态下二者之间的代谢平衡有关。
很多动物实验证实抗氧化治疗对心脑血管疾病有效,但大多人体实验研究效果并不令人满意[16]。ROS和NO虽然在糖尿病肾病可作为独立的发病因素存在,两者之间也有着密切的联系,但其作用效果仍不清楚,分析其原因可能是多因素效应不能均衡的结果。不仅仅是ROS和NO之间的平衡,更是肾脏细胞内氧化状态和抗氧化状态的平衡,有待于进一步探讨。
[1]Josephine M,Coughlan MT,Cooper ME.Oxidative stress as a major culprit in kidney disease in diabetes[J].Diabetes,2008,57(6):1446-1454.
[2]Lee SH,Nam BY,Kang EW,et al.Effects of an oral adsorbent on oxidative stress and fibronectin expression in experimental diabetic nephropath[J].Nephrol Dial Transplant,2010,25(7):2134-2141.
[3]Evans JL,Goldfine ID,Maddux BA,et al.Oxidative stress and stress-activated signaling pathways:a unifying hypothesis of type 2diabetes[J].Endocr Rev,2002,23:599-622.
[4]Hiroki F,Hiromi F,Shinsuke C,et al.Reduction of renal superoxide dismutase in progressive diabetic nephropathy[J].JASN,2009,20(6):1303-1313.
[5]Ulrich F,William C.Sessa nitric oxide synthases:regulation and function[J].Eur Heart,2011,9(10):1093-1098.
[6]Ducsay CA,Myers DA.eNOS activation and NO function:differential control of steroidogenesis by nitric oxide and its adaptation with hypoxia[J].J Endocrinol,2011,210:259-269.
[7]Bernd H,Christian PM,Birgit H,et al.Analysis of NO-synthase expression and clinical risk factors in human diabetic nephropathy[J].Nephrol Dial Transplant,2008,23(4):1346-1354.
[8]Hostetter TH.Hyperfiltration and glomerulosclerosis[J].Semin Nephrol,2003,23(2):194-199.
[9]Ishii N,Patel KP,Lane PH,et al.Nitric oxide synthesis and oxidative stress in the renal cortex of rats with diabetes mellitus[J].J Am Soc Nephrol,2001,12:1630-1639.
[10]Tessari P,Cecchet D,Cosma A,et al.Nitric oxide synthesis is reduced in subjects with type 2diabetes and nephropathy[J].Diabetes,2010,59(9):2152-2159.
[11]Atul A,Harlokesh NY,Sharma PL.Involvement of vascular endothelial nitric oxide synthase in development of experimental diabetic nephropathy in rats[J].Mol Cell Bioch,2011,354(1-2):57-66.
[12]Radko K,Anderson S.Paradoxes of nitric oxide in the diabetic kidney[J].Am J Physiol Renal Physiol,2003,284(6):1121-1137.
[13]Satoh M,Fujimoto S,Haruna Y,et al.NAD(P)H oxidase and uncoupled nitric oxide synthase are major sources of glomerular superoxide in rats with experimental diabetic nephropathy[J].Am J Physiol Renal Physiol,2005,288:1144-1152.
[14]Nava B,Julia K,Hilla O,et al.Positive and negative regulation of insulin signaling by reactive oxygen and nitrogen species[J].Physiol Rev,2009,89(1):27-71.
[15]Bedrad K,Krause KH.The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J].Physiol Rev,2007,87(2):245-313.
[16]Schürks M,Glynn RJ,Rist PM,et al.Effects of vitamin E on stroke subtypes:meta-analysis of randomised controlled trials[J].BMJ,2010,341(11):c5702-5709.
The relation between the reactive oxygen species and nitric oxide of diabetic nephropathy in type 2 diabetic rats
LiuPing1#,QiuMingcai1△,HeLanjie2
(1.DepartmentofEndocrinology,GeneralHospitalofTianjingMedicalUniversity,Tianjing300052,China;2.DepartmentofEndocrinology,AffiliatedHospitalofNingxiaMedicalUniversity,Yinchuan,Ningxia750004,China)
ObjectiveTo study the relation between the reactive oxygen species and nitric oxide(NO)of diabetic nephropathy in type 2diabetic rats.MethodsMaking type 2diabetic rats by high-sucrose-high-fat diet with a low dose of STZ(35mg/kg)injecting into abdominal cavity.The rats divided into control group(n=10)and diabetic group(n=20).The expression of oxidative stress and Nitric Oxide system in diabetic nephropathy were observed and the correlation of oxidative index,Nitric Oxide and renal function was analyzed.ResultsIn diabetic rats,SOD,SOD/MDA were reduced in comparison with control group while MDA was increased.NO,Total NOS,iNOS,cNOS were elevated in diabetic group;the kidney weight/body weight,urine microalbumin,mean glomerular area,mean mesangial matrix area/mean glomerular area ratio negatively correlated with SOD/MDA,while positively correlated with NO,total NOS;SOD/MDA negatively correlated with NO,total NOS.ConclusionThe oxidative stress and NO participate in the diabetic nephropathy,the balance is the key point that the treatment of antioxidant in the diabetic nephropathy probably.
diabetic nephropathy;reactive oxygen species;nitric oxide
10.3969/j.issn.1671-8348.2012.23.017
A
1671-8348(2012)23-2389-03
#该作者就职于宁夏医科大学总医院内分泌科,现为天津医科大学内分泌专业在读博士。△ 通讯作者,Tel:13512019540;E-mail:mingcaiqiu@vip.sina.com。
2011-11-07
2012-02-16)

