高效液相色谱法分析北方部分地区蜂胶醇提物成分
赵亮亮,王光新,陈 平,董 捷,张红城,*
(1.哈尔滨商业大学食品学院,黑龙江 哈尔滨 150076;2.中国农业科学院蜜蜂研究所,北京 100093)
高效液相色谱法分析北方部分地区蜂胶醇提物成分
赵亮亮1,2,王光新2,陈 平1,董 捷2,张红城2,*
(1.哈尔滨商业大学食品学院,黑龙江 哈尔滨 150076;2.中国农业科学院蜜蜂研究所,北京 100093)
研究北方部分地区的蜂胶提取物中组分含量的差异并对成分分析。采用乙醇水溶液对中国北方11个省市的蜂胶进行提取,以NaNO2-Al(NO3)3比色法和Folin-Ciocalteu试剂比色法分别测定蜂胶不同提取物的总黄酮和总酚酸含量;并且借助标准品以高效液相色谱法对不同提取物中的酚类化合物进行初步定性和定量,进而模拟蜂胶的区域性。结果表明:不同地区的蜂胶含有的总黄酮和总酚酸不同,其中咖啡酸、坎非醇、松属素、柯因、高良姜素、苯甲酰肉桂酯以河南蜂胶含量最高;芹菜素、异鼠李素以辽宁蜂胶含量最多;山东蜂胶含有最多的鼠李素。关键词:蜂胶提取物;高效液相色谱;成分分析
蜂胶是蜜蜂从植物芽胞或树干采集的树胶,混入蜜蜂的上额腺、蜂蜡而形成的芳香性树脂状固体物质[1]。蜂胶中含有丰富的生物活性成分,具有广泛的生理和药理活性。但是不同地区甚至相同地区的蜂胶所含有的活性成分都有所差异,这主要是由于蜜蜂所采集的胶原植物不同所导致的。巴西蜂胶中富含萜类化合物和p-香豆酸异戊烯基衍生物;而在中国大陆及欧洲,蜂胶的主要成分是多酚类物质,其中包括酚酸和黄酮类物质[2]。而一般用于分析植物及其相关产品中的酚酸和黄酮类物质的方法有很多,比较常用的是高效液相色谱(high performance liquid chromatography,HPLC)[3-4]。同时还可以串联质谱进行物质的结构分析,这就使得这种方法在物质检测和分析方面得到了很快的发展。
在中国,由于地理条件的关系,国内蜂胶的成分相当复杂。目前国家的行业标准,主要是检测蜂胶中的8种黄酮,但是由于地域和胶源植物的差异,蜂胶的成分变化很大,例如8种黄酮中的芦丁就只存在很小部分蜂胶中,并且含量很少。而且蜂胶的主要活性成分不仅仅是黄酮,还有酚酸和酚酸酯类,这些成分发挥着抗氧化、抗炎、抗癌等作用。然而目前的国家行业标准,没有体现出这些生理活性物质。因此,通过检测蜂胶中8种黄酮含量已无法完全满足蜂胶质量评价和假胶鉴别要求[5]。
本实验以北方11个省市所采集的蜂胶为原料,采用超声波辅助乙醇水溶液法进行提取,之后利用HPLC检测蜂胶提取物中的黄酮类和酚酸类物质,并通过聚类分析试图反映出蜂胶的地域具有可追溯性。通过这些实验可以更加有效的评价中国蜂胶及其相关产品的质量,对于实际生产具有重要指导意义。
1 材料与方法
1.1 材料与试剂
黑龙江、吉林、辽宁、北京、河北、山东、河南、陕西、安徽、湖北、甘肃11个地区的蜂胶原胶分别由当地蜂农采集,由中国农业科学院蜜蜂研究所提供,粉碎后冻存;3,4-二羟基苯甲酸、4-羟基苯甲酸、香草酸、咖啡酸、香兰素、p-香豆酸、阿魏酸、3-羟基-4-甲氧基肉桂酸、苯甲酸、3,4-二甲氧基肉桂酸、肉桂醇、杨梅酮、桑色素、肉桂酸、山奈酚、异鼠李素、芹菜素、鼠李素、松属素、短叶松素、柯因、咖啡酸苯乙酯、高良姜素、苯甲酰肉桂酯、芦丁、槲皮素、木犀草素、柚皮素、黄岑素、花旗松素、染料木素、没食子酸(以上均为色谱纯)、Folin-Ciocalteu试剂 美国Sigma公司;甲醇(CR) 美国Fisher公司。
1.2 仪器与设备
WK-600A高速粉碎机 青州市精诚医药装备制造有限公司;AL204型分析天平 梅特勒-托利多(上海)仪器有限公司;Milli-Q Intergral纯水/超纯水一体化系统 美国Merk Millipore公司;KQ-50DB型数控超声波清洗器昆山市超声仪器有限公司;微量移液器 德国Eppendorf公司;UV-2100型紫外-可见分光光度计 UNICO(上海)仪器有限公司;HZS-H型水浴摇床 哈尔滨市东明医疗仪器厂;SY21-K型电热恒温水浴锅 北京长风仪器仪表公司;LGJ-12真空冷冻干燥机 北京松源华兴科技发展有限公司; LC-6AD高效液相色谱仪(配有二极管阵列紫外检测器(PDA)、CTO-10A柱温箱、SIL-自动进样器、LCsolution数据处理系统) 日本岛津公司; RE-2000A旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 蜂胶提取物的制备
准确称取10g已粉碎的各地区蜂胶,置于500mL已称质量的具塞锥形瓶中,分别加入200mL 75%乙醇溶液。40℃、100r/min水浴摇床中提取48h,每12h取出锥形瓶并置于超声波清洗器中,超声1h,共超声4次。提取结束后,离心收集蜂胶不同提取液。旋转蒸发浓缩后进行真空冷冻干燥,得到的固体提取物冻存备用。
1.3.2 标准对照品溶液配制
准确称取一定量的3,4-二羟基苯甲酸、4-羟基苯甲酸、香草酸、咖啡酸、香兰素、p-香豆酸、阿魏酸、3-羟基-4-甲氧基肉桂酸、苯甲酸、3,4-二甲氧基肉桂酸、肉桂醇、杨梅酮、桑色素、坎非醇、异鼠李素、芹菜素、鼠李素、松属素、柯因、咖啡酸苯乙酯、高良姜素、苯甲酰肉桂酯,将其配成一定质量浓度的标准品储备液。根据各种标准品的出峰时间及强度,进行相应的混合,混合后标准品的浓度在0.1~0.8mg/mL。利用混合标准品工作液进行定性和定量分析。
1.3.3 样品中总多酚含量的测定[6]
标准曲线的建立:精确称取0.005g没食子酸,蒸馏水定容50mL,该标准质量浓度0.1mg/mL。准确量取上述标准液0.0、0.2、0.4、0.6、0.8、1.0、1.2mL置于10mL容量瓶中,各加入6mL蒸馏水,摇匀,再加入0.5mL 2mol/mL福林酚试剂,充分摇匀。1min之后加入1.5mL碳酸钠溶液(20g /100mL),混匀定容,放置10min后在765nm处测定其吸光度,绘制标准曲线。样品测定时根据不同蜂胶提取物的质量浓度不同取样量也不同,但吸光度选取在0.2~0.8之间。样品中总多酚用原胶中没食子酸质量计算。
1.3.4 样品中总黄酮含量的测定[7]
标准曲线建立:精确称量0.01g芦丁标准品,用60%乙醇溶液溶解,定容至100mL容量瓶中,得到质量浓度0.1mg/mL标准溶液。准确吸取标准溶液0、5、7、9、10、12mL置于25mL容量瓶中,加水补到12mL,摇匀,再加入5% NaNO2溶液1mL充分摇匀;放置6min之后加入10% Al(NO3)3溶液1mL摇匀;放置6min之后加入4.3% NaOH溶液10mL,充分摇匀,最后用60%乙醇溶液定容至25mL放置15min后,在波长510nm处测定其吸光度,绘制标准曲线。样品测定时根据不同蜂胶提取物的质量浓度不同取样量也不同,但吸光度选取在0.2~0.8之间。样品中总黄酮用原胶中芦丁质量计算。
1.3.5 HPLC分析条件[8]
Shim-Pack PREP-ODS(250mm×4.6mm,5μm)色谱柱;流动相:甲醇-水(含0.1%乙酸溶液);流速:1.0mL/min;检测温度35℃;检测波长280nm;进样量10μL;所用的梯度洗脱程序如下:0~10min、18%~28%甲醇溶液,10~35min、28%~38%甲醇溶液,35~58min、38%~50%甲醇溶液,58~70min、50%~55%甲醇溶液,70~85min、55%~59%甲醇溶液,85~95min、59%~62%甲醇溶液,95~105min、62%~70%甲醇溶液,105~120min、70%~75%甲醇溶液,120~140min、75%甲醇溶液。
1.3.6 样品中成分的初步定性
按照相同的色谱条件,分别对标准品混合物和不同地区的蜂胶提取液进行液相色谱分析。根据样品中各个组分的保留时间和标准品的保留时间是否重合进行初步定性,然后进一步根据二极管阵列检测器所得到的紫外光谱的形状,吸收带以及最大吸收波长与标准品的紫外光谱相比较,进行样品定性分析。
1.3.7 样品中各组分定量
将1.3.2节配制的混合对照品溶液,按1.3.5节色谱条件,分别以1、5、10、15、20、2 5μL进样量,依次进样分析。以对照品的进样量(X)/(μg/L)对峰面积(Y)进行线性回归分析。由标准曲线分别计算出各个产地蜂胶中各组分的含量。
1.3.8 数据处理
利用Excel绘制各对照品标准曲线,获得线性回归方程及相关系数;采用SPSS 13.0软件对数据进行方差分析,分别比较总酚和总黄酮含量在不同提取物之间的显著性差异,P<0.05有统计学意义。利用Alphasoft软件进行蜂胶区域性的聚类分析。
2 结果与分析
2.1 不同地区的蜂胶提取物中的总多酚和总黄酮含量

表1 不同地区蜂胶提取物的总多酚、总黄酮含量Table 1 Total polyphenol and total flavonoid contents in propolis extracts from different areas
从表1可知,不同地区蜂胶中的总酚酸和总黄酮含量不同,其中每克原胶的总酚酸含量范围为81.19~199.69mg;总黄酮为139.55~368.06mg。其中河北地区的蜂胶提取物中总多酚含量最高,为(199.69±0.56)mg/g,而总黄酮含量最高的是陕西蜂胶提取物,为(368.06± 1.35)mg/g,但是通过数据分析可以看出,河北蜂胶中的黄酮含量和陕西蜂胶之间并没有显著差异,因而单从总体的活性成分上看,河北地区蜂胶可能是最好的,而吉林、安徽及湖北等地区的蜂胶相对较差。
不同地区蜂胶中的总多酚和总黄酮含量不同,主要与当地饲养的蜜蜂种类和蜂胶的胶原植物有关。总体含量与Ahn等[9]报道的中国和欧洲蜂胶中的总多酚和总黄酮含量相比差异不大。当然即使活性成分含量较少的吉林和安徽等地的蜂胶提取物,也比其他一些天然产物中的多酚含量要高,如龙眼(27.4mg/g)[10]。
2.2 液相色谱条件的确定
液相色谱的最佳条件是以相邻的两种物质可以明显分开为最佳,因此本实验进行多种流动相的选取。有机相从甲醇和乙腈中筛选,实验结果发现,甲醇流动相基线和物质的分离情况更好,这可能是由于甲醇的水溶性和非极性相对较好。对于水相流动,通过添加一定的酸性物质进去,可以有效增加物质的溶解,阻止部分酚酸类和黄酮类物质的解离而出现挂柱,导致目标物质出现拖尾的现象。在水相中加入的酸性物质主要从磷酸、乙酸和甲酸3种物质中筛选。结果发现,添加酸性物质后,目标化合物拖尾现象明显减少,且分离效果和峰型都得到了明显改善,其中磷酸和乙酸效果最好,但考虑到所用的色谱柱子是反相色谱柱,同时有机相为甲醇,易使磷酸类物质结晶吸附在色谱柱上,对色谱柱产生一定的影响;并且在做质谱分析检测时不能使用磷酸,所以本实验选取乙酸作为酸性剂。
为了能够获得最佳的分离效果和最高的效率,对于酸性条件进行了筛选,发现0.2%和0.1%(V/V)的乙酸-水对峰型效果最好,但是考虑柱子耐受酸性程度,本实验最终选择0.1%(V/V)的乙酸-水为水相流动相。对于检测波长来说,多酚类物质的最大吸收波长主要在280nm和350nm处,实验结果显示,在280nm处的紫外光谱吸收,较多的物质能够被检测出来,且基线相对比较平稳,所以本实验选取280nm作为检测波长。
实验开始阶段,首先进行等浓度洗脱,但是分离效果不好,这可能是由于蜂胶中的活性成分比较复杂,难以在一个浓度条件获得相对较好的分离效果,之后参考了一些文献[8,11-12]选择了梯度分离,并进一步探索,得到一个相对较好的分离效果,所用分离条件如下:流动相:甲醇-水(含0.1%乙酸);流速:1.0mL/min;检测温度35℃;检测波长280nm;进样量10μL;所用梯度洗脱程序如下:0~10min、 18%~28%甲醇,10~35min、28%~38%甲醇,35~58min、38%~50%甲醇,58~70min、50%~55% 甲醇,70~85min、55%~59%甲醇,85~95min、59%~62%甲醇,95~105min、62%~70% 甲醇,105~120min、70%~75%甲醇,120~140min、75%甲醇。
2.3 中国北部地区蜂胶成分分析
首先进行单个标准品的分析,通过相对保留时间和紫外光谱进行相应定性分析,将样品中含有且相对能够分开的标准物质进一步混合,得到了最终 23种物质的混合物。标准品混合物液相图谱见图1。
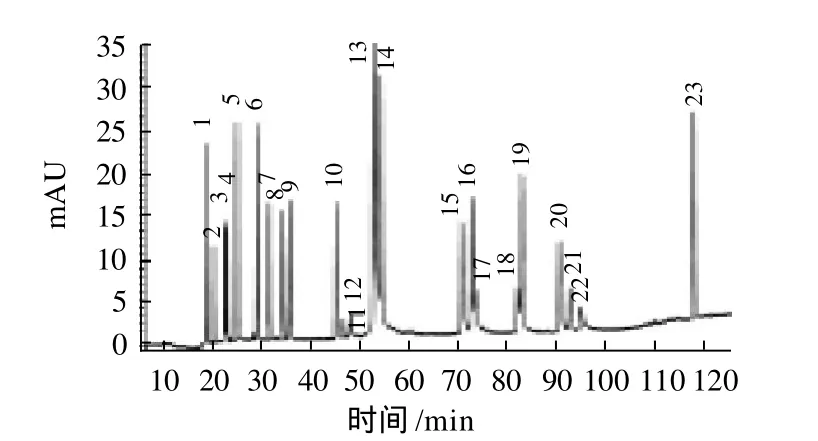
图1 标准品HPLC图谱Fig.1 HPLC chromatogram of mixed individual compound standards

图2 不同地区蜂胶的HPLC图谱比较Fig.2 Comparison of HPLC chromatogram fingerprints of propolis extracts from different areas

表2 不同地区蜂胶中各组分含量Table 2 Contents of individual components in propolis extracts from different areas
由图2可知,各地的蜂胶提取物的主要成分多数集中在75~100min之间,在75min之前和100min之后蜂胶的成分含量较低。根据实验结果,75min之前多为酚酸类物质,而在75~100min之间的多数是黄酮类物质,而100min之后可能是酯类物质。其中从液相图谱的峰数可以看出,河南蜂胶提取物所含有的成分种类较多。结合表2可以看出,河北、黑龙江和河南蜂胶的成分种类最多,且以酚酸和黄酮类物质为主要成分。酚酸以咖啡酸和p-香豆酸最为普遍且含量也相对最多,其中河南蜂胶中咖啡酸含量最多,为11.18mg/g,而黑龙江蜂胶中p-香豆酸含量最多,为13.18mg/g。从表2可以看出,按照目前国家标准规定检测蜂胶中的8种黄酮,其中坎非醇、芹菜素、松属素、柯因、高良姜素最为普遍。在11种蜂胶中河南蜂胶的坎非醇、松属素、柯因以及高良姜素最多,辽宁蜂胶中的芹菜素含量最大,分别为3.84、53.44、63.67、40.35、6.72mg/g。国家标准中规定的蜂胶中的8种黄酮类物质,只有这5种黄酮类物质普遍的存在于北方不同地区的蜂胶中,而杨梅酮存在的范围较小且含量也相对较低;在所测的11个产地蜂胶中芦丁、桑色素均未检测到,这表明简单的以这8种黄酮类物质来作为中国蜂胶的产品质量标准存在缺陷。除了上述5种黄酮,还检测出鼠李素和异鼠李素,且含量也相对较高,其中山东蜂胶中鼠李素含量为10.73mg/g,辽宁蜂胶中异鼠李素含量为7.87mg/g。相比而言,酚酸类物质中咖啡酸和p-香豆酸普遍存在于所测的11个产地中,且含量也相对较高,此外苯甲酰肉桂酯和咖啡酸苯乙酯也比较普遍存在于所测定蜂胶中。因此在进一步增加检测样品量的基础上,建议在修订国家行业标准时,删除芦丁、桑色素和杨梅黄酮的检测,增加鼠李素和异鼠李素,以及咖啡酸、p-香豆酸和咖啡酸苯乙酯的检测。该结论为进一步完善中国蜂胶的质量标准提供一定理论支持。
由于不同地区的植物有着较大的区别,而蜂胶的成分主要依靠蜜蜂所采集的胶原植物的种类不同而有所不同,甚至同一地区的蜂胶,其所含有的化学成分都有着不同,使得蜂胶的植物来源性很难确定。Ahn等[9]研究发现中国蜂胶的主要成分是柯因、高良姜素、松属素、短叶松素,这与杨树胶的主要成分相同。同时从本实验测定结果来看,所测定地区的蜂胶中都含有相对较高的柯因、高良姜素、松属素和鼠李素含量,表明这些地区的蜂胶植物源性与杨树可能有着较大的关系。此外,有些研究者还发现,中国、欧洲等北半球国家的蜂胶组成成分都与杨树胶或其渗出液有着一定的相似性[13-15],但是由于中国蜂胶主要以酚酸和黄酮类物质为主,所以一些黄酮类物质含量要高于欧洲一些国家,如柯因含量要高于保加利亚蜂胶(8.4mg/g)[2,16]。然而,Volpi等[17]研究结果却显示中国蜂胶中不含有坎非醇和柯因,这可能是由于所使用的分析方法不同,以及选用的蜂胶产地不同。
2.4 不同地区蜂胶的HPLC聚类分析
图3是利用Alphasoft软件,将HPLC检测到的所有峰进行聚类分析得到的结果,它比单纯的利用某几个特定物质峰进行分析得到的结果更可靠,能更加全面的反应各地区蜂胶中的成分,进而有效的对蜂胶的区域源性进行分析。从图3可知,河南和陕西蜂胶的主要成分具有很大的相似性,这表明这两地的蜂胶的胶原植物具有一定的相似性;河北、山东和辽宁地区的蜂胶具有一定的相似性;但是北京地区的蜂胶成分却与河北蜂胶有着很大的不同,这主要是由于胶原植物和采集时间不同所导致的,即使是同一地区的蜂胶其成分含量上也有着很大的不同,如北京市海淀区和门头沟区的蜂胶成分[18]。 同样,研究发现安徽、湖北、黑龙江、吉林以及甘肃这些地区的蜂胶,在模拟分析中有很大的相似性。虽然这些地区在地里位置上离的相对较远,但胶原植物可能具有很大的相似性,使得这些地区的蜂胶具有很大的相似性。从以上实验结果可以看出,蜂胶的区域性不可以简单的以蜂胶的产地来划分,而应以蜂胶所含有的组成成分来进行分析确定。

图3 中国不同地区蜂胶相似度分析Fig.3 Similarity comparison of propolis samples from different areas
3 结 论
利用乙醇溶液对11个地区的蜂胶进行提取,测定其总多酚和总黄酮的含量,结果表明它们之间差别很大,其中河北地区的蜂胶提取物含有的总多酚含量最高,而总黄酮含量最高的是陕西蜂胶提取物,但在P<0.05条件下,河北蜂胶中的黄酮含量和陕西的蜂胶之间并没有显著差异,相比较而言,吉林、安徽及湖北等地区的蜂胶含量相对较低,因此,单从总体的活性成分上看,河北蜂胶可能是最好的。
通过HPLC对蜂胶中有效成分进行定性和定量。结果显示,蜂胶的主要成分是酚酸和黄酮类物质,此外还含有一些酯类和其他物质。酚酸中以咖啡酸和p-香豆酸最为普遍且含量也相对最多,其中河南和黑龙江的含量最多;黄酮以坎非醇、芹菜素,松属素、柯因、高良姜素最为普遍,其中河南蜂胶提取物中含有坎非醇、松属素、柯因以及高良姜素,辽宁蜂胶提取物中含有的芹菜素最大;酯类方面苯甲酰肉桂酯和咖啡酸苯乙酰酯较为普遍。这种方法为开发蜂胶保健功能食品和药理学研究提供了理论基础。
本实验利用Alphasoft软件对蜂胶的全组分进行了聚类分析,根据HPLC图谱比较分析,可以发现河南和陕西蜂胶所含的成分种类最多,而北京和安徽等地的蜂胶成分种类含量相对较少。从实验初步鉴定的成分含量上看,河南、河北和北京相对较多,其他省份相对较少。区域性分析结果显示,河南和陕西具有很大的相似性,河北、山东和辽宁地区的蜂胶具有一定的相似性,安徽、湖北、黑龙江、吉林以及甘肃这些地区的蜂胶相似度较大,而北京地区的蜂胶与上述蜂胶相似度相对较小,这可能是由于所产胶的地域、季节、树种、蜂种的差异所导致的。这也表明蜂胶的区域性不能够简单的以地理位置划分,而应以蜂胶的所含有的组成成分进行分析确定。这为建立全国的蜂胶液相指纹图谱打下一定基础。
[1] 董捷, 张红城, 尹策, 等. 蜂胶研究的最新进展[J]. 食品科学, 2007, 28(9): 639-642.
[2] CHEN Chianan, WENG Mengshih, WU Chiali, et al. Comparison of radical scavenging activity, cytotoxic effects and apoptosis induction in human melanoma cell by taiwan propolis different source[J]. Evidence-Based Complementary and Alternative Medicine, 2004, 1(2): 175-185.
[3] ZHANG Yu, BAO Bili, LU Boyi, et al. Determination of flavone C-glucosides in antioxidant of bamboo leaves (AOB) fortified foods by reversed-phase high-performance liquid chromatography with ultraviolet diode array detection[J]. Journal of Chromatography A, 2005, 1065: 177-185.
[4] BOUE S M, CARTER-WIENTJES C H, SHIH B Y, et al. Identification of flavone aglycones and glycosides in soybean pods by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2003, 991(1): 61-68.
[5] ZHOU Jinhui, LI Yi, ZHAO Jing, et al. Geographical traceability of propolis by high-performance liquid-chromatography fingerprints [J]. Food Chemistry, 2008, 108(2): 749-759.
[6] 张红城, 董捷, 李慧, 等. 六种蜂花粉多酚和黄酮类物质含量测定及抗氧化性的研究[J]. 食品科学, 2007, 28(9): 500-504.
[7] 董捷, 张红城, 秦健, 等. 十种蜂花粉醇提物中总多酚和总黄酮含量测定[J]. 食品科学, 2008, 29(12): 246-249.
[8] HROBONOVA K, LEHOTAY J, CIZMARIK J. Determination of organic acid in propolis by HPLC using two columns with an on-line SPE system[J]. Journal of Liquid Chromatography and Related Technologies, 2009, 32(1): 125-135.
[9] AHN M R, KUMAZAWA S, USUI Y, et al. Antioxidant activity and constituents of propolis collected in various areas of China[J]. Food Chemistry, 2007, 101(4): 1383-1392.
[10] HE Ning, WANG Zhiyuan, YANG Cuixian, et al. Isolation and identification of polyphenolic compounds in longan pericarp[J]. Separation and Purification Technology, 2009, 70(2): 219-224.
[11] 陈磊, 黄雪松. 高效液相色谱法同时检测黄酒中的5-羟甲基糠醛和9种多酚[J]. 分析化学研究简报, 2010, 38(1): 133-137.
[12] WANG Dongmei, LU Jiali, MIAO Aiqing, et al. HPLC-DAD-ESI-MS/ MS analysis of polyphenols and purine alkaloids in leaves of 22 tea cultivars in China[J]. Journal of Food Composition and Analysis, 2008, 21(5): 361-369.
[13] GARCIA-VIGUERA C, FERRERES F, TOMAS-BARBERAN F A. Study of Canadian propolis by GC-MS and HPLC[J]. Zeitschrift fur Naturforschung C: A Journal of Biosciences, 1993, 48(5/6): 731-735.
[14] MACIEJEWICZ W, DANIEWSKI M, DZIDO T H, et al. GC-MS and HPLC analysis of phenolic acids extracted from propolis and fromPopulus nigrabud exudates[J]. Chemistry Analysis (Warsaw), 2002, 47(1): 21-30.
[15] VARDAR-UNLU G, SILICI S, UNLU M. Composition andin vitroantimicrobial activity of populus buds and polar-type proplis[J]. Chemistry and Materials Science, 2008, 24(7): 1011-1017.
[16] BANKOVA V, POPOVA M, BOGDANOV S, et al. Chemical composition of European propolis: expected and unexpected results[J]. Zeitschrift fur Naturforschung C: A Journal of Biosciences, 2002, 57(5/6): 530-533.
[17] VOLPI N, BERGONZINI G. Analysis of flavonoids from propolis by on-line HPLC-electrospray mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 42(3): 354-361.
[18] MEDANA C, CARBONE F, AIGOTTI R, et al. Selective analysis of phenolic compounds in propolis by HPLC-MS/MS[J]. Phytochemical Analysis, 2008, 19(1): 32-39.
Composition Analysis in Ethanol Extracts of Propolis Samples from Northern China
ZHAO Liang-liang1,2,WANG Guang-xin2,CHEN Ping1,DONG Jie2,ZHANG Hong-cheng2,*
(1. College of Food Science, Harbin University of Commerce, Harbin 150076, China;2. Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China)
The purpose of this study was to compare the contents of total phenols, total flavonoids and individual components in ethanol extracts of propolis samples collected from Northern China (Beijing and 10 provinces). The content of total flavonoids and total phenols were determined by NaNO2-Al(NO3)3 method and Folin-Ciocalteau method, respectively. Quantitative and qualitative HPLC analysis of phenols in propolis extracts was carried out by comparison with standard references for geographic cluster analysis of propolis samples. The results showed that the contents of total flavonoids and total phenols of propolis samples varied with geographic origin. The highest contents of caffeic acid, kaempferol, pinocembrin, chrysin, galangin and benzyl cinnamate were found in propolis samples from Henan province; propolis samples from Liaoning province were the richest in apigenin and isorhamnetin; propolis samples from Shandong province showed the highest content of rhamnetin.
propolis extract;HPLC;composition analysis
S896
A
1002-6630(2012)18-0143-06
2012-04-17
“十二五”国家科技支撑计划项目(2011BAD33B04);国家蜂产业技术体系资助项目(CARS-45-KXJ18)
赵亮亮(1988—),男,硕士研究生,研究方向为食品科学。E-mail:zll.3678@163.com
*通信作者:张红城(1967—),男,副研究员,博士,研究方向为食品生物技术。E-mail:zzhc@sohu.com

