喹诺酮类药物作用的生理和遗传的分子机制
马好
·综述·
喹诺酮类药物作用的生理和遗传的分子机制
马好
现阶段,应用较为广泛的一种广谱抗生素便是氟喹诺酮类药物,在世界的抗生素类的药物市场上它占了大概18%的比重。氟喹诺酮类药物不仅能够迅速的杀菌,同时还有一个规模较大的衍生物库,为药物的换代更新创造了有利条件。然而,此类衍生物在代谢的过程、杀菌速度方面对蛋白合成的依赖性及对氧的需求各不相同。根据药物作用之后细菌分子遗传层面所表现出来的应答特点我们能够分析出不同的衍生物的深层次的作用体制,能够为研制疗效更好的新型的喹诺酮类药物创造条件。活性氧簇、染色体的片段化、细菌程序性的死亡、霉素-抗霉素的系统及SOS应答等新的机制在某种程度上参与了喹诺酮类药物杀菌的过程。笔者在本文中着重分析了喹诺酮作用的“二步特征”。引入这一特征不仅能够更好的理解各种喹诺酮类药物所具有的杀菌特点,同时还有利于新型喹诺酮类药物的研发。
喹诺酮类药物;遗传;分子机制
现阶段,应用较为广泛的一种广谱抗生素便是氟喹诺酮类药物,氟喹诺酮类药物不仅能够迅速的杀菌,同时还有一个规模较大的衍生物库,为药物的换代更新创造了有利条件。各代的喹诺酮类药物在细菌方面的杀伤体制是互不相同的:在低氧或者是蛋白质的合成停滞的情况下,第一代的喹诺酮类药物(萘啶酸)是不具备杀菌的功能的,但像莫西沙星等新一代的氟喹诺酮类药物的杀菌功能却不受制于上述这两种条件。尽管,喹诺酮类的药物均会在细菌Ⅱ型拓扑异构酶上发生作用,然而杀菌的途径或许会由于修饰基团各异。笔者分析了喹诺酮类的药物所具有的深层次的作用机制,得出喹诺酮类的药物存在特征各异两个作用阶段。这或许是各喹诺酮类的药物有着不同的杀菌效果的药动学方面的原因。
1 喹诺酮类药物主要的靶点
细菌的两种Ⅱ型拓扑异构酶是喹诺酮类药物主要的靶点。对原核生物而言,Ⅱ型拓扑异构酶借助于负超螺旋的引入使调节DNA拓扑结构的功能得以实现[1]。除古菌的拓扑异构酶Ⅳ,别的Ⅱ型拓扑异构酶均为ⅡA型拓扑异构酶,存在蛋白结构与一级结构上的同源性,然而作用却各异。topoisomeraseⅣ(拓扑异构酶Ⅳ)与DNA gyrase(DNA解旋酶)是细菌基因组一般编码的ⅡA型拓扑异构酶的两种类型。喹诺酮类药物主要靶向细菌的两种Ⅱ型拓扑异构酶,借助于对酶催化反应的干扰来达到杀菌的目的。
2 各代喹诺酮类药物和细胞致死的不同途径
喹诺酮类药物有一个庞大的衍生物库[2],下图1反映了其典型的几种结构。各喹诺酮类药物在杀菌方面的特点各异,杀伤效果因厌氧条件与氯霉素等条件的不同而不同,且不同的喹诺酮类药物有不同的杀菌途径。
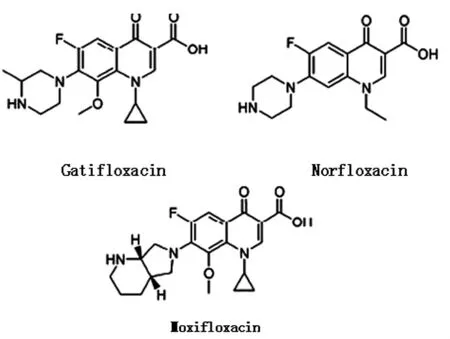
图1 典型的几种喹诺酮类药物的化学结构
3 断裂复合体和喹诺酮类药物的杀菌作用
3.1 断裂复合体的形成 拓扑异构酶Ⅳ或者DNA解旋酶引发了DNA的双链断裂,同时共价结合至断裂的 DNA 5'端[3],酶-DNA复合物由此形成。喹诺酮类药物能够和酶-DNA复合物快速结合,在结合之后,DNA缓慢的断裂。我们也能够理解为喹诺酮类药物把Ⅱ型拓扑异构酶牢牢的套在了DNA上,断裂复合体得以形成。
4 染色体的片段化和细菌的快速死亡
4.1 染色体的片段化 在整个染色体上散布着断裂复合体,DNA片段因其在断裂复合体里的释放会产生出染色体片段,且使细菌死亡。该假设起初的证据是源于关于染色体超螺旋的研究。所以染色体的片段化和细胞的死亡存在一种极为直接的关系。
4.2 断裂复合体的去稳定化介导喹诺酮类药物迅速的消灭细菌 染色体的片段化或许是借助于“自杀因子”对断裂复合体进行攻击的,断裂DNA在被释放之后,引发了细菌染色体的片段化,细菌因此被消灭。对于喹诺酮类药物而言,其主要具有两种不同的快速杀伤体制:一种无需蛋白质合成;另一种则是需要蛋白质合成的。
5 活性氧簇和喹诺酮致死功能的放大
诺氟沙星有着较为复杂的致死作用。有研究者通过致死途径单一的奥索利酸对活性氧簇的功能进行了分析。硫脲或2,2'-联吡啶严重制约了奥索利酸的致死活性,然而其是无法影响染色体的片段化的,仅有氯霉素给喹诺酮类药物所造成的杀菌作用的抑制是借助于对染色体片段化的制约得以完成的。且喹诺酮类药物所具有的杀菌过程存在不同的两种途径,此种借助于解旋酶亚基解离引发的致死活性和因活性氧簇的产生而获得的杀菌活性相互独立。
6 小结
根据对相关研究的分析,我们发现:喹诺酮类药物介导的细菌快速死亡的直接原因并不是对细菌DNA的复制。喹诺酮的致死作用包括两阶段性:第一阶段为形成断裂复合体,对细菌DNA的复制进行抑制,引发SOS反应,借助于部分次级损伤来消灭细菌细胞。去垢剂的应用能够让业已形成的断裂复合体逐渐的向正常状态恢复,抑菌状态由此解除。第二个阶段为断裂的DNA借助于某种方式由断裂复合体里释放,大量染色体的片段得以形成,以此来杀灭细菌。笔者实验室专注于对断裂复合体稳定的蛋白破坏的研究,即与氟喹诺酮类药物能够迅速杀菌有关联的蛋白。这将在很大程度上有助于对断裂复合体释放其所包含的断裂DNA片段问题的分析研究,为改良氟喹诺酮类药物的工作创造了条件。
[1] 谢建平,何颖.喹诺酮类药物作用的生理和遗传的分子机制.中国疗养医学,2005,1(2):23-24.
[2] 刘云刚,李丽.基因突变与结核分支杆菌对喹诺酮类药物耐药性的研究进展.中国防痨杂志,2004,1(1):33-35.
[3] 孙云辉,王云凯.喹诺酮类药物的不良反应研究进展.四川生理科学杂志,2003,4(1):8-9.
454000焦作煤业(集团)有限责任公司中央医院
3.2 断裂复合体对DNA复制的抑制 断裂复合体的形成过程会对合成DNA的过程产生抑制。在喹诺酮靶点给DNA解旋酶的情况下,当药物和靶点结合之后便能迅速的抑制DNA的合成。断裂复合体与复制叉间的冲突是抑制DNA合成的主要原因。然而,喹诺酮类药物在快速抑制合成DNA的方面存在可逆性。

