c-Met在食管鳞状细胞癌组织中的表达及其与临床病理的相关性
刘春涛 朱圣韬 田 月 张澍田
(首都医科大学附属北京友谊医院消化内科北京市消化疾病中心,北京 100050)
我国是食管癌的高发国家,每年约有25万新诊断的食管癌病例,占世界食管癌病例数的一半。与欧美国家不同,我国食管癌的组织学类型以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主。虽然近年来食管鳞癌的诊治水平有了显著提高,但大多数病例发现时已处于进展期,抗癌治疗的效果较差。因此,到目前为止我国仍是世界上食管癌发病率和病死率最高的国家[1]。
c-Met是肝细胞生长因子(hepatocyte growth factor,HGF)的受体,位于细胞表面,与HGF结合后可以导致下游多种信号转导通路的激活,如Erk、Akt和Stat3等,从而促进肿瘤细胞的侵袭与迁移[2]。既往研究[3-5]发现,c-Met在结肠癌、头颈部鳞癌、肺癌等多种肿瘤组织中过表达,并与肿瘤的侵袭、转移及预后相关。然而,目前关于c-Met在食管鳞癌中的表达情况及其在食管鳞癌发生及转移中的作用少有报道。
本研究以87例食管鳞癌标本及配对癌旁组织作为研究对象,采用免疫组织化学法检测c-Met的表达,阐明其与食管鳞癌临床病理特点的相关性,并进一步探讨c-Met作为食管鳞癌治疗靶点的可能性。
1 材料与方法
1.1 研究对象
87对甲醛固定,石蜡包埋的食管鳞状细胞癌及配对的癌旁组织标本取自首都医科大学附属北京友谊医院病理科。手术时间为2008年至2011年,其中男性标本73例,女性标本14例,患者年龄41~81岁。有淋巴结转移的病例占47.1%(41/87)。所有病例均经病理证实。同时收集患者的临床资料。肿瘤分期根据国际抗癌联盟食管鳞癌临床病理分期(tumornode-metastasis,TNM)分期标准(第 7 版)确定[6]。所有病例术前均未接受化学治疗或放射治疗。
1.2 试剂
兔抗人c-Met单克隆抗体购自美国CST公司。二步法抗兔/鼠通用型免疫组化检测试剂盒购自基因科技(上海)有限公司。
1.3 免疫组织化学染色及阳性结果判断
烤片、二甲苯脱蜡及梯度乙醇脱水,PBS缓冲液洗3次,每次5 min;3%H2O2(80%甲醇)阻断内源性过氧化酶活性;抗原高压热修复10 min,抗原修复液为0.01 mol/L柠檬酸盐缓冲液;滴加兔抗人c-Met单克隆抗体IgG(1∶100),室温孵育2 h,PBS溶液漂洗3次,每次5 min;滴加100 μL A液(二步法抗兔/鼠通用型免疫组化检测试剂盒),室温孵育30 min,PBS溶液漂洗3次,每次5 min;最后滴加显色剂DAB工作液,光镜下控制显色,显色完全后,用蒸馏水冲洗终止显色;苏木精复染细胞核,中性树胶封片;显微镜下观察,以细胞膜呈棕黄色作为阳性判定标准。
1.4 统计学方法
采用SPSS 13.0软件进行统计分析。采用Pearson χ2检验检测c-Met的表达与食管鳞癌患者临床病理特征的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 c-Met在食管鳞癌及癌旁组织中的表达
c-Met主要表达于细胞膜,表现为胞膜呈棕黄色染色。87例食管鳞癌组织中有29例(33.3%)呈阳性表达,配对癌旁组织中未见c-Met表达(图1)。
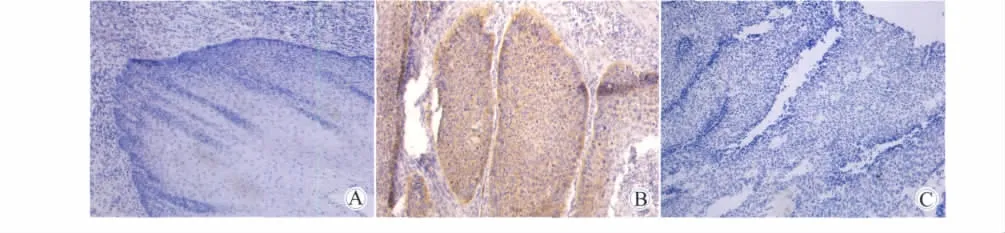
图1 c-Met在食管鳞癌及癌旁食管复层鳞状上皮中的表达Fig.1 c-Met expression in esophageal squamous cell carcinoma and normal esophageal tissues(200×)
2.2 c-Met与食管鳞癌临床病理特征的关系
本研究分析了c-Met的表达与食管鳞状细胞癌患者临床病理参数的相关性。结果表明,c-Met的高表达与食管鳞状细胞癌患者的肿瘤浸润深度、淋巴结转移及TNM分期存在显著相关性(分别为 P=0.017,P=0.000,P=0.000),而与患者的性别、年龄、肿瘤细胞分化程度、肿瘤大小等无明显相关性(P>0.05),详见表1。
3 讨论
肝细胞生长因子(hepatocyte growth factor,HGF)主要由成纤维细胞等间质细胞分泌。HGF与肿瘤细胞表面的c-Met受体结合后可以导致c-Met在Y1234和Y1235位点发生磷酸化,进而导致下游多种信号转导通路的激活,如Erk、Akt和Stat3等,从而促进肿瘤细胞的侵袭与迁移。既往研究[2]发现,c-Met及HGF在多种肿瘤组织中过表达,并与肿瘤的侵袭、转移及预后相关。Kammula U S等[3]检测了60例结肠癌组织中c-Met和HGF mRNA水平的表达,结果提示c-Met和HGF的过表达与结肠癌淋巴结及远处转移相关,并能影响患者预后。Nakamura Y等[4]检测了130例肺腺癌组织中c-Met的表达,结果提示c-Met的过表达能通过配体依赖性和非配体依赖性2种途径导致c-Met的活化,进而影响肿瘤的组织学类型和分化程度。Seiwert T Y等[5-6]分析了121例头颈部鳞癌组织中c-Met的表达,发现c-Met在84%的头颈部鳞癌组织中呈过表达,而c-Met抑制剂可以阻断c-Met活化所导致的细胞增生、迁移及血管生成等生物学活性。Kim C H等[7]通过免疫组化技术检测了61例舌鳞状细胞癌组织中HGF和c-Met的表达,结果发现其阳性率分别为57.3%和54.1%,c-Met的表达与肿瘤分型、淋巴结转移、复发以及患者的生存期显著相关,因此认为c-Met能够影响舌鳞状细胞癌的进展及患者的预后。Yamamoto S等[8]通过免疫组化检测了90例卵巢透明细胞癌组织中c-Met的表达,发现c-Met在22%的肿瘤组织中呈过表达,并且c-Met的表达情况是患者生存期的独立预测因素。可见,c-Met过表达在多种肿瘤组织中普遍存在,并与肿瘤的侵袭、转移及预后相关。

表1 c-Met的表达与食管鳞状细胞癌患者临床病理参数的相关性Tab.1 c-Met expression and its correlation with clinicopathological characteristics
最近的研究[6-8]发现,肿瘤的细胞外基质所形成的微环境对食管鳞癌的生长和转移具有重要作用,基质中的肿瘤相关性成纤维细胞能够影响肿瘤的发生和进展。Grugan K D等[9]通过一个模拟体内的三维器官型培养模型证实,肿瘤相关性成纤维细胞能够通过分泌HGF促进食管鳞癌细胞向基质中的侵袭。另外,Ren Y等[10]通过ELISA检测了149例食管鳞癌患者的血清HGF浓度,结果发现食管鳞癌患者治疗前的血清HGF浓度显著高于对照组,并且与肿瘤的转移及患者生存期相关,多变量分析提示血清HGF水平是细胞侵袭的独立预测因子。这些研究均提示HGF/c-Met信号通路在食管鳞癌的发生及转移中发挥重要作用。然而,目前关于c-Met在食管鳞癌中的表达情况及其在食管鳞癌发生及转移中的作用少有报道。本研究采用免疫组化技术检测了c-Met在87例食管鳞癌组织标本中的表达情况,并进一步分析了c-Met的过表达与食管鳞癌临床病理特点的相关性。c-Met在33.3%的食管鳞癌组织中呈阳性表达,c-Met的高表达与食管鳞状细胞癌患者的肿瘤浸润深度、淋巴结转移及TNM分期存在显著相关性,而与患者的性别、年龄、肿瘤细胞分化程度、肿瘤大小等无明显相关性。这一结果提示,c-Met的高表达可以作为高侵袭性食管鳞癌的分子标志物。
HGF/c-Met信号通路在多种肿瘤的发生和侵袭中均发挥关键作用,而阻断HGF/c-Met可以抑制肿瘤细胞的增生和转移,因此,以c-Met为治疗靶点已成为目前肿瘤治疗研究中的热点。Yoo B K等[11]对肝细胞癌的研究发现,c-Met抑制剂可以阻断晚期转录因子SV40所介导的裸鼠成瘤和转移,提出c-Met抑制剂可能成为肝细胞癌的新的治疗措施。Xu H等[12]的研究发现,联合应用c-Met抑制剂PF2341066和EGFR抑制剂吉非替尼可以显著抑制头颈部鳞癌细胞的增生和转移,效果优于2种药物的单独应用,这一结果提示c-Met和EGFR的联合阻断可能成为头颈部鳞癌的新的治疗措施。Syed Z A等[13]通过体外及体内试验证实,阻断HGF/c-Met/Stat3信号通路可以抑制皮肤鳞状细胞癌的侵袭。Lau P C等[14]对鼻咽癌的体外研究发现,小分子酪氨酸激酶抑制剂PHA665752可以抑制c-Met的激活,从而抑制鼻咽癌细胞的生长、迁移和侵袭。另外,Arriola E等[15]对小细胞肺癌的研究也发现,PHA665752可以阻断HGF介导的c-Met磷酸化,从而抑制细胞增生和侵袭。迄今为止,关于阻断HGF/c-Met信号通路对食管鳞癌生长及侵袭的研究尚未见报道,对这一问题的深入研究有望为食管鳞癌的治疗找到新的靶点。
总之,本研究报道了HGF的受体c-Met在食管鳞癌组织中的表达情况,发现c-Met在部分食管鳞癌组织中呈高表达,且c-Met异常表达率增高与患者的肿瘤浸润深度、淋巴结转移及TNM分期存在显著相关性。这一结果提示,c-Met的高表达可以作为高侵袭性食管鳞癌的分子标志物,c-Met有望成为食管鳞癌的新的治疗靶点。
[1]Enzinger P C,Mayer R J.Esophageal cancer[J].N Engl J Med,2003,349(23):2241-2252.
[2]Trusolino L,Bertotti A,Comoglio P M.MET signalling:principles and functions in development,organ regeneration and cancer[J].Nat Rev Mol Cell Biol,2010,11(12):834-848.
[3]Kammula U S,Kuntz E J,Francone T D,et al.Molecular co-expression of the c-Met oncogene and hepatocyte growth factor in primary colon cancer predicts tumor stage and clinical outcome[J].Cancer Lett,2007,248(2):219-228.
[4]Nakamura Y,Niki T,Goto A,et al.c-Met activation in lung adenocarcinoma tissues:an immunohistochemical analysis[J].Cancer Sci,2007,98(7):1006-1013.
[5]Seiwert T Y,Jagadeeswaran R,Faoro L,et al.The MET receptor tyrosine kinase is a potential novel therapeutic target for head and neck squamous cell carcinoma[J].Cancer Res,2009,69(7):3021-3031.
[6]方文涛.第7版国际抗癌联盟食管鳞癌TNM分期解读[J].上海交通大学学报(医学版),2011,31(3):265-270.
[7]Kim C H,Koh Y W,Han J H,et al.c-Met expression as an indicator of survival outcome in patients with oral tongue carcinoma[J].Head Neck,2010,32(12):1655-1664.
[8]Yamamoto S,Tsuda H,Miyai K,et al.Gene amplification and protein overexpression of MET are common events in ovarian clear-cell adenocarcinoma:their roles in tumor progression and prognostication of the patient[J].Mod Pathol,2011,24(8):1146-1155.
[9]Grugan K D,Miller C G,Yao Y,et al.Fibroblast-secreted hepatocyte growth factor plays a functional role in esophageal squamous cell carcinoma invasion[J].Proc Natl Acad Sci U S A,2010,107(24):11026-11031.
[10]Ren Y,Cao B,Law S,et al.Hepatocyte growth factor promotes cancer cell migration and angiogenic factors expression:a prognostic marker of human esophageal squamous cell carcinomas[J].Clin Cancer Res,2005,11(17):6190-6197.
[11]Yoo B K,Gredler R,Chen D,et al.c-Met activation through a novel pathway involving osteopontin mediates oncogenesis by the transcription factor LSF[J].J Hepatol,2011,55(6):1317-1324.
[12]Xu H,Stabile L P,Gubish C T,et al.Dual blockade of EGFR and c-Met abrogates redundant signaling and proliferation in head and neck carcinoma cells[J].Clin Cancer Res,2011,17(13):4425-4438.
[13]Syed Z A,Yin W,Hughes K,et al.HGF/c-Met/Stat3 signaling during skin tumor cell invasion:indications for a positive feedback loop[J].BMC Cancer,2011,11:180.
[14]Lau P C,Wong E Y.Targeting MET by tyrosine kinase inhibitor suppresses growth and invasion of nasopharyngeal carcinoma cell lines[J].Pathol Oncol Res,2011,25[Epub ahead of print].
[15]Arriola E,Canadas I,Arumi-Uria M,et al.MET phosphorylation predicts poor outcome in small cell lung carcinoma and its inhibition blocks HGF-induced effects in MET mutant cell lines[J].Br J Cancer,2011,105(6):814-823.

