细菌16SrRNA基因PCR诊断细菌性阴道病的研究
吕 治 彭国丽 苏建荣*
(1.首都医科大学附属北京友谊医院检验中心,北京 100050;2.北京市公安医院医疗技术处,北京 100121)
细菌性阴道病(bacterial vaginosis,BV)是阴道细菌生态平衡被打破,占优势的乳酸杆菌减少而阴道加德纳菌、厌氧菌大量繁殖,导致搔痒、分泌物增多并带鱼腥臭味的临床综合征。细菌性阴道病的病因尚不清楚,目前认为是多种微生物共同作用的结果。BV相关微生物包括:阴道加德纳菌、阴道阿托波菌、动弯杆菌及人型支原体等。这些细菌多为厌氧菌或苛氧菌,常规分离培养较困难。细菌16SrRNA基因PCR技术在临床微生物和感染性疾病病原体鉴定的广泛应用为确定BV及建立BV的分子诊断方法提供了可能[1]。
本研究采用细菌16SrRNA基因特异性引物PCR对阴道分泌物标本中的2种乳酸杆菌:卷曲乳酸杆菌(lactobacillus crispatus)、惰性乳酸杆菌(lactobacillus iners)和9种BV相关条件致病菌:阴道加德纳菌(gardnerella vaginalis)、阴道阿托波菌(atopobium vaginae)、纤毛菌属(leptotrichia sp)、巨球菌属(megasphaera sp)、羞怯动弯杆菌(mobiluncus mulieris)、柯氏动弯杆菌(mobiluncus curtisii)、人型支原体(mycoplasma hominis)、脆弱拟杆菌(bacteroides fragilis)、普雷沃菌属(prevotella sp)进行检测。通过对两组标本中细菌分离率的比较,确定BV主要角色菌,建立BV的分子诊断方法。
1 材料与方法
1.1 研究对象
BV组91例,为北京友谊医院、北京市房山区妇幼保健院、北京市朝阳妇幼保健院就诊的育龄期妇女,年龄18~45岁,除外淋球菌、梅毒等性传播疾病及真菌、滴虫等特异性阴道感染性疾病。按照临床诊断BV的Amsel标准的4项内容检查:分泌物外观、pH值、胺试验、线索细胞。4项中有3项阳性诊断为BV。健康对照组82例为健康体检的育龄期妇女,除外细菌性、滴虫性、真菌性阴道疾病,除外梅毒、淋病等性传播疾病。
1.2 标本采集
用无菌棉拭子在患者阴道壁下1/3处采集分泌物,放入无菌试管中立即送检。
1.3 试剂
细菌基因组DNA试剂盒(Bacterial DNA Kit),OMEGA公司产品。琼脂糖,北京赛百盛基因技术有限公司产品。PCR Taq Mix,广州东盛生物科技有限公司产品。2×PCR TaqMix的组分:100 mmol/L KCl,20 mmol/L Tris-HCl,3 mmol/L MgCl2,400 mmol/L dNTP混合物,0.1 U/μL Taq DNA 聚合酶,溴酚蓝等。
1.4 仪器
ABI7300PCR分析仪(美国ABI公司)、DYY-10C型电泳仪(北京六一仪器厂)、BIO-RAD凝胶成像系统(美国BIO-RAD公司)。
1.5 细菌基因组DNA提取
棉拭子在PBS缓冲液中振荡悬浮,12 000 r/min离心5 min,收集菌体沉淀。按照DNA提取试剂盒说明书提取细菌基因组DNA,-70℃冷冻保存。
1.6 细菌特异性16SrRNA基因PCR检测
25 μL 反应体系,包括引物各 1 μL(10 μmol/L)、TaqMix 12.5 μL、模板 2 μL,超纯水补足体积。PCR引物序列、反应条件及产物片段见表1。
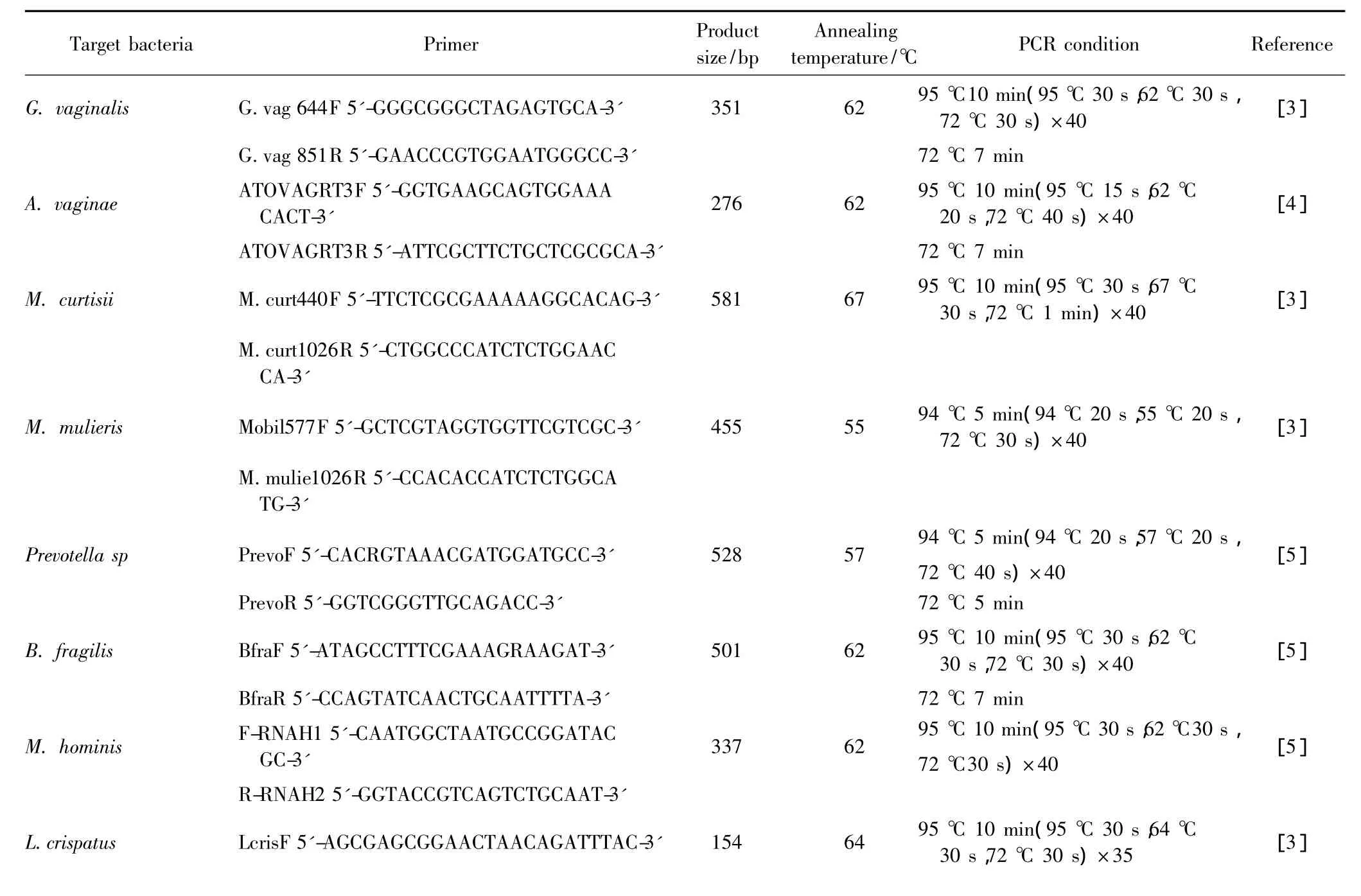
表1 细菌特异性16SrRNA基因PCR引物序列、反应条件及产物片段Tab.1 Bacteria targets,primers,and PCR conditions for each bacterium-specific 16SrRNA PCR assay

L.crispatus:Lactobacillus crispatus;L.iners:Lactobacillus iners;G.vaginalis:Gardnerella vaginalis;A.vaginae:Atopobium vaginae;Leptotrichia/Sneathia spp:Leptotrichia/Sneathia spp;Megasphaera sp:Megasphaera sp;M.mulieris:Mobiluncus mulieris;M.curtisii:Mobiluncus curtisii;M.hominis:Mycoplasma hominis;B.fragilis:Bacteroides fragilis;Prevotella sp:Prevotella sp.
1.7 产物分析
扩增产物在2%琼脂糖凝胶中(含0.15 mg/L溴化乙啶)100 V电压电泳30~40 min,全自动凝胶图像分析系统显像观察。符合片段大小的PCR阳性产物经切胶回收纯化后由上海英峻生物技术有限公司进行DNA测序。测序结果通过BLAST与Gene Bank比对。
1.8 统计学方法
数据采用SPSS11.5软件进行统计分析。以P<0.05为差异有统计学意义。
2 结果
11种细菌16SrRNA基因PCR检测:在82份健康对照组标本中,分离率最高的3种细菌是卷曲乳酸杆菌61.0%(50/82)、惰性乳酸杆菌52.4%(43/82)、阴道加德纳菌45.1%(37/82),而91份BV患者标本中,分离率居前3位的细菌分别是,阴道加德纳菌属63.7%(58/91)、普雷沃菌属63.7%(58/91)、阴道阿托波菌属51.6%(47/91)。说明BV患者阴道菌群构成发生了显著变化,作为阴道主要优势菌的乳酸菌大量耗竭,厌氧菌、阴道加德纳菌过度繁殖,详见表1。
通过对2组标本11种细菌分离率的比较显示,一些苛养细菌或非培养细菌与BV的发生密切相关。这些细菌用常规培养方法很难分离,采用PCR方法检测阴道阿托波菌属,纤毛菌属,巨球菌属,羞怯动弯杆菌属,以阳性检测结果作为BV诊断指标时,其诊断特异性分别为 85.4%、93.9%、95.1%、91.4%。
以表2中差别具有统计学意义的阴道阿托波菌属、羞怯动弯杆菌属、普雷沃菌属、纤毛菌属、巨球菌属选择3种细菌进行组合。以任意1种细菌阳性作为BV诊断指标,以3者均阴性为排除指标,与临床诊断标准进行比较评价见表3。结果显示:联合检测阴道阿托波菌属、普雷沃菌属、纤毛菌属,特异性为93.41%,敏感性为 78.05%,OR=50.37,是 PCR 方法诊断BV的较理想方案。
卷曲乳酸杆菌是正常阴道菌群的主要优势菌,是产生过氧化氢的主要细菌,对于维持阴道微生态平衡,抑制病原微生物生长繁殖起着关键作用。该菌在健康组的分离率为61.0%(50/82),在BV患者卷曲乳酸杆菌大量耗竭,分离率42.9%(39/91),2组比较差异有统计学意义(P<0.05)。显示卷曲乳酸杆菌与BV呈负相关 (OR=0.480)。惰性乳酸杆菌是另一种在阴道中分离率较高的乳酸杆菌,PCR检测结果显示在BV组(38.5%)和健康组(52.4%)均有较高的分离率,但2组标本的分离率的差异无统计学意义(P >0.05)。
阴道加德纳菌可在63.7%的 BV患者标本和45.1%的健康对照标本中分离到。尽管2组分离率的差异具有统计学意义(P<0.05),但是由于其对BV诊断的特异性较差,单独对该菌进行定性检测尚不能作为判断BV的理想指标。
动弯杆菌属的柯氏动弯杆菌和羞怯动弯杆菌是一种厌氧、革兰染色不定的苛养小杆菌。动弯杆菌属的柯氏动弯杆菌和羞怯动弯杆菌在BV组的分离率分别为28.6%和41.8%,敏感性较差;但诊断特异性较高,分别为 85.3%和 91.5%。
人型支原体、脆弱拟杆菌、惰性乳酸杆菌在BV组和健康组的分离率差异无统计学意义(P>0.05)。11种阴道细菌2%琼脂糖凝胶电泳见图1;健康组、BV组细菌分离率比较见表2。

图1 11种阴道细菌PCR产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoretic profile of 11 Vaginal Bacteria PCR products
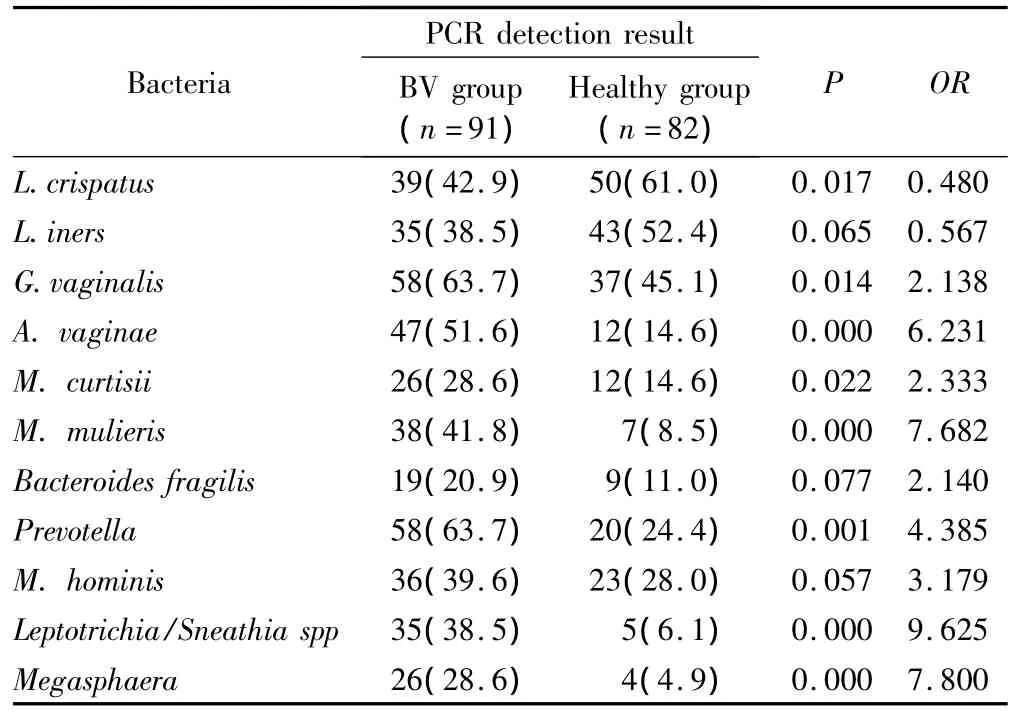
表2 BV组、健康组11种阴道细菌PCR检测结果Tab.2 11 Bacterial PCR results between BV group and healthy group n(%)

表3 不同细菌检测组合诊断BV价值评价Tab.3 Evaluation of different bacteria combination in diagnosis of BV n(%)
3 讨论
本研究采用16SrRNA基因细菌特异性PCR技术对阴道分泌物标本中的11种与BV关系密切的细菌进行检测。这些细菌主要是厌氧菌、苛养菌和一些新发现的非培养细菌。常规的细菌培养技术不能有效地进行分离鉴定,而PCR技术具有敏感性高、特异性强的优点,能够将常规培养无法检测的细菌识别出来。尽管本研究采用的16SrRNA基因细菌特异性引物不能检测未知细菌,但能够准确测定已知细菌在阴道中的分离率,这是进一步研究阴道细菌数量及相互关系的前提。
本研究显示,与健康对照组相比,BV患者阴道菌群构成发生了明显变化,分离的11种细菌中差异有统计学意义的(P<0.05)占8种。一些常规培养方法不能发现的细菌如:巨球菌属、纤毛菌属、阴道阿托波菌、羞怯动弯杆菌等证实与BV密切相关,可作为BV的标志菌。当联合检测阴道阿托波菌属、普雷沃菌属、纤毛菌属(以检出任一种细菌为BV阳性指标,均未检出作为BV阴性指标)时,以Amsel诊断标准作为金标准,敏感性为93.41%,特异性为78.05%。可见,利用PCR技术检测BV关键细菌或细菌组合可以建立有效的BV诊断方法。
除上述BV标志菌外,本研究显示卷曲乳酸杆菌是阴道中的优势菌,其在BV组分离率明显降低,提示该菌与BV的发生呈负相关,属保护性因素(OR=0.480)。惰性乳酸杆菌是一种在阴道微生态环境恶化时仍能存活的独特的乳酸杆菌,其在阴道防御机制中的作用是当前研究的热点[4]。在可培养细菌中,阴道加德纳菌和动弯杆菌或者由于缺乏特异性,或者因敏感性差都不是BV诊断的理想检测指标。人型支原体、脆弱拟杆菌的分离率在2组标本中差异无统计学意义(P>0.05),提示应做进一步的定量分析将更具有意义。
本研究采用的定性PCR方法不能够提供标本中细菌数量的信息,本研究也未能对全部已知的阴道细菌进行检测。相对于定性检测BV致病菌的有无,检测细菌数量对于BV的诊断似乎更有意义,但是由于荧光定量PCR存在对产物片段大小的限制,不能获得足够的产物信息。本研究采用常规PCR检测结合序列分析可以保证PCR产物均为所需的目的片段,从而提高了细菌检测的准确性。虽然目前国内外学者对于分子生物学技术诊断BV的具体方案仍存在争议,但这些研究拓展了分子诊断学的应用,对阐明细菌性阴道病的病因学具有重要意义[3,6]。
[1]田竟生,徐群渊.PCR及其相关技术进展[J].首都医科大学学报,1995,16(2):159-161.
[2]Jill E.Clarridge.Impact of 16S rRNA Gene Sequence A-nalysis for Identification of Bacteria on Clinical Microbiology and Infectious Diseases[J].Clinical Microbiology Reviews,2004,17(4):840-862.
[3]Fredricks D N,Fiedler T L,Thomas K K,et al.Targeted PCR for Detection of Vaginal Bacteria Associated with Bacterial Vaginosis[J].J Clin Micrology,2007,45(10):3270-3276.
[4]Backer E D,Verhelst R,Verstraelen H,et al.Quantitative determination by real-time PCR of four vaginal Lactobacillus species,Gardnerella vaginalis and Atopobium vaginae indicates an inverse relationship between L.gasseri and L.iners[J].BMC Microbiology,2007,9(7):115-121.
[5]Matsuki T,Watanabe K,Fujimoto J,et al.Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces applied and environmental micrology[J].Appl Environ Microbiol,2002,68(11):5445-5451.
[6]Kumar N,Behera B,Sagiri S S,et al.Bacterial vaginosis:etiology and medalities of treatment-A brief note[J].J Pharm Bioallied Sci,2011,3(4):496-503.

