肠球菌GyrA基因突变和多重耐药泵与氟喹诺酮耐药性关系研究
闫东辉 许淑珍 苏建荣
(首都医科大学附属北京友谊医院检验科,北京 100050)
肠球菌是多重耐药菌并可获得和传递耐药性[1],是当今细菌性感染的治疗难题之一。随着新氟喹诺酮类抗菌药物在临床的广泛应用和时间的延长,在药物的选择压力作用下,肠球菌对此类药物的耐药性也在不断增强[2]。肠球菌对氟喹诺酮类药物(fluoroquinolone,FQs)的耐药机制主要包括2个方面:拓扑异构酶Ⅱ的改变和药物的主动外排[3]。拓扑异构酶Ⅱ分别由GyrA和GyrB两对亚单位组成,分别由GyrA和GyrB基因编码[4]。其中,GyrA基因的突变性在细菌对喹诺酮类药物的耐药机制中占重要地位。多聚酶链反应-单链构象多态性(PCR-SSCP)作为一种对单碱基置换和多碱基插入或缺失的检测方法,其灵敏度高、稳定性好、简单快速,因而是分析GyrA基因突变较为成熟和最常用的方法。
1 材料和方法
1.1 实验菌株和质控菌株
全部实验菌株经过VITEK-2 Compact和 GPI卡片鉴定,其中粪肠球菌30株,屎肠球菌10株。所有实验菌株对左氧氟沙星和环丙沙星耐药。质控菌株为粪肠球菌ATCC 29212。
1.2 实验试剂
Taq酶、缓冲液、PCR反应管等购自赛百盛公司。引物:上游引物5'-CGG GAT GAA CGA ATT GGG TGT GA-3',下游引物5'-AAT TTT ACT CAT ACG TGC TTC GG-3'由赛百盛公司合成;丙烯酰胺、甲叉双丙烯酰胺、N,N,N,N-四甲基乙二胺购自 Sigma公司;去离子甲酰胺购自华美生物工程公司;溶菌酶、蛋白酶K、Tris、SDS、EDTA、无水乙醇、异丙醇、NaCl、葡萄糖、冰乙酸、硝酸银、碳酸钠、甲醛、氯仿、苯、过硫酸胺等试剂购自北京市化学试剂公司。
1.3 实验仪器
PCR扩增仪,美国Biotronic公司AG-9600型扩增仪;细菌鉴定仪,VITEK-2 Compact为法国生物梅里埃有限公司产品;TGL-16G-1冷冻离心机、TGL-16B高速台式离心机购自上海安亭科学仪器厂;DYCP-31D型电泳槽、DYCP-37型电泳槽、WD-9412A型恒温循环器、DYY-10C电泳仪 购自北京市六一仪器厂。DNA测序仪为ABI PRISMTM 377-96DNA Sequencer。
1.4 菌株鉴定
使用VITEK-2 Compact和GPI卡片鉴定。
1.5 肠球菌基因组DNA提取[5]
细菌于BHI肉汤中过夜培养,离心收集细菌,蒸馏水洗涤一次后,重悬于200 μL SET,加溶菌酶至浓度5~10 mg/mL,37℃ 作用1~2 h。加1/10体积10%SDS和 5 μL RNase(10 mg/mL),37 ℃ 孵育 15 min,加20 μL 蛋白酶 K(20 mg/mL),55 ℃ 作用 2 h,70℃ 加热15 min失活蛋白酶K,加1/3体积(100 μL)5 mol/L NaCl和1 体积(400 μL)氯仿,颠倒混匀数次,室温放置30 min,7 300 r/min离心15 min,吸取水层,加入等体积的异丙醇,沉淀DNA,4℃ 13 000 g高速离心10 min,取沉淀晾干,置于200 μL TE缓冲液,55℃溶解DNA 1 h,-20℃保存。
1.6 PCR 法检测耐药基因[3]
20 μL PCR反应体系:TaqDNA聚合酶1 U,10×缓冲液(500 mmol/L KCl,100 mmol/L Tris-HCl,1.0%Triton X-100,200 mmol/L MgCl2)2 μL,dNTPs 各 200 μmol/L,上样染料2 μL,稳定剂2 μL,模版2 μL,引物各1.0 μmol/L。引物:上游引物 5'-CGG GAT GAA CGA ATT GGG TGT GA-3',下游引物5'-AAT TTT ACT CAT ACG TGC TTC GG-3'。循环条件:预变性94℃ 5 min,变性94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 30 s,30个循环。在试验过程中同时设阳性及阴性对照,GyrA是肠球菌基因的正常组成部分,用粪肠球菌ATCC29212做阳性对照;反应体系中不加入DNA模板做阴性对照。
1.7 琼脂糖凝胶电泳
1% ~1.5%琼脂糖凝胶电泳后,在UV光源下观察结果并照相保存,同时把PCR产物进行单链构象多态性分析。
1.8 单链构象多态性分析[5]
样品的制备:5 μL PCR扩增产物与等量的2×变性上样缓冲液(95%去离子甲酰胺,20 mmol/L EDTA,0.05%溴酚蓝,0.05%二甲苯青)混合,98 ℃变性10 min,迅速冰浴骤冷。凝胶的制备:30%丙烯酰胺溶液的制备:100 mL去离子水中加入29 g丙烯酰胺、1 g N、N-二甲基丙烯酰胺。10%过硫酸铵的制备:10 mL去离子水中加入1 g过硫酸铵。凝胶溶液的配制及灌胶:根据PCR产物片段的长度配制8%的凝胶浓度,将配好的溶液用注射器缓慢连续灌注到倾斜30°角的两块玻璃板缝隙中,避免出现气泡。过20~30 min出现Schlieren折射线说明凝胶已形成。小心揭去上层短玻璃。
1.9 聚丙烯酰胺凝胶电泳(PAGE)
实验前2 h开启低温循环器,将冷却板提前预冷至4℃。将长玻璃板及附着其上面的凝胶放置在冷却板上。打开电泳仪开关,首先预电泳至电流恒定。将PCR变性产物8 μL与少量的上样缓冲液Ⅰ混合后加样至1 mm×3 mm的WhatmanⅢ 号滤纸上,整齐贴于凝胶一端,相应的未变性PCR产物作参照。电泳开始5 min电压为250~300 V,5 min后电压改为100~120 V。电泳时间为12~15 h。
1.10 银染色
每次新鲜配制下列溶液:①凝胶固定液:450 mL去离子水中加入50 mL冰乙酸;②显影液:500 mL去离子水中加入 15 g Na2CO3、0.75 mL 37%甲醛、400 μL硫代硫酸钠(10 mg/mL),放置4℃冰箱预冷;③染色液:500 mL去离子水中加入0.5 g硝酸银,0.75 mL 37%甲醛。将电泳后的凝胶同长玻璃板一起放入凝胶固定液中固定20 min。固定结束后回收固定液作为显色后的定影剂。用去离子水漂洗凝胶3次,漂洗过程中注意动作要慢,以免损坏凝胶。加入染色液缓慢摇动染色60 min。用去离子水漂洗凝胶半分钟后加入预冷的显影液缓慢摇动直至凝胶上显出条带。向塑料皿中加入等体积的凝胶固定液(即开始回收的)缓慢摇动2~3 min以中止显色反应。用去离子水漂洗凝胶2次。凝胶在空气中干燥后即可观察记录条带。
1.11 结果判读
未变性的双链走在前端,并应位于ladder marker相应大小条带的水平;单链走在后端,可有1到2条,将单链的带型与敏感株的单链带型比较,位置不同者判读为异常条带。
1.12 基因测序及结果分析
测序菌株的选择:对于聚丙烯酰胺凝胶电泳不同的电泳带型,每种带型随机选取2株进行测序。同时对粪肠球菌ATCC29212的PCR产物进行测序。序列结果分析:用NCBI中的Blast软件与基因库(Genbank)中的相应基因序列进行对比分析。
1.13 利血平对粪肠球菌多重耐药泵的抑制
使用琼脂稀释法[6]把30株对高浓度庆大霉素耐药的粪肠球菌在含有利血平(20 μg/mL)和不含利血平,但是都含有二倍稀释的环丙沙星(MIC值范围是0.25~64 μg/mL)的M-H琼脂上进行平行试验,比较两者MIC值的不同。
2 结果
2.1 肠球菌GyrA基因片段的PCR-SSCP结果
2.1.1 PCR方法检测肠球菌GyrA基因
40株肠球菌(粪肠球菌30株,屎肠球菌10株)、粪肠球菌ATCC29212均扩增出241 bp GyrA基因片段,阴性对照未扩增出条带。琼脂糖凝胶电泳结果见图1。
图1 肠球菌GyrA基因PCR扩增产物Fig.1 Enterococci GyrA gene PCR amplification products M:DNA Marker;N:negative control;P:positive control;1 ~6:samples.
2.2 SSCP 结果
40株对左氧氟沙星和环丙沙星都耐药肠球菌的双链电泳条带都在DNA MarkerⅡ的200 bp附近,其中有24株粪肠球菌和4株屎肠球菌与敏感株和粪肠球菌ATCC 29212电泳条带不同。其他12株肠球菌的电泳条带未发生变化。PAGE电泳后银染色结果详见图2。
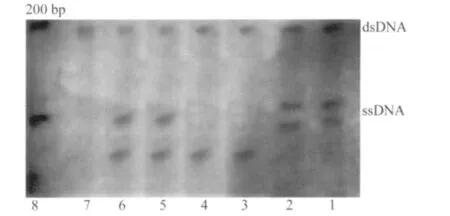
图2 粪肠球菌和屎肠球菌GyrA的PAGE电泳图Fig.2 GyrA gene electrophoresis pattern for E.faecalis and E.faecium
2.3 基因测序
对有异常电泳条带的粪肠球菌和屎肠球菌扩增产物进行测序,用 NCBI中的 Blast软件与基因库(Genbank)中的相应基因序列进行对比分析显示,粪肠球菌的87位密码子发生改变:GAA变为GGA,密码子编码对应的氨基酸由谷氨酸变为甘氨酸。屎肠球菌的83位密码子改变:AGT变为TAT,密码子编码对应的氨基酸由丝氨酸变为脯氨酸。
2.4 利血平对粪肠球菌多重耐药泵的抑制试验
利血平对肠球菌多重耐药泵具有抑制作用,M-H琼脂中加入利血平可以提高环丙沙星对肠球菌的敏感性,实验结果详见表1。

表1 M-H琼脂加入利血平后30株粪肠球菌MIC下降的倍数Tab.1 30 strains E.faecalis MIC reduction level when M-H agar containing reserpine
3 讨论
40株对左氧氟沙星和环丙沙星耐药肠球菌(30株粪肠球菌,10株屎肠球菌)和粪肠球菌ATCC 29212均扩增出GyrA基因。经过PCR-SSCP法检测显示其中24株粪肠球菌和4株屎肠球菌的单链泳动带出现异常。对出现异常条带的菌株进行测序分析,并将测序结果与ATCC29212和Genebank中相关菌株的基因序列进行比较,其中粪肠球菌在第87位上有密码子改变:GAA变为GGA,密码子编码的氨基酸由谷氨酸变为甘氨酸。屎肠球菌在第83位有密码子改变:AGT变为TAT,密码子编码的氨基酸由丝氨酸变为脯氨酸。
40株肠球菌中有70%(28株)发生了基因突变,结果导致对氟喹诺酮类药物的耐药。文献[4]报道氟喹诺酮类耐药菌株的变异常发生于螺旋酶A亚单位的67~106位氨基酸,即耐氟喹诺酮类决定区(QRDR),本次试验所用引物扩增出的PCR产物包括QRDR,所有菌株均扩增出241bp的GyrA片段,经单链构象多态性分析后共电泳出3种带型:粪肠球菌ATCC29212、对Levo和Cip敏感的粪肠球菌为一种带型;耐药菌株出现2种带型,一种带型为粪肠球菌的GyrA亚单位的87位氨基酸由谷氨酸变为甘氨酸,有24株耐药菌检测到了该突变;另一种带型为屎肠球菌的GyrA亚单位的83位氨基酸由丝氨酸变为脯氨酸,有4株耐药菌检测到了该突变。此外,粪肠球菌的耐药程度虽然不同,但其GyrA的突变点一致。12株耐药肠球菌并未发生基因突变,说明GyrA基因QRDR突变是肠球菌对氟喹诺酮类药物耐药的重要原因。利血平对肠球菌多重耐药泵具有抑制作用,M-H琼脂中加入终浓度为20 μg/mL的利血平后,30株粪肠球菌中有10株细菌的MIC值降为原来的一半,有4株细菌的MIC值降为原来的四分之一,肠球菌的敏感性在原有的水平上有了不同程度的提高。肠球菌GyrA基因突变和多重耐药泵是其对氟喹诺酮类抗生素耐药的主要原因。
[1]Gould I M.The epidemiology of antibiotic resistance[J].Int J Antimicrob Agents,2008,32(Suppl 1):S2-9.
[2]汪玲,沈叙庄,陆权,等.4地儿科临床分离革兰阳性球菌2000-2006年耐药性监测[J].首都医科大学学报,2008,29(5):627-631.
[3]Wickman P A,Black J A,Smith Moland E,et al.In vitro development of resistance to DX-619 and other quinolones in enterococci[J].J Antimicrob Chemother,2006,58(6):1268-1273.
[4]Piekarska K,Jaqielski M.Genetical conditioning of fluoroquinolone resistance mechanisms of clinical enterococcus faecalis strains.Ⅱ.The mutations present in the qrdrs of gypA,gyrB,parC and parE genes[J].Med Dosw Mikrobiol,2007,59(4):329-341.
[5]卢圣栋.现代分子生物学试验技术[M].2版.北京:中国协和医科大学出版社,2004,111-217.
[6]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:nineteenth informational supplement.CLSI document M100-S19[S].Wayne:CLSI,2009.

