探讨γ-谷氨酰基转移酶冰冻混合人血清候选标准物质的制备和稳定性
徐 静 张建平 王清涛
(首都医科大学附属北京朝阳医院检验科,北京 100020)
血清酶测定是临床实验室的一项重要常规工作,但由于酶的催化活性不仅取决于酶的含量,还受多种因素的影响,具有方法依赖性,对酶活性测定进行标准化是解决这一问题的最好方法[1]。目前,国际临床化学学会(International Federation of Clinical Chemistry,IFCC)已经公布了丙氨酸氨基转移酶(alanine-aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate-aminotransferase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶(creatine kinase,CK)、γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)、淀粉酶(amylase,AMY)6个血清酶测定的参考方法[2-7]。在标准物质方面,目前欧共体标准物质与测量研究所(Institute for Reference Materials and Measurements,IRMM)以及日本临床检验标准委员会(Japan Committee for Clinical Laboratory Standards,JCCLS)均研制了酶的有证标准物质。国内多家实验室已经建立了酶的国际临床化学联合会(International Federation of Clinical Chemistry,IFCC)推荐的参考方法,酶学标准物质的研制也在进行中,考虑到互通性,酶学标准物质最好为人源性血清标本,而用冰冻人血清制备标准物质的可行性也得到了美国国家疾病控制中心的认可[8]。本实验室将收集的人血清按照GGT不同浓度进行过滤分装,制备了GGT冰冻混合人血清候选标准物质,并对其稳定性进行了观察,以研究此血清制备方法的可行性和GGT冰冻混合血清-80℃贮存条件下的稳定性。
1 材料与方法
1.1 GGT冰冻混合人血清的制备
①体检血清:收集当日体检结果正常,且无溶血、黄疸及乳糜的血清标本,-80℃冰箱保存。②患者血清:按 GGT结果50~200 U/L、200~400 U/L、400~750 U/L、>750 U/L浓度范围分别收集患者新鲜血清,避免溶血、黄疸及乳糜。-80℃冰箱保存。
1.2 仪器
GAST DOA型真空/加压两用过滤泵(美国),全波过滤器,分析滤纸,赛多利斯0.8 μm醋酸纤维素膜(德国Sartorius公司),赛多利斯0.45 μm醋酸纤维素膜(德国 Sartorius公司),赛多利斯 0.2 μm 醋酸纤维素膜(德国 Sartorius公司),BIOHIT 100 ~5 000 μL 单道电动移液器(芬兰),冻存盒,磁力搅拌器,Siemens Dimension RXL Max全自动生化分析仪。
1.3 冰冻混合人血清制备方法
1)确定浓度:制备5个浓度水平的GGT冰冻混合人血清候选标准物质,各浓度分别为<50 U/L、50~100 U/L、101 ~200 U/L、201 ~300 U/L、301 ~400 U/L,每个浓度水平制备约600 mL。分装1 mL/支,每个浓度约500支。
2)血清复融:在过滤前一天将需要过滤的血清在室温融化,将收集的同一浓度范围的血清混匀,用常规方法测定其浓度。根据其浓度水平确定最终混合比例,再用常规方法测定其浓度,达到确定的浓度水平后放4℃冰箱保存。
3)玻璃器皿及冻存管:将过滤用的容器洗刷干净,与冻存管一同消毒后备用。
4)将前一天融好的血清从4℃冰箱中取出,在生物安全柜中进行负压抽吸过滤,血清依次经过分析滤纸,0.8 μm 滤膜,0.45 μm 滤膜,0.2 μm 滤膜过滤。
5)将过滤好的血清在生物安全柜中进行分装,1 mL/支。-80℃冰箱保存。
1.4 冰冻混合人血清候选标准物质的稳定性观察
1)材料:①GGT冰冻混合人血清候选标准物质:经过滤分装制备的5个浓度水平的混合人血清。②质控血清:RANDOX常规化学质控血清1和2(批号分别为496UN和331UE),分别将其进行0.5 mL/支分装,用于监测仪器及试剂状态。③仪器和试剂:Siemens Dimension RXL Max全自动生化分析仪,Siemens GGT检测试剂盒,Siemens enzyme校准品。
2)方法:分别于候选标准物质制备后0、7、30、60、120、180、330、360、390、750 d 采用 Siemens Dimension RXL Max全自动生化分析仪测定RANDOX质控血清1、2(QC1、QC2)及采用随机方法抽取的5个浓度水平的候选标准物质各1支,分别记录为 C1、C2、C3、C4、C5。
1.5 统计学方法
采用Microsoft Office Excel 2007软件抽取随机样本并进行趋势分析,采用SPSS 11.5统计学软件进行线性回归分析,以P<0.05为差异有统计学意义。
2 结果
RANDOX质控血清QC1、QC2和候选标准物质C1、C2、C3、C4、C5 在 0、7、30、60、120、180、330、360、390、750 d的测定结果见表1。
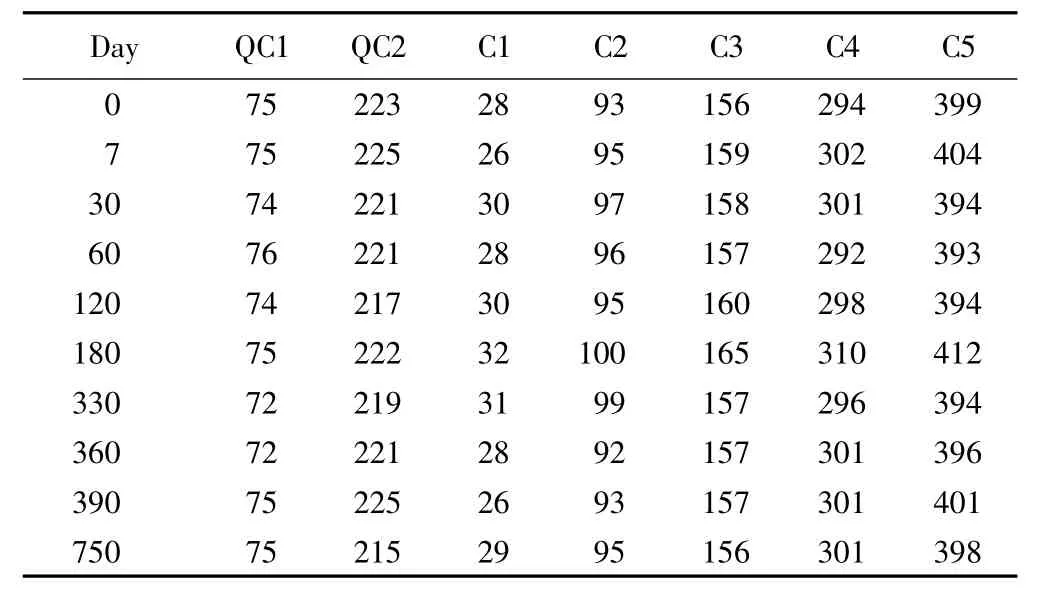
表1 RANDOX质控血清和候选标准物质GGT测定结果Tab.1 RANDOX qc serum and candidate standard material GGT determination result (U/L)
RANDOX质控血清和候选标准物质稳定性曲线见图1,从图1可以看到对于经验模型方法,QC1、QC2、C1~C5的斜率 b分别为 -0.127 8,-0.442 4,0.060 6,-0.042 4,-0.084 8,0.484 8,0.006 1,均接近0,即质控血清和候选标准物质在不同时间的GGT测定结果没有明显变化趋势。
根据ISO Guide35,采用SPSS 11.5统计学软件对QC1、QC2、C1~C5进行线性回归分析,结果显示在750 d以内,QC1、QC2、C1~C5线性回归分析的 P 值均 >0.05(QC1、QC2、C1 ~C5测定结果P值分别为0.560、0.114、0.886,0.753,0.585,0.571,0.945),即差异不具有统计学意义,所以GGT冰冻混合人血清候选标准物质在此时间阶段是稳定的。

图1 GGT冰冻混合人血清候选标准物质的稳定性Fig.1 Stability of GGT frozen mixed human serum candidate standard material
3 讨论
临床检验结果准确一直是检验医学界的工作目标。实现检验结果准确的重要手段是建立和保证检验结果的溯源性,而开展检验量值溯源的必要条件是具备参考系统[9],后者包括参考测量程序,从事参考测量的实验室及参考物质。而由参考方法定值,具有不同水平参考值结果的患者混合血清盘可以作为“企业一级参考品”,即企业的最高标准。这种定值血清分装成小包装,-70℃保存,应该与新鲜血清性质相似,但对其稳定性的研究甚少。从减少基质效应的角度出发,校准品最好为人源血清标本。
采用感染筛查阴性的人血清或类人血清标本,添加外源性替代物,如加入与人血清酶具有相似特性,从动物脏器中提取的酶或重组人源性酶制品制备校准品具有基质效应小、良好的互换性和感染可能性小等优点而成为一种可行的方案[10]。本实验室制备的GGT冰冻混合人血清候选标准物质的血清来源为实验室检测剩余的体检者及患者血清,主要存在的问题是来源有限及可能具有感染性,最好在对收集的血清混匀后测定HIV和肝炎标志物,以进行感染筛查,而本研究并未进行此测定。但本实验室采用的混合血清制备方法比较简单,除生物安全柜外,无需特殊设备,可操作性强。
稳定性观察分为短期稳定性和长期稳定性,有2种基本实验设计,即经典稳定性研究和同步稳定性研究,经典稳定性研究中,同时(如同一批次)制备的样品在同样的条件下随着时间变化进行测量,同步稳定性研究是使所有稳定性研究的测量在重复性条件下进行,其不确定度相对较小[11]。本实验室曾采用同步稳定性研究方法进行6种冰冻混合血清酶(ALP、ALT、AST、GGT、CK、LDH)的短期稳定性观察,对于GGT,其在室温和2℃ ~8℃冷藏条件下30 d内稳定[12]。对于长期稳定性的观察,我们采用经典稳定性研究方法,并采用直线作为经验模型,即斜率b应为0或接近0的方法观察,结果发现,5个浓度水平GGT混合血清在不同时间的测定结果没有明显变化趋势。采用线性回归方差分析方法对其进行分析,得到相同的结果,因此在750d稳定性的观察中,5个浓度水平的GGT冰冻混合人血清候选标准物质在-80℃保存条件下是稳定的。
综上所述,虽然本实验室在血清来源方面缺乏感染筛查,无法保证制备的混合血清候选标准物质不存在感染性,但采用的混合血清制备方法简便易行,且制备候选标准物质稳定性良好。此血清候选标准物质制备方法及稳定性研究方案可以应用于其他项目,但须注意感染性问题,因此血清来源仍是一个需要解决的问题。
[1]张克坚,杨振华.临床酶学标准化的新途径[J].中华医学检验杂志,1999,22(1):54-56.
[2]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degrees C.Part 2.Reference procedure for the measurement of catalytic concentration of creatine kinase[J].Clin Chem Lab Med,2002,40(6):635-642.
[3]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degrees C.Part 3.Reference procedure for the measurement of catalytic concentration of lactate dehydrogenase[J].Clin Chem Lab Med,2002,40(6):643-648.
[4]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement o f catalytic activity concentrations of enzymes at 37 degrees C.Part 4.Reference procedure for the measurement of catalytic concentration of alanine aminotransferase[J].Clin Chem Lab Med,2002,40(7):718-724.
[5]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement of catalytic activi-ty concentrations of enzymes at 37℃.Part 5.Reference procedure for the measurement of catalytic concentration of aspartate aminotransferase[J].Clin Chem Lab Med,2002,40(7):725-733.
[6]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part 6.Reference procedure for the measurement of catalytic concentration of γ-glutamyltransferase[J].Clin Chem Lab Med,2002,40(7):734-738.
[7]Schumann G,Aoki R,Ferrero C A,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part 8.Reference procedure for the measurement of catalytic concentration of α-Amylase[J].Clin Chem Lab Med,2006,44(9):1146-1155.
[8]National Committee for Clinical Laboratory Standards.Preparation and Validation of Commutable Frozen Human Serum Pools as Secondary Reference Materials for Cholesterol Measurement Procedures;Approved Guideline[S].C37-A.Wayne,PA:NCCLS:1999.
[9]陈文祥.临床检验量值溯源与参考系统[J].中华检验医学杂志,2006,29(1):17-19.
[10]徐国宾,吴南,王清涛.要重视血清酶学测定的标准化工作[J].临床检验杂志,2007,25(3):161-164.
[11]中国合格评定国家认可委员会.CNAS-CL04 2007标准物质/标准样品生产者能力认可准则[S].2007.
[12]马怀安,王清涛,徐静,等.六种冰冻混合血清酶学的短期同步稳定性研究[J].中国医药导刊,2009,11(4):644-646.

