他莫昔芬介导的绝经期子宫内膜pten基因突变的检测
郭 蕾 李文君 马雪莲 冯力民
(首都医科大学附属北京天坛医院妇产科,北京 100050)
他莫昔芬(tamoxifen,TAM)是乳腺癌术后辅助内分泌治疗应用最为广泛的药物,但TAM治疗乳腺癌的同时对子宫内膜则产生类雌激素样激动作用,长期使用可以使子宫内膜增生甚至癌变[1],其发生机制尚不明确。
磷酸酶张力蛋白抑癌基因(phosphatase and tensin,pten)是子宫内膜癌中突变率最高的基因,被公认为子宫内膜的“看家基因[2]”。本研究选取服用TAM的绝经期患者的子宫内膜,以绝经期子宫内膜癌患者及绝经期正常子宫内膜为对照,采用聚合酶链反应—单链构象多态性(PCR-SSCP)及DNA双向测序法检测pten基因外显子的突变情况,探讨其与TAM介导的子宫内膜病变发生发展的关系。为临床预防及治疗TAM相关内膜病变提供理论依据。
1 材料与方法
1.1 标本来源
所有子宫内膜标本采集于2007年至2010年间在首都医科大学附属北京天坛医院妇产科住院治疗的绝经期患者。纳入的75例病例均为绝经后患者,以排除激素水平对TAM作用的影响。共分为3组,实验组为服用TAM的子宫内膜组(33例),均为乳腺癌术后服用TAM的绝经期患者,每日服TAM 10 mg,Bid,平均服药时间为(17.15±16.58)月。因出现阴道不规则出血或定期随访B超提示子宫内膜增厚,住院宫腔镜检查获得子宫内膜标本。患者平均年龄(56.5±10.1)岁,平均绝经时间(7.3±8.9)年。对照组为子宫内膜腺癌组(22例),子宫内膜标本临床病理分期为Ⅰ期的子宫内膜癌。患者平均年龄为(59.1±9.5)岁,平均绝经时间(9.1±7.6)年;正常子宫内膜组(20例),为因患子宫脱垂入院行子宫切除术的绝经期患者,术后子宫内膜病理检查除外子宫内膜增生性病变和癌变。患者平均年龄(63.5±7.7)岁,平均绝经时间(13.2±7.5)年。
1.2 方法
1)标本采集:离体子宫内膜标本立即无菌操作下留取部分置液氮中速冻,然后置-80℃冰箱冻存备用。
2)组织DNA提取:-80℃冰箱取组织块,室温解冻,加Trizol液(1 mL/10 cm2),充分研磨;加入氯仿,低温离心;吸取上清,剩余有机相和中间层加入无水乙醇,混匀,低温离心;弃上清,加0.1 mmol的柠檬酸钠洗沉淀,室温放置30 min,75%乙醇洗涤沉淀,室温干燥 DNA沉淀5~10 min,加入适量含8 nmol NaOH的无菌蒸馏水溶解。
3)Pten基因9个外显子(ex)PCR-SSCP步骤:总反应体系25 μL,加上、下游引物,加DNA聚合酶Mastermix 12.5 μL;加模板 DNA 各 1 μL;加灭菌蒸馏水至25 μL反应体系,分别按各自反应条件进行PCR扩增。反应条件:ex1:预变性(94℃),3 min;变性94 ℃,30 s;退火60 ℃,30 s;延伸(72 ℃),30 s;后延伸72 ℃,7 min,35 个循环;ex2、3、4:预变性(94 ℃),3 min;变性94℃,40 s;退火 46 ℃,40 s;延伸(72 ℃),60 s;后延伸72 ℃,7 min,45 个循环;ex5、6、7、8、9:预变性 94 ℃,3 min;变性 94 ℃,40 s;退火58 ℃,40 s;延伸72 ℃,60 s;后延伸72 ℃,7 min,35个循环。
4)琼脂糖凝胶电泳:取PCR产物5 μL以2%琼脂糖凝胶电泳,电压100V,紫外灯下观察确认扩增成功。聚丙烯酰胺凝胶快速银染法(SSCP):加等体积(各10 μL)变性缓冲液置99℃变性10 min,变性后标本各取20 μL以聚丙烯酰胺凝胶电泳,电压120V,约40 min。快速银染并拍照。
1.3 结果判断
以正常子宫内膜组织的DNA(标准Marker)扩增产物的SSCP带型为阴性对照,如出现单链DNA条带数目增加、减少或位置的相对位移为阳性结果,筛选为可疑突变标本,再对目标基因行PCR扩增100 μL,透析袋电洗脱纯化后进行DNA双向测序,并与NCBI基因库序列进行比较(序列号:AF067844),确认有无突变发生和突变位点及种类。
1.4 统计学方法
采用SPSS11.5统计学软件分析数据,各组间数据采用χ2检验比较,所得数据用Fisher's确切概率法进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR-SSCP筛选结果及DNA双向测序
PCR-SSCP电泳筛选出20个出现异常单链DNA条带的外显子(图1A-E所示)。
将筛选出的目标基因行PCR扩增后由诺赛基因公司做DNA双向测序,结果(图2A-D)与NCBI基因库序列进行比较(序列号:AF067844),确认TAM组和子宫内膜癌组分别有4例和5例发生突变(表1,2),突变率分别为12.12%(4/33)和22.72%(5/22)。
Pten基因突变样本DNA测序结果(图2A-D):
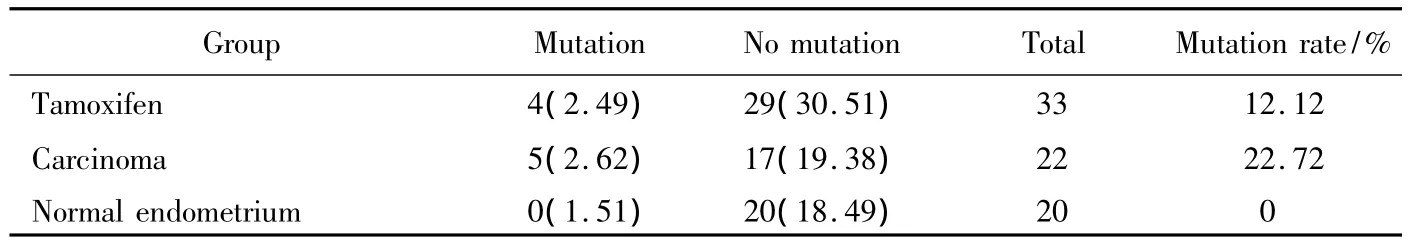
表1 各组pten基因突变情况Tab.1 Pten mutation of nine exons in 3 groups
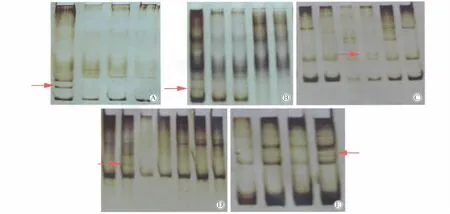
图1 Pten基因外显子PCR-SSCR电泳结果Fig.1 The PCR-SSCR result of Pten exon
2.2 3组基因突变率比较
TAM组和子宫内膜癌组分别有4例和5例发生基因突变,突变率差异无统计学意义(P>0.05);正常子宫内膜组无基因突变,突变率0%(0/20),TAM组与正常子宫内膜组比较,差异无统计学意义(P>0.05);子宫内膜癌组与正常子宫内膜组比较,差异有统计学意义(P<0.05),详见表1,2。
3 讨论
3.1 他莫昔芬对乳腺癌患者子宫内膜的影响
乳腺癌已成为当今女性健康的第一杀手,发病率在世界范围内呈逐年增长的趋势。近10年来其发病率上升的同时病死率呈下降趋势,其原因与术后辅助化疗和内分泌治疗密切相关,患者的长期生存率大大提高。他莫昔芬(tamoxifen,TAM)是乳腺癌内分泌治疗中应用最为广泛的药物,用于雌激素敏感性乳腺癌术后的辅助治疗,60%~70%的乳腺癌患者术后需连续服用TAM 5年。20多年的临床应用证明其疗效肯定。2002年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)建议,目前5年的TAM治疗仍是雌激素受体(ER)阳性者的标准治疗方案。TAM在乳腺癌术后预防复发转移的辅助治疗及解救治疗中都有十分重要的地位[3]。TAM同时也是一种选择性雌激素受体调节剂,对不同靶器官间有雌激素和/或抗雌激素样的双重作用,在乳腺组织可产生拮抗雌激素的作用,而对子宫内膜则产生类雌激素样激动作用,长期使用可引起子宫内膜病变,甚至癌变[1]。
研究[5]发现他莫昔芬的作用随着周围雌二醇(E2)的浓度的变化而表现不同,对于激素低水平[E2<20pg/mL,卵泡刺激素(follicle-stimulating hormone,FSH)>40 mIU/mL]的绝经后妇女则是一种弱的雌激素激动剂,表现出类雌激素样作用,一系列内膜异常与其使用有关,可造成内膜增生、良性息肉甚至癌变。子宫内膜息肉是绝经后妇女服用他莫昔芬后最常见的子宫内膜病理类型,TAM治疗者子宫内膜息肉发生率高于未用药者(8%~36%:0~10%)[4]。大多数患者无症状。TAM相关子宫内膜息肉恶变率为3.0% ~10.7%。多发性息肉及局灶性增生是癌变的重要起源[5]。有学者[6]观察每1 000个无症状妇女发生子宫内膜癌的危险估计为1.7,服用TAM可使这一危险提高2~3倍,依赖于累计剂量和服用时间。一些流行病学研究及临床试验[7]也已证实乳腺癌患者在长时间服用TAM后发生子宫内膜癌的危险性增加。1996年,国际癌症研究组织正式将TAM划归为人类子宫内膜致癌物。
3.2 他莫昔芬介导的子宫内膜病变发病机制研究现状

表2 Pten基因各外显子突变情况Tab.2 Pten mutation of nine exons
目前对TAM相关子宫内膜病变的形态学改变研究较多,但其作用机制尚不明确。有研究[8]发现TAM不仅影响雌激素相关靶基因的表达,而且调控一系列独特的基因表达,认为雌激素和TAM通过影响细胞信号传导途径如调节下游区的效应基因PAX2启动子低甲基化来参与子宫内膜细胞的增生和癌变过程。Pole J C等[9]研究了在原代培养的人正常子宫内膜细胞中TAM诱导的基因表达的变化,发现与对照组相比,TAM组出现了许多基因的改变,这些改变和基因转录调节、细胞周期调控和信号的转导有关。Monte N M等[10]在正常增生、癌前、子宫内膜腺癌组织中进行Pten和 PAX2免疫染色,对总体患病率和联合PAX2-Pten基因表达缺失进行了统计学分析。认为这2个基因的功能同时丧失是导致一种癌前病变转化为癌的重要因素。
Pten是继p53之后发现的人类肿瘤中第2个突变率较高的基因,也是目前已知的子宫内膜癌中突变率最高的基因,是子宫内膜癌发生的早期事件,被视为子宫内膜的“看家基因”。Pten基因失活与细胞信号转导、肿瘤发病机制、浸润转移、恶性转化、无限制生长和临床预后等有一定关系。Pten基因失活机制主要包括等位基因缺失、基因突变、甲基化、mRNA和蛋白表达降低或失表达,微卫星不稳定性,其中基因突变是最常见的Pten基因失活方式[11]。许多学者通过对子宫内膜癌、非典型增生组织中抑癌基因Pten突变和表达缺失与临床意义的探讨,得知由Pten基因突变和表达缺失导致的Pten功能丧失,是子宫内膜癌的早期分子事件,在子宫内膜过度增生发展至子宫内膜癌前病变中起着重要作用[12]。更有学者[13]证实Pten也可作为癌前病变——子宫内膜上皮内瘤样增生(EIN)的预测及转归的重要指标之一。观察[12]提示,与p53相比,Pten失活可能作用于子宫内膜癌早期,或许可以作为早期子宫内膜癌及癌前病变的诊断指标。
3.3 研究服用TAM的绝经期患者子宫内膜Pten基因失活机制的意义
目前国内外对子宫内膜癌中Pten基因研究较多,但对服用TAM的患者子宫内膜中Pten基因的研究相关报道尚少。那么TAM是否也通过引起Pten基因的失活,从而成为其导致子宫内膜癌的驱使因素,是本研究的重点。
国内邢风玲等[14]采用LSAB二步法检测了服用TAM绝经期患者子宫内膜PTEN蛋白表达情况,并以绝经期子宫内膜癌及正常绝经期内膜中PTEN蛋白表达做对照,发现PTEN蛋白在正常绝经人群中呈高表达、服用TAM的绝经人群呈中表达、绝经后子宫内膜癌患者的子宫内膜中呈低表达,提出PTEN蛋白表达降低可能为TAM介导的子宫内膜癌的早期分子事件。
本实验检测了服用TAM绝经期妇女子宫内膜Pten基因外显子突变情况。服用TAM组与正常子宫内膜组相比差异虽无统计学意义,但其突变率明显高于正常组,且与子宫内膜癌组比较差异无统计学意义,预测如加大样本量可能差异会有统计学意义。本研究表明Pten基因突变可能在服用TAM的绝经期患者的子宫内膜过度增生发展至子宫内膜癌前病变中起重要作用,可能是TAM介导的子宫内膜癌的早期分子事件,其意义有待扩大样本例数并对服用TAM前基础病变做前瞻性对照研究进一步验证。
临床上为服用TAM达到足够的疗程,往往采取切除子宫的方法来预防子宫内膜的病变,但对患者的损伤较大,国内冯力民等[15]开展了在患者服用TAM前采用宫腔镜微创治疗行子宫内膜去除术,术后继续服用TAM的研究。目前已有32例患者术后随访5年,未发现子宫内膜息肉复发及恶性病变。目前尚缺乏大样本的前瞻性基础实验为其提供分子生物学依据并且证实其疗效。如果能证实TAM也通过引起Pten基因的失活,从而成为其导致的子宫内膜癌的驱使因素,不仅能为TAM引起子宫内膜癌变提供分子生物学证据,作为预测服用TAM患者的子宫内膜细胞是否失去分化活性及增加癌变风险的标志物,而且能指导临床治疗策略,为我们采用宫腔镜下去除子宫内膜的微创手术来预防和治疗TAM相关内膜病变提供理论依据,为乳腺癌患者术后安全服用TAM至全疗程,降低复发率和病死率都有很大的现实意义。
[1]Duffy S,Jackson T L,Lansdown M,et al.The ATAC('Arimidex',Tamoxifen,Alone or in Combination)adjuvant breast cancer trial:baseline endometrial sub-protocol data on the effectiveness of transvaginal ultrasonography and diagnostic hysteroscopy[J].Hum Reprod,2005,20(1):294-301.
[2]Gielen S C,Santegoets L A,Hanifi-Moghaddam P,et al.Signaling by estrogens and tamoxifen in the human endometrium[J].J Steroid Biochem Mol Biol,2008,109(3-5):219-223.
[3]Jordan V C.Tamoxifen:a most unlikely pioneering medicine[J].Nat Rev Drug Discov,2003,2(3):205-213.
[4]Varras M,Polyzos D,Akrivis C H.Effects of tamoxifen on the human female genital tract:review of the literature.[J].Eur J Gynaecol Oncol,2003,24(3 -4):258-268.
[5]Turbiner J,Moreno-Bueno G,Dahiya S,et al.Clinicopathological and molecular analysis of endometrial carcinoma associated with tamoxifen[J].Mod Pathol,2008,21(8):925-936.
[6]Le Donne M,Lentini M,DeMeo L,et al.Uterine pathologies in patients undergoing tamoxifen therapy for breast cancer:ultrasonographic,hysteroscopic and histological findings[J].Eur J Gynaecol Oncol,2005,26(6):623-626.
[7]Kieback D G,Harbeck N,Bauer W,et al.Endometrial effects of exemestane compared to tamoxifen within the Tamoxifen ExemestaneAdjuvantMulticenter(TEAM)trial:results of a prospective gynecological ultrasound substudy[J].Gynecol Oncol,2010,119(3):500-505.
[8]Wu H,Chen Y,Liang J,et al.Hypomethylation-linked activation of PAX2 mediates tamoxifen-stimulated endometrial carcinogenesis[J].Nature,2005,438(7070):981-987.
[9]Pole J C,Gold L I,Orton T,et al.Gene expression changes induced by estrogen and selective estrogen receptor modulators in primary-cultured human endometrial cells:signals that distinguish the human carcinogen tamoxifen[J].Toxicology,2005 Jan 5,206(1):91-109.
[10]Monte N M,Webster K A,Neuberg D,et al.Joint loss of PAX2 and PTEN expression in endometrial precancers and cancer[J].Cancer Res,2010,70(15):6225-6232.
[11]Salvesen H B,MacDonald N,Ryan A,et al.PTEN methylation is associated with advanced stage and microsatellite instability in endometrial carcinoma[J].Int J Cancer,2001,91(1):22-26.
[12]Bilbao C,Rodriguez G,Ramirez R,et al.The relationship between microsatellite instability and PTEN gene mutations in endometrial cancer[J].Int J Cancer,2006,119(3):563-570.
[13]Pavlakis K,Messini I,Vrekoussis T,et al.PTEN-loss and nuclear atypia of EIN in endometrial biopsies can predict the existence of a concurrent endometrial carcinoma[J].Gynecol Oncol,2010,119(3):516-519.
[14]邢风玲,陈雪芹,冯力民,等.绝经后服用他莫西芬的乳腺癌患者子宫内膜中PTEN的表达[J].首都医科大学学报,2010,31(03):405-408.
[15]冯力民,高婉丽,张华,等.他莫昔芬致子宫内膜病变的宫腔镜诊治[J].实用妇产科杂志,2005,21(7):399-402.

