子宫腺肌病PGP 9.5、NGF的表达及其与痛经的关系
王文莉 段 华 张 颖 郭银树 成九梅
(首都医科大学附属北京妇产医院妇科微创中心,北京 100026)
子宫腺肌病(adenomyosis,ADS)是最常见的引起继发性痛经的疾病之一,虽然继发性痛经发生率很高,但目前对其发病机制的了解仍然有限。本研究旨在探讨蛋白基因产物9.5(protein gene product 9.5,PGP 9.5),神经生长因子(nerve growth factor,NGF)在ADS中的表达情况,研究神经因子在ADS中的表达及其与痛经的关系,探讨上述因子在ADS发病及痛经产生中的作用。
1 资料和方法
1.1 研究对象
选取2008年8月~2008年12月间在首都医科大学附属北京妇产医院妇科微创中心接受手术治疗的未绝经ADS患者30例,患者年龄28~51岁,平均年龄(45.90±3.97)岁,术前根据视觉模拟评分法[1](visual analogue scale/score,VAS)对ADS患者的痛经程度进行评分,轻度痛经者12例、中度痛经者9例、重度痛经者9例。在30例患者中取60例病理标本,分为2组:①ADS在位子宫内膜组(ADS-E组)30例标本,其中增生期子宫内膜23例,分泌期子宫内膜7例;②ADS子宫肌层组(ADS-M组)30例标本。对照组为同期因子宫肌瘤、宫颈病变接受手术治疗的30例患者,取57例标本,分为2组:①对照在位子宫内膜组(对照-E组)30例标本,增生期子宫内膜23例,分泌期子宫内膜7例。患者年龄26~50岁,平均年龄(41.27±7.05)岁。②对照肌层组(对照-M组)27例标本。患者年龄29~50岁,平均年龄(43.44±5.46)岁。全部病例标本取材经过伦理委员会批准及患者知情同意,病理结果均由2名病理学专家检查证实,患者未合并有糖尿病、甲状腺功能亢进、肾上腺功能亢进等神经、内分泌疾病,且术前3个月内未接受激素治疗。研究组与对照组患者的年龄,剖宫产史、子宫内膜增生期与分泌期比较差异无统计学意义(P>0.05)。
1.2 方法
1)主要试剂:鼠抗人蛋白基因产物9.5(protein gene product 9.5,PGP 9.5)单克隆抗体(1:100)(北京中杉金桥生物技术有限公司产品)、兔抗人神经生长因子(nerve growth factor,NGF)单克隆抗体(1:100)(北京博奥森生物技术有限公司产品)。
2)方法:标本经10%甲醛浸泡,制成石蜡块。以人小肠和脑组织切片为阳性对照,PBS代替一抗为阴性对照,每例组织石蜡块切片3张,1张HE染色核实病理诊断,余2张行免疫组化染色。切片厚4μm,石蜡切片常规脱蜡浸水,蒸馏水浸泡5min;PBS冲洗3次;枸橼酸缓冲液煮沸(沸水浴)修复15 min;PBS冲洗3次;3%过氧化氢水溶液,室温孕育20 min;PBS冲洗3次;滴加正常山羊血清工作液,37℃孵育15 min,后去除多余正常山羊血清工作液;滴加一抗鼠抗人PGP 9.5单克隆抗体(1:100)、兔抗人NGF单克隆抗体(1:100)4℃过夜。复温20 min,PBS冲洗3次;二抗孵育,37℃20min,室温孵育20 min;PBS冲洗3次;三抗(辣根酶标记链酶卵白素工作液)孵育,37℃20min;PBS冲洗3次;DAB显色;自来水充分冲洗,脱水透明、封片。
3)结果判定标准:采用Lecia光学显微镜系统,每张切片在Lecia高倍镜下采用抽签法随机观察4个视野,电脑计算每个视野的阳性细胞数,取平均值[2]。
1.3 统计学方法
所有数据均采用SPSS15.0统计软件进行分析处理,计量数据采用均数±标准差(±s)表示。各组均数比较先进行方差齐性检验,方差齐者采用独立样本 t检验,方差不齐者进行秩和检验,采用Spearman法进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 在位子宫内膜功能层中PGP 9.5、NGF的表达
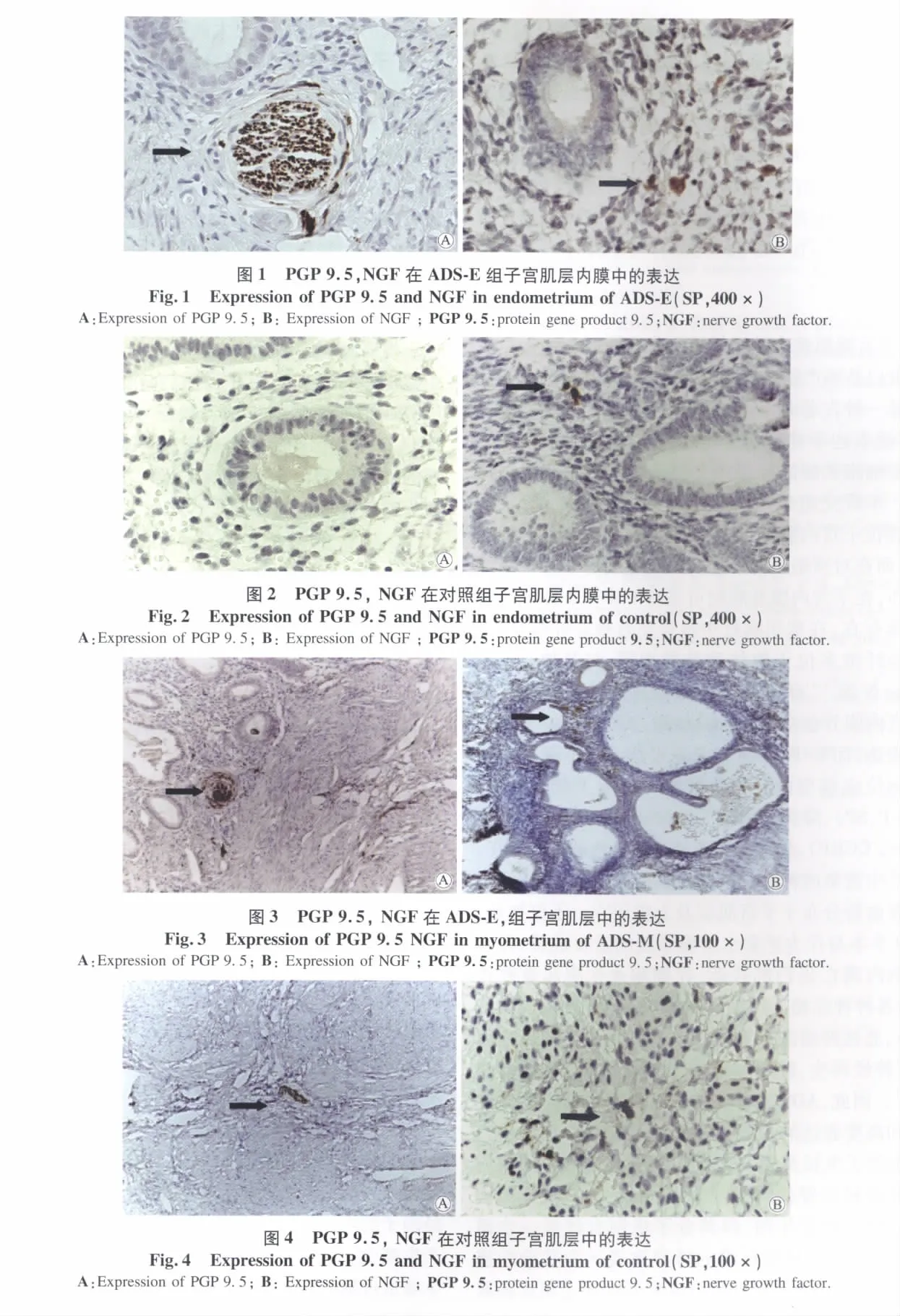
ADS-E组可见 PGP 9.5、NGF的表达,阳性细胞棕黄色颗粒位于细胞质中 (图1)。对照-E组未见PGP 9.5的表达,仅见NGF的表达(图2)。对照-E组NGF的表达明显低于ADS-E组,差异有统计学意义(P <0.05),详见表1。
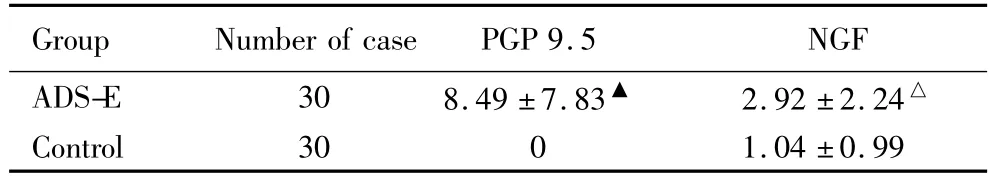
表1 在位子宫内膜中PGP 9.5、NGF表达Tab.1 Expression of PGP 9.5 and NGF in endometrium
2.2 子宫肌层中PGP 9.5、NGF的表达
ADS-M组可见 PGP 9.5、NGF的表达,阳性细胞棕黄色颗粒位于细胞质中 (图3);对照-M组中可见PGP 9.5和NGF的表达(图4)。对照-M组PGP 9.5、NGF的表达明显低于ADS-M组,差异有统计学意义(P <0.05),详见表2。

表2 子宫肌层中PGP 9.5、NGF的表达Tab.2 Expression of PGP 9.5,NGF in myometrium
2.3 PGP 9.5、NGF的表达与痛经的相关性
在ADS-E组中,随着痛经程度的加重,PGP 9.5、NGF在在位子宫内膜功能层中的表达有显著的增高趋势,且PGP 9.5、NGF的表达与痛经程度有显著相关性(r=0.520和0.688,P <0.05)。
在ADS-M组中,随着痛经程度的加重,PGP 9.5和NGF的表达有显著的增高趋势,且与痛经程度有显著相关性(r=0.543和0.503,P<0.01)。
3 讨论
3.1 子宫腺肌病中神经纤维的分布特点
蛋白基因产物9.5(protein gene product 9.5,PGP 9.5)是一种古老而保守的蛋白质,属于泛素水解酶系统,广泛表达于神经元分化的各个阶段,是一个神经外胚层细胞来源的神经内分泌系统的特定的组织标志物。本研究组采用PGP 9.5标记神经纤维,发现ADS在位子宫内膜功能层可见PGP 9.5染色的神经纤维,而在对照组正常子宫内膜功能层却未见神经纤维分布,在子宫内膜基底层可见有PGP 9.5标记的神经纤维存在,在腺肌病灶中也可见有神经纤维存在,且神经纤维多位于腺体和脉管周围,与其伴行;Tokushige N 等[3-4]研究发现传导慢痛的 C 类神经纤维在子宫内膜异位症(endometriosis,EMS)在位子宫内膜见表达,而非EMS患者未见表达。在小鼠的子宫内膜异位症模型的异位病灶也可见有P物质(substance P,SP)、降钙基因相关肽(calcitonin gene related peptide,CGRP)、囊泡单胺类转运体染色的纤维存在,异位灶中密集的神经纤维分布临近血管周围,神经突触沿着血管分布于子宫肌层及上皮层[5]。不仅如此,PGP 9.5本身作为泛素水解酶系统的重要成员,还参与细胞内凋亡蛋白的代谢,在细胞永生中起重要作用,与各种神经相关性疾病(如帕金森病、阿尔茨海默病等),恶性肿瘤的复发、预后相关,是独立的风险因子,在神经再生,肿瘤细胞侵入的调节方面有重要作用[6-7]。因此,ADS患者在位子宫内膜中增生的神经纤维和高度表达的神经生长因子可能为在位的子宫内膜提供了生长及侵袭所需的营养,促进在位子宫内膜发生转移及侵袭,在异位内膜持续生长、浸润周围器官起到了重要作用,但其分子机制有待进一步研究,另外ADS中神经纤维的特异性表达为其诊断提供了新的方向,比如宫腔镜下内膜活检甚至刮宫获取子宫内膜功能层行病理检查,有助于早期诊断ADS,为后续的治疗提供了更大的空间。
3.2 子宫腺肌病中神经纤维及因子与痛经的关系
神经生长因子(nerve growth factor,NGF)是最早发现的靶源性神经营养因子,产生于传入纤维的外周靶组织和支持细胞,如角质细胞、成纤维细胞和Schwann细胞。它可促进中枢及外周神经元的正常发育与分化,并对受损神经元有促再生和保护作用。NGF可以引导神经细胞触枝(neurite)的延伸,维持感觉神经元的生存、发育,并选择性的营养参与疼痛调节的小感觉神经元和交感神经节神经元;同时NGF也是疼痛外周敏感化产生的重要介质之一,它能诱导中枢疼痛的调节因子P物质(SP),降钙基因相关肽(CGRP)、神经肽的生成。缺乏NGF和其特殊受体TrKA的转基因动物出生后表现为缺乏介导伤害性疼痛的神经元和痛觉减退,而NGF过表达的动物则表现为痛觉过敏[7]。
本研究发现,PGP 9.5、NGF在ADS患者子宫内膜的表达与痛经程度成正相关,即PGP 9.5、NGF的表达越高,痛经程度越重。Barcena de Arellano M L等[8]发现子宫内膜异位症患者痛经与腹水中神经因子表达成正相关,子宫内膜异位症病灶可释放一些刺激神经纤维的分子,如肿瘤坏死因子-α(TNF-α)、PGI2、PGE2、PGF2α以及 NGF使异位病灶局部器官的神经纤维向异位病灶内生长[9];同时,子宫内膜异位症病灶也可以产生分泌许多疼痛介质,比如PGs、组胺、缓激肽、NGF和白介素等,这些疼痛介质可以刺激末梢神经纤维,产生疼痛[10],并且神经纤维密度和子宫内膜异位症相关痛经呈正相关[11],Zhang G等[12]报道子宫内膜异位症小鼠模型中卵巢囊肿周围血管和神经随着小鼠的动情周期变化,在病灶周围形成血管及神经,并且在动情前期可以诱发痛觉过敏。腺肌病灶内的神经纤维有可能是由于在位子宫内膜中本身含有神经纤维,移位至其他部位继续生长而来;也可能由于异位病灶分泌各种神经营养因子,如TNF-a、PGI2、PGE2 和 NGF 等[13],病灶周围正常组织的神经纤维受各种神经营养因子的刺激,长入异位病灶所致,并且其促进异位病灶的生长。据此推测,神经因子的增高可导致局部感觉神经纤维敏感性增高产生痛觉,且由于内脏神经冲动的传入特点,可能发生痛觉过敏的现象[14-15],病灶局部神经纤维痛觉的传入就可以表现为痛经。
[1]张立生.现代疼痛学[M].北京:河北科学技术出版社,1999:169.
[2]邱曙东.组织化学与免疫组织化学[M].北京:科学出版社,2008:47.
[3]Tokushige N,Markham R,Russell P,et al.High density of small nerve fibres in the functional layer of the endometrium in women with endometriosis[J].Hum Reprod,2006,21(3):782-787.
[4]Al-Jefout M,Andreadsis N,Tokushige N,et al.A pilot study to evaluate the relative efficacy of endometrial biopsy and full curettage in making a diagnosis of endometriosis by the detection of endometrial nerve fibers[J].Obstet Gynecol,2007,197:578.
[5]Berkley K J,Dmitrieva N,CurtisK,et al.Innervation of ectopic endometrium in a rat model of endometriosis[J].Proc Natl AcADS Sci,2004,101:11094-11098.
[6]Anderson J R,Fear M W,Phillips J K et al.A preliminary investigation of the reinnervation and return of sensory function in burn patients treated with INTEGRA[J].Burns,2011,37(7)1101-1108.
[7]Zetterberg M,Sjölander A,von Otter M,et al.Ubiquitin carboxy-terminal hydrolase L1(UCHL1)S18Y polymorphism in Alzheimer's disease[J].Mol Neurodegener,2010,5:11.
[8]Barcena de Arellano M L,Arnold J,Vercellino F,et al.Overexpression of nerve growth factor in peritoneal fluid from women with endometriosis may promote neurite outgrowth in endometriotic lesions[J].Fertil Steril,2011,95(3):1123-1126.
[9]Mechsner S,Schwarz J,Thode J,et al.Growth-associated protein 43-positive sensory nerve fibers accompanied by immature vessels are located in or near peritoneal endometriotic lesions[J].Fertil Steril,2007,88(3):581-587.
[10]Tran L V,Tokushige N,Berbic M,et al.Macrophages and nerve fibres in peritoneal endometriosis[J].Hum Reprod,2009,24(4):835-841.
[11]Mechsner S,Kaiser A,Kopf A,et al.A pilot study to evaluate the clinical relevance of endometriosis-associated nerve fibers in peritoneal endometriotic lesions[J].Fertil Steril,2009,92(6):1856-1861.
[12]Zhang G,Dmitrieva N,Liu Y,et al.Endometriosis as a neurovascular condition:estrous variations in innervation,vascularization,and growth factor content of ectopic endometrial cysts in the rat[J].Physiol Regul Integr Comp Physiol,2008,294(1):R162-171.
[13]Tokushige N,Markham R,Russell P,et al.Effects of hormonal treatment on nerve fibers in endometrium and myometrium in women with endometriosis[J].Fertil Steril,2008,90(5):1589-1598.
[14]Berkley K J,Rapkin A J,Papka R E.The pains of endometriosis[J].Science,2005,308(5728):1587-1589.

