用蛋白质组学方法分析先兆子痫孕妇血清差异蛋白表达和急性反应蛋白
刘崇东 鲁 琦 张震宇* 邓海腾
(1.首都医科大学附属北京朝阳医院妇产科,北京 100020;2.清华大学生命科学院,北京 100083)
先兆子痫是孕妇妊娠期特有的疾患,它的特点是孕20周后出现高血压及妊娠蛋白尿。在发展中国家其发病率高达9.4% ~10.4%,是导致孕产妇和新生儿死亡的首要原因[1]。子痫和先兆子痫的诊治水平与孕产妇病死率关系密切,而孕产妇病死率是评价国家卫生保健事业水平的重要指标。目前还没有一种很好的实验指标可以对先兆子痫进行早期诊断。Roberts J M等[2]的研究表明,先兆子痫是一个多系统综合征,有复杂的病理生理改变,例如:血管内皮损伤、炎性反应、凝血系统的激活和代谢的改变。目前普遍认为先兆子痫的病理生理改变是由于一些蛋白的异常表达。这些蛋白的确认对我们阐述先兆子痫的病理生理机制的分子基础有很大帮助,也可以作为先兆子痫早期诊断的生物指标。
使用蛋白质组学方法对先兆子痫患者血清的研究蛋白质进行确认,Gong L Y等[3]用SELDI-TOF-MS的方法研究,发现在妊娠高血压疾病患者与正常妊娠妇女,血清中有10个异常蛋白表达峰。Blumenstein M等[4]应用免疫沉淀技术和2D胶联合,在先兆子痫患者中发现了39个差异表达蛋白,这些蛋白与脂代谢、凝血、血管重塑、蛋白酶抑制活性和炎性反应有关。在本研究中,我们应用亲水亲脂柱(hydrophiliclipophilic balance,HLB)和多肽配体库磁珠(peptide ligand library bead,PLLB)的方法,去除血清中高表达蛋白使低含量蛋白表达丰富,对重度先兆子痫患者和正常妊娠妇女血清中的差异蛋白和一些炎性蛋白表达进行分析。
1 材料和方法
1.1 样本的收集
血清的样本均来自于2008年1~12月首都医科大学附属北京朝阳医院妇产科收治的孕晚期重度先兆子痫前期患者和正常孕足月产妇各5例,收集样本。先兆子痫的诊断根据国际高血压教育协作组对妊娠高血压的诊断标准。妊娠20周以后出现临床症状,伴有轻度头晕、头痛等;收缩压≥160 mmHg(1 mmHg=0.133 kPa),舒张压≥110 mmHg,连续 2次血压增高,每次至少间隔6 h;尿蛋白≥++,24 h蛋白尿≥5g/24 h;既往无高血压及肾脏病史;既往无先兆子痫病史。取样之前详细向患者交代取样方法、风险及样本的用途。患者充分知情并签署知情同意书。知情同意书已被首都医科大学附属北京朝阳医院伦理委员会审核通过。外周血获得的样本,静放2 h,4 000 r/min 4℃快速离心10 min。然后储存在-80℃冰箱等待分析使用。
1.2 样本准备
5份正常妊娠妇女的血清,5份重度先兆子痫患者血清分别混合在一起,等量血清120 mL,等量混合后共600 mL。600 mL血液分别用HLB和PLLB方法进行样本处理。
1.3 HLB血清处理
血清样本分别稀释到1 mL;1 mL纯水+1 mL甲醇平衡HLB柱(均购自Thermo公司);2个分离柱分别加入正常孕妇血清和重度子痫孕妇血清,1%TFA(三氟乙酸,购自美国Abcam公司)清洗2遍;收集洗脱液。
1.4 PLLB血清处理
8 mg PLLB 磁珠 (Peptide International,Lexington,NY)放入100 μL 50% 甲醇10 min,pH7.4 PBS清洗3遍;2份血清和PLLB分别在室温(22~25℃)摇摆器上培养2 h;去除未结合物质,再次用pH7.4 PBS清洗3遍;与LDS 100℃ 共培养5 min,洗脱蛋白。
1.5 蛋白的分离、胶内消化和LC/MS/MS分析
蛋白用4% ~12%Tris-Glycin梯度SDS胶 (Invitrogen,Grand Island,NY)进行分离;用考马斯亮蓝进行染色(Invitrogen,Grand Island,NY);每条带切割15个小片段,切割后片段分别根据流程进行胶内消化。每份消化产物分别进行LC-MS/MS分析。首先用Dionex 300 nano-HPLC系统进行60 min的洗脱,流速为0.25 μL/min(购自 Thermo公司),用 LTQ-Orbitrap质谱使用Xcalibur 2.0.7软件进行操作,Orbitrap(400-1800 m/z,30,000 Resolution)单一气相图谱,连接6个数据独立的MS/MS扫描。
1.6 数据处理和定量分析
每个从LC/MS/MS获得的MS/MS图谱都需从原始数据形式转化为DTA文件(Bioworker 3.3.1,Thermo-Fisher,Sanlose,CA)使用Mascot针对人类IPI database搜索DTA文件;Mascot评分>30,蛋白才被确认,并且至少有2个独立的肽段与之相匹配;应用Perl script spectral counts对每个确认的蛋白进行定量分析;2组质谱数比值大于2或小于0.5,认定为有差异。
1.7 Western blotting分析
2例孕晚期重度先兆子痫患者60 μg蛋白和2例正常孕足月妇女60 μg血清蛋白分别用 NuPAGE Novx 40 12%Bis Tris梯度胶进行分离 (Invitrogen,NY);转膜30 min;4℃封闭过夜;室温加入一抗孵育120 min;特异性抗体 RBP4和铜蓝蛋白(ceruloplasmin,CP)(Abcam,Cambriage,MA);用 TBST(0.1%Tween 20,0.01 mol/L TBS)清洗;转膜分别用与二抗(抗鼠)caruloplasmin进行孵育,用ECL显色剂曝光(Thermo,waltham,MA)。
1.8 统计学方法
所有数据使用统计学软件SPSS13.0进行统计分析处理,数值采用均数±标准差(±s)的形式表示,采用单因素方差分析法分析入选孕妇年龄、孕周、血压,以 P<0.05为差异有统计学意义。
2 结果
2.1 入选患者的一般情况
首都医科大学附属北京朝阳医院妇产科收治的孕晚期重度先兆子痫患者和正常孕足月产妇各5例。研究对象的基本情况见表1。

表1 研究对象特点Tab.1 Characteristic of the patients n=5
2.2 HLB处理血清样本后SDS梯度胶结果
样本条带显示清晰,15 000和10 000条带可见明显差异,但白蛋白区域条带分离欠佳(图1)。
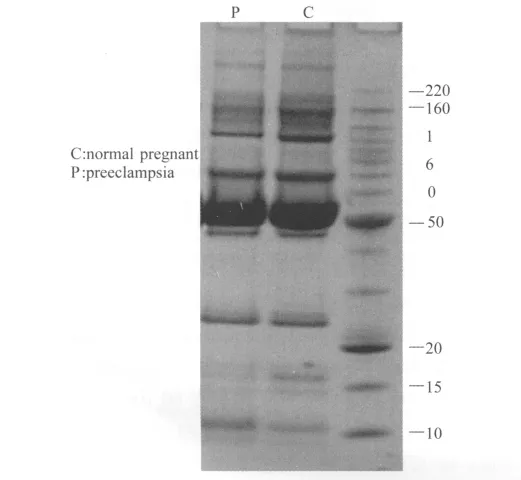
图1 HLB柱处理后的SDS-PAGE梯度胶Fig.1 SDS-PAGE treated by HLB
2.3 PLLB处理血清后SDS梯度胶结果
2组样本显示的条带相似,表明处理后2组蛋白浓度无明显改变。从PLLB洗脱后的蛋白,覆盖蛋白的相对分子质量从10 000~200 000,一些低含量蛋白也被丰富表达,但一些含量较高的蛋白水平明显减低,例如:血清中的白蛋白(大约在67 000左右),详见图2。
2.4 通过1D-LC/MS/MS对蛋白进行鉴定
在重度先兆子痫患者中共采用HLB方法鉴定326种蛋白,采用PLLB鉴定方法1 172种蛋白;在正常妊娠妇女中共HLB方法鉴定342个蛋白,采用PLLB方法鉴定1 149个蛋白,详见表2。

图2 PLLB处理后SDS梯度胶Fig.2 A-SDS-PAGE gelimage treated by PLLB

表2 PLLB和HLB通过LC/MS/MS识别出的蛋白总数差异Tab.2 Total number of proteins identified by LC/MS/MS after depeletion of abundant proteins with PLLB beads and HLB cartridge
2.5 确定重度先兆子痫患者与正常妊娠对照中差异表达的蛋白
在HLB组19种蛋白上调,PLLB组30种蛋白上调;HLB组9种蛋白下调表达,PLLB组21个蛋白下调表达(见表 3,4)。

表3 HLB和PLLB处理后蛋白上调及下调数量差异Tab.3 Up-regulated proteins and down-regulated proteins by HLB and PLLB
PLLB亲和层析结合1D胶-LC/MS/MS识别出的在先兆子痫患者和正常妊娠妇女孕晚期中表达有差异的血清蛋白,详见表4。
2.6 Western blotting分析
HLB和PLLB处理血清中,表达蛋白CP。见图2结果显示在重度先兆子痫中,CP上升。
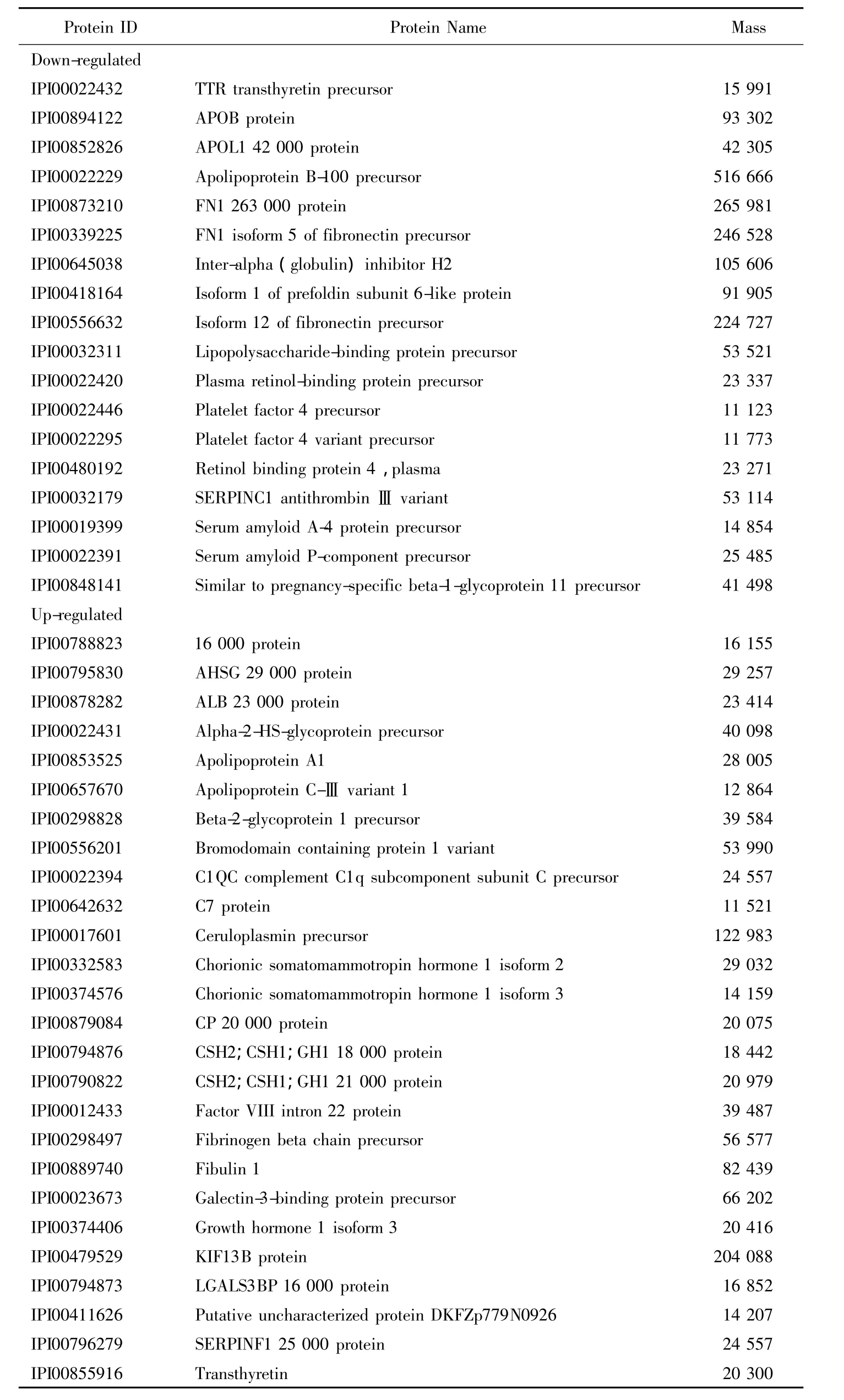
表4 差异血清蛋白Tab.4 Differently expressed proteins

图3 在重度先兆子痫中ceruleplasmin上升Fig.3 Elevated level of ceruleplasmin in serum of pregnant women with severe preeclampsia
3 讨论
随着人类基因图谱的绘制成功,蛋白质组学的出现,生物研究进入了一种后基因组时代。生物学研究从对物质活性研究为中心的时代转化到以序列研究为基础的时代。传统的生物化学研究方法是先发现物质的活性,然后进行纯化,然后再对其进行确认。随着蛋白质组学的发展,2D胶聚合质谱技术对蛋白进行捕获已从最初的假说变成了现实。但2D胶因受胶大小的限制,使很多蛋白丢失。近几年,1D胶联合LC/MS/MS对血清、尿液、和脑脊液等中的蛋白进行鉴定,取得了满意的结果。
人类血清中85%表达丰富的6种蛋白(白蛋白,IgA和IgG,免疫球蛋白亚型,转铁蛋白,结合铁蛋白)这些蛋白会覆盖那些有意义但表达含量低的蛋白。故质谱检测前需要对样本进行处理,去除表达丰富的蛋白。使一些表达含量低,但在发病中起重要作用的蛋白充分表达,使之容易检测和测定。
本研究应用PLLB联合1D-LC/MS/MS分析重度先兆子痫患者和正常妊娠妇女血清中差异蛋白的表达,发现PLLB是减少血清中高表达蛋白使低表达蛋白表达丰富的有效办法,并且有较高的重复性。用1D胶分析PLLB处理后的血清样本,在本研究中和文献中均获得满意图像。与其他亲和洗脱方法相同,PLLB可以使亚蛋白质组表达丰富,主要通过多肽六聚体选择性与蛋白相结合。不能与多肽六聚体结合的蛋白不能保留在磁珠上。用PLLB处理血清,重度先兆子痫患者和正常妊娠妇女相比,有51种蛋白出现差异表达。
在差异表达蛋白中,有多种蛋白与急性炎性反应有关,如 ApoA2,ApoH,SAA4,CP,TRIMS,IL-17F等。在重度先兆子痫妇女血清中CP和IL-17F明显上调。
Sacks G P等[8]通过流式细胞学研究认为,正常妊娠过程中的炎性反应是通过血清中IL-6和TNF-a浓度升高,激活中性粒细胞中的单核细胞,Cosmi L等[9]研究表明,IL-17F 来源于 CD161+,CD4+自然杀伤细胞,IL-17F作为多效性细胞因子作用在免疫和非免疫细胞上,在很多细胞上都有IL-17的受体,例如成骨细胞、纤维细胞、血管内皮细胞等[10]。IL-17配体在体外可诱导IL-6和IL-8的产生,刺激T细胞增生和很多前炎性分子的上调;进而产生一系列免疫反应,在宿主免疫防御中起到重要作用[11-12]。Borekci B等[13]研究认为先兆子痫孕妇与正常妊娠孕妇相比,血清TNF-a和IL-6浓度升高,尤其在重度先兆子痫孕妇中升高更加明显[14]。IL-6升高只通过先升高IL-17F,然后使IL-6升高,尚需进一步验证。循环中CP含有1 046氨基酸蛋白,查对分子质量大约在133 000[15],是一种急性期反应蛋白,在感染、组织损伤、炎性细胞因子介导中血清明显增高[16]。在本研究中,通过HLB和PLLB方法证明CP在重度子痫孕妇中明显增高,并且通过Western blotting验证,与既往研究结果相似。
先兆子痫是一种影响多器官的疾病,目前病因尚不清楚,氧化应激和炎性因子的作用引起血管内皮的损伤,导致先兆子痫及相应心血管疾病的发生,可能是一种主要的发病机制。前炎性细胞因子的主要生物活性,包括炎性反应和对内皮细胞活性的影响,先兆子痫患者血清中炎性因子的增加,可能是引起疾病症状的原因,也可能是疾病发生后产生的结果。
总之,本研究结果表明,PLLB结合1D-LC/MS/MS分析重度先兆子痫患者与正常妊娠妇女血清中差异表达蛋白是一种有效地方法,一些急性反应因子可能与先兆子痫的发病机制相关。
[1]Laivuori H.Genetics aspects of preeclampsia[J].Front Biosci,2007,12:2372-2382.
[2]Roberts J M,Lain K Y.Recent insights into the pathogenesis of pre-eclampsia[J].Placenta,2002,23(5):359-372.
[3]Gong L Y,Zhang Z Y,Zheng Y H,et al.Study of a serum protein fingerprint diagnostic model in patients with hypertensive disorder complicating pregnancy[J].Chin J Obstet Gynecol,2007,42(1):822-825.
[4]Blumenstein M,McMaster M T,Black M A,et al.A proteomic approach identifies early pregnancy biomarkers for preeclampsia:novel linkages between a predisposition to preeclampsia and cardiovascular disease[J].Proteomics 2009,9(11):2929-2945.
[5]Li L,Sun C J,Freeby S,et al.Protein sample treatment with peptide ligand library:coverage and consistency[J].J Proteomics Bio,2009,2(12):485-494.
[6]Castagna A,Cecconi D,Sennels L,et al.Exploring the hidden human urinary proteome via ligand library beads[J].J Proteome Res,2001,4(6):917-930.
[7]Guerrier L,Claverol S,Fortis F,et al.Exploring the platelet proteome via combinatorial,hexapeptide ligand libraries[J].J Proteome Res,2007,6(11):4290-4303.
[8]Sacks G P,Studena K,Sargent K,et al.Normal pregnancy and preeclampsia both produce changes in peripheral blood leukocytes akin to these of sepsis[J].Am J Obstet Gynecol 1998,179(1):80-86 .
[9]Cosmi L,De Palma R,Santarlasci,et al.Humans interleukin-17 producing cells originate from a CD 161+CD4 T cell precursor[J].J Exp Med,2008,205(8):1903-1915.
[10]Toy D,Kugler D,Wolfson M,et al.Cutting edge:interleukin 17 signals through a heteromeric receptor complex[J].J Immunol,2006,177(1):36-39.
[11]Kolls J K,Linden A.IL-17 family members and inflammation[J].Immunity,2004,21(4):467-476.
[12]Curtis M M,Way S S.Interleukin-17 in host defence against bacteria,mycobacterial and fungal pathogens[J].Immunology,2009,126(2):177-185.
[13]Borekci B,Aksoy H,AL R A,et al.Maternal serum interlenkin-10,interleukin-2 and interleukin-6 in preeclampsia and elampsia[J].J Am Reprod Immunol,2007,58(1):56-54.
[14]Tosun M,Celik H,Avei B,et al.Malatyaliogla,Maternal and umbilical serum levels of interleukin-6,interleukin-8,and tumor nerosis factor-a in normal pregnancy and in pregnancies complicated by preeclampsia[J].J Matern Fetal Neonatal Med,2010,23(8):880-886.
[15]Hellman N E,Gitlin J D.Ceruloplasmin metabolism and function[J].Annu Rev Natr,2002,22:439-458.
[16]Barber E F,Cousins R J.Interleukin-1-stimmLated induction of ceruloplasmin synethesis in normal and copper rats[J].J Nutr,1988,118(3):375-381.

