人宫颈癌侧群细胞的分选及其生物学特性的研究
宋菁华 王克芳 李 斌 张 军
(首都医科大学附属北京安贞医院妇产科,北京100029)
宫颈癌是发生于全球妇女中仅次于乳腺癌的最常见的恶性肿瘤,全世界每年大约有50万例新发宫颈癌病例,每年近30万死亡病例,中晚期患者5年生存率很低[1]。目前宫颈癌病因尚未完全明了,在基础研究领域,宫颈癌发病的分子机制始终是研究的热点和难点。近年来,随着肿瘤干细胞学说[2]的提出,以及越来越多的肿瘤干细胞(cancer stem cells,CSC;或tumour stem cells,TSC)相继在肿瘤组织中分离成功,为肿瘤研究提供了新的途径。侧群细胞(side population cells)即SP细胞是指一小群可以将脂溶性DNA结合染料(即Hoechst 33342)排出细胞外的细胞,在流式分选的散点图中,这些细胞处于大多数细胞的一侧。研究[3]显示,SP细胞具有干细胞特性。尽管目前各学科对肿瘤干细胞的研究进行得如火如荼,但在宫颈癌中,无论是针对宫颈癌干细胞的研究还是针对宫颈癌侧群细胞的研究,都处在起步阶段。本课题立足于肿瘤干细胞学说,拟通过宫颈癌细胞中侧群细胞的富集、分离和鉴定,确定其肿瘤干细胞特性,探讨以侧群细胞作为宫颈癌干细胞研究切入点的可行性,为进一步研究宫颈癌干细胞的靶向治疗策略奠定基础。
1 材料与方法
1.1 实验材料
1)标本来源:选取2009年12月至2010年12月于首都医科大学附属北京安贞医院妇产科施行宫颈癌手术的病例标本40例(均经患者或委托人知情同意),其中鳞癌32例、腺癌6例、恶性腺瘤1例、腺鳞癌1例。40例标本中高分化癌5例、中分化癌23例、低分化癌12例。肿瘤均为原发性,术前均未进行放疗和化疗,所有标本均经北京安贞医院病理科2名以上有经验的病理科医师确诊为宫颈癌并按国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)2009年宫颈癌的临床分期标准进行分期。所有标本均在手术切除后30min内取材并送实验室。
2)实验动物:雌性非肥胖型糖尿病/重症联合免疫缺陷(non-obese diabetic/severe combined immunodeficiency,NOD/SCID)小鼠,4~6周龄,购买并饲养在北京大学医学院实验动物科学部[实验动物合格证号:SCXK(京)2006-0008]。
3)实验试剂:DMEM/F12 1:1培养基购自Hyclone公司,胎牛血清(FBS)购自Gibco公司,0.25%胰蛋白酶-EDTA消化液、青链霉素混合液购自Solarbio公司,碘化丙咤(Pl)、维拉帕米(verapamil hydrochloride)、Hoechst 33342、二甲基亚砜(DMSO)、四甲基噻唑蓝(MTT)和胶原酶I购自Sigma-Aldrich公司,磷酸盐缓冲液(PBS)购自贝博生物公司。
1.2 实验方法
1)宫颈癌细胞原代培养及细胞传代:术中在新鲜肿瘤组织边缘无坏死、钙化及电凝部位无菌取材,置于培养基中(DMEM/F12,内含10%FBS)。修剪去除坏死组织及残余血管,用PBS冲洗3遍,将组织块剪碎,经0.14%Ⅰ型胶原酶和0.25%胰蛋白酶-EDTA 37℃分别消化30min,100μm滤网过滤去渣,4℃下1 000 r/min离心10min,弃上清,收集含细胞的沉淀,移至培养瓶中,以含有10%FBS、100U/mL青霉素、100mg/mL链霉素的DMEM/F12培养基在37℃、5%CO2饱和湿度培养箱中培养48h,洗掉未贴壁细胞继续培养。从取材到接种在2h内完成。原代培养3~5d时行第1次换液,以后每3~4 d半量换液1次,每7d按1∶2传代。
2)流式分选:选取处于对数生长期的细胞,0.25%胰蛋白酶-EDTA消化,将细胞浓度调整为1×106/mL。向实验组及对照组细胞悬液中加入Hoechst 33342至终浓度为5μg/mL,对照组在加入 Hoechst 33342前加拮抗剂维拉帕米至终浓度50μg/mL,避光,于 37℃孵育90min,每隔 15min混匀 1次。4℃1 000 r/min离心10 min,去上清,预冷的PBS洗涤细胞1遍。以含2%FBS的PBS重悬,经40μm滤网过滤后于4℃下存放至检测。碘化丙啶(PI)染色标记死亡细胞,过流式细胞仪前5min加入PI至终浓度1μg/mL,。将制备好的细胞悬液入流式细胞仪,检测SP细胞的比例。参数如下:激发波:HOE:UV(351-364)HOE blue:450 HOE red:675 Pl:488nm。为了剔除因维拉帕米未能完全拮抗带来的可能误差,SP细胞的比例取实验组与对照组之间的差值。在相同波长条件下,对已通过检测的细胞悬液进行分选,得到宫颈癌侧群(SP)细胞和非侧群(NSP)细胞亚群。
3)宫颈癌SP和NSP细胞生物学功能鉴定
①细胞生长曲线:将新鲜分离的SP和NSP细胞分别接种于96孔板,1 000个细胞/孔,分别接种32孔,每孔加入200 μL完全培养基,置于37℃、5%CO2饱和湿度培养箱中培养;24h后,SP和NSP细胞各取4孔,分别加入50mg/mL的MTT 20 μL,置37 ℃、5%CO2饱和湿度培养箱4h;取出培养板,吸净培养液及MTT,每孔加入 DMSO 150 μL,摇床震荡 10min,酶标仪读OD490值;每24 h测1次OD490值,每次SP和NSP各4孔,连续测8 d,4孔OD490的平均值即为当天细胞的OD值;实验共重复3次。取3次实验的平均数绘制生长曲线。
②裸鼠移植瘤试验:选取4~6周龄NOD/SCID雌性裸鼠32只,采用抽签法随机分为8组,每组4只。按照三级动物要求,饲养在25℃恒温无特定病原体(specific pathogen free,SPF)屏障系统内,12 h光照和12 h黑暗交替,自由进食标准颗粒饲料及饮水。将新鲜分离的SP和NSP细胞离心,PBS重悬,计数,以PBS调整细胞密度为 1×103、1×104、1 ×105、1×106/mL,将不同密度SP和NSP细胞各0.1 mL接种于裸鼠右侧背部皮下,每种细胞每个数量级接种4只裸鼠,观察8周。
③化疗药物敏感性分析:化疗药物选择顺铂。将新鲜分离的SP和NSP细胞接种至96孔板,1 000个细胞/孔,加入200 μL完全培养基,置于37 ℃、5%CO2饱和湿度培养箱中培养;吸净培养基,分别加入不同终浓度的顺铂(0、12.5、25、50、100、200μg/mL),每个浓度设3个复孔,其中0浓度为无药对照,另设3孔只加培养液不加细胞作为调零孔。每孔培养基调整为200μL,置于37℃、5%CO2饱和湿度培养箱中继续培养24 h;从培养箱中取出96孔板,每孔加入已配置好的MTT 20 μL,37℃、5%CO2饱和湿度培养箱中继续孵育4 h;弃去上清,每孔加入DMSO 150 μL,于振荡器上振荡10 min,使其彻底溶解混匀;酶标仪读OD490值,以只加培养液不加细胞的孔作为调零孔进行调零,取3个复孔的均值为实验结果。计算细胞增生抑制率:细胞增生抑制率=1-实验组OD值/无药对照组OD值;实验重复3次,取3次抑制率的平均值。
1.3 统计学方法
所有数据分析用SPSS 11.5软件完成,数据以均数±标准差±s)表示,统计学处理分别采用t检验、χ2检验、方差分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 人宫颈癌细胞形态
光学显微镜下,宫颈癌细胞形态符合病理学描述(图1),符合本研究需要。

图1 人宫颈癌细胞Fig.1 Human cervical cancer cells(100×)
2.2 宫颈癌SP细胞流式检测结果
人宫颈癌细胞染色后去除PI阳性的死细胞,分析状态良好的活细胞Hoechst 33342荧光染色情况。流式细胞仪可检测到宫颈癌细胞中SP细胞的存在比例约为0.90% ~3.40%(2.04% ±0.93%),加入维拉帕米的对照管SP细胞比例下降至0%或接近0%的水平(图2)。不同分化程度的宫颈癌细胞分别检测,差异具有统计学意义(P<0.05),即在检测的高、中、低分化的宫颈癌细胞中,SP细胞比例与分化程度有关,分化程度越差者其SP细胞比例越低,详见表1。
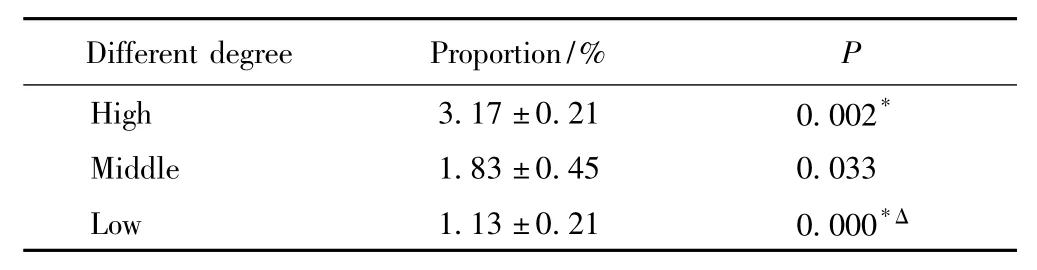
表1 不同分化程度宫颈癌细胞SP比例Tab.1 Proportion of the SP cells with different degree of cervical cancer cells
2.3 细胞生长曲线
MTT法绘制细胞生长曲线,结果显示:SP细胞与NSP细胞相比生长速度较快,从第3天开始,SP细胞开始大量增生,尤其是第5天起,SP细胞明显进入指数增长期,而NSP细胞增生缓慢(图3)。SP细胞和NSP细胞的增生能力差异有统计学意义(P<0.05)。
2.4 裸鼠成瘤效果
实验结果显示,SP细胞和NSP细胞的致瘤能力差异有统计学意义(表2),仅1×103个SP细胞即可形成肿瘤,平均成瘤时间(13.27±2.61)d。而至少1×105个NSP细胞才能形成肿瘤,平均成瘤时间(18.50±1.52)d。相同数量的SP细胞在同一观察时间点可以形成更大的肿瘤,且形成肿瘤的潜伏期较短。
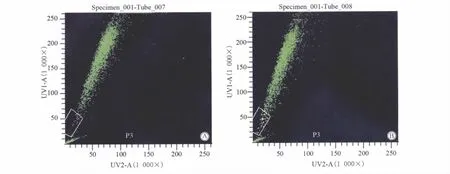
图2 人宫颈癌SP细胞流式检测图Fig.2 Expressions of cell related markers in human cervical cancer cells as detected by flow cytometry A:Hoechst 33342;B:Hoechst 33342 and verapamil;SP:side population.
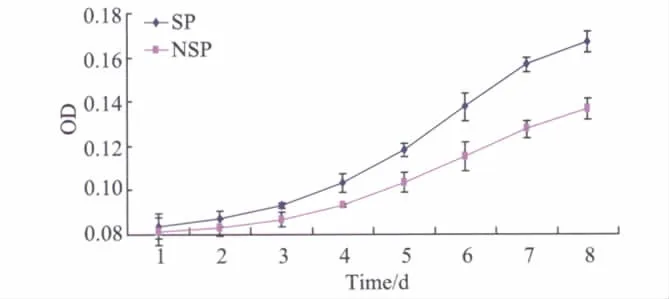
图3 宫颈癌SP和NSP细胞生长曲线Fig.3 Cell growth curve of SP cells and NSP cells
2.5 化疗药物敏感性分析
将SP细胞和NSP细胞分别在不同浓度的化疗药物中作用24h后,应用MTT法检测细胞存活状况。结果显示:化疗药物作用后,SP和NSP细胞均出现一定程度的细胞死亡,但SP细胞表现出较强的耐药性,只出现少量细胞死亡,而NSP细胞存活明显减少,细胞增生抑制率显著升高,差异具有统计学意义(P<0.05),见表3。
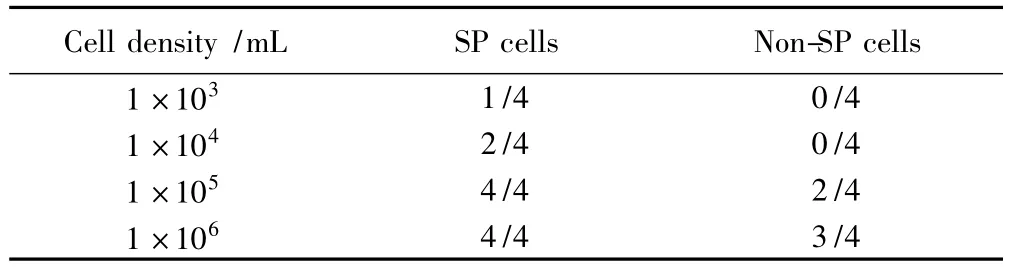
表2 宫颈癌SP和NSP细胞裸鼠的成瘤性情况Tab.2 Tumorigenicity of SP cells and NSP cells in nude mice
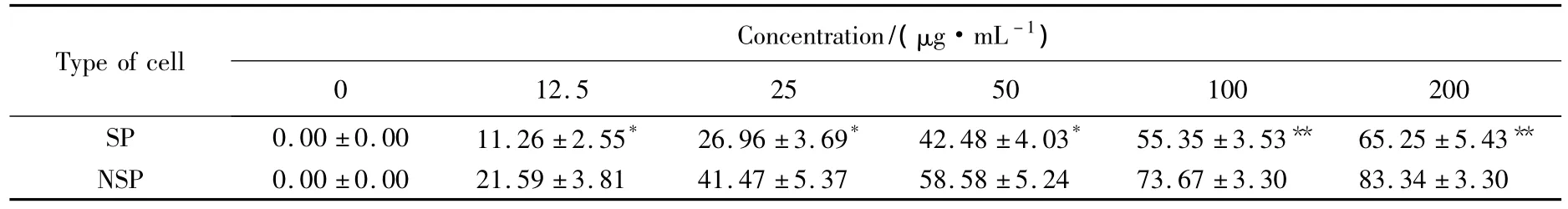
表3 宫颈癌SP和NSP细胞增生抑制率情况Tab.3 Inhibition rates of SP cells and NSP cells n=9,%
3 讨论
肿瘤干细胞是存在于肿瘤中的一小部分具有干细胞性质的细胞群,具有自我更新能力,能够分化成不同表型的肿瘤细胞,使肿瘤在体内不断扩大或形成新的肿瘤。除此之外的其他绝大多数肿瘤细胞没有或仅有有限的增生能力,经短暂的分化增生后即发生凋亡。肿瘤干细胞的分离和鉴定最初来源于血液系统恶性肿瘤,而实体肿瘤细胞较难以分离。目前肿瘤干细胞的分离和培养主要有2种方法,即通过细胞表面特异性标记进行分选和侧群(SP)细胞分选法。组织特异性干细胞的严格分离鉴定只在少数组织中完成,许多实体组织自身的干细胞表面标志物尚未确定,故限制了此方法的应用。SP细胞作为一个特殊的细胞亚群,其发育和分化状态可能介于胚胎干细胞和成体干细胞之间,具有很强的多向分化潜能和增生特性,且有较明确的表型标记和分离纯化方法,以SP细胞作为切入点来进行宫颈癌干细胞筛选,可望为进一步深入研究宫颈癌干细胞建立基础。
本研究选用宫颈癌原代培养细胞进行流式分选,为了剔除因维拉帕米未能完全拮抗带来的可能误差,SP细胞的比例取实验组与对照组之间的差值。结果显示,宫颈癌细胞中存在一定数量的SP细胞,比例约为0.90% ~3.40%(2.04% ±0.93%),并可被维拉帕米阻断,阻断后 SP细胞比例减少至0~0.60%(0.28%±0.20%)。SP细胞的比例随分化程度的降低而下降,差异具有统计学意义(P<0.05)。迄今,有关肿瘤分化程度与SP细胞比例的关系报道较少,且意见不一。Brown M D等[4]研究前列腺肿瘤时发现,肿瘤分化程度越高,其SP细胞比例越高。而Wu C等[5]发现分化不良的间叶源性肿瘤中的SP细胞比例高于分化良好的肿瘤细胞。目前对这一现象仍缺乏公认的解释,推测出现上述差异的原因可能有:①分化较差的宫颈癌细胞中SP细胞的增生能力和自我更新能力可能更强,故只需较低比例的SP细胞即可维持肿瘤的恶性生物学行为;②分化较差的宫颈癌细胞中NSP细胞的增生能力可能更强,在SP细胞绝对数相似的情况下,NSP细胞的绝对数较大,从而导致其SP细胞的相对比例下降。
作为一个特殊的细胞亚群,SP细胞具备自我更新能力和高致瘤性。Xu J X等[6]研究发现SP细胞的扩增倍数可以达到1 000~5 000倍,而NSP细胞的扩增有时甚至不能达到2倍。为了探讨分选出的SP细胞是否具有肿瘤干细胞特性,我们进行了一系列的实验。采用MTT法检测SP细胞和NSP细胞的增生能力,发现SP细胞的增生能力显著强于NSP细胞,2组差异具有统计学意义(P<0.05)。实验结果表明,与宫颈癌NSP细胞相比,宫颈癌SP细胞具有更强的增生能力。在脑胶质瘤[7]、神经母细胞瘤[8]、鼻咽癌[9]、乳腺癌[10]、肝癌[11]等多种肿瘤的研究中均有类似发现。但也有学者对这一现象提出质疑,认为NSP细胞在分选后增生较差,可能与分选采用的Hoechst 33342对NSP细胞的毒性作用有关[12],然而,Hoechst 33342 染料的半衰期较短,且在分裂过程中难以大量传入子代细胞中而影响其增生[13],单纯以Hoechst 33342染料的毒性作用来解释上述现象难以令人信服。为了探求宫颈癌SP细胞的致瘤能力,我们采用NOD/SCID小鼠行皮下接种成瘤实验,把不同数量级的SP和NSP细胞移植到NOD/SCID小鼠皮下,发现SP细胞的成瘤能力明显强于NSP细胞。
大量临床和基础研究[2,7-8]显示,各种肿瘤对化疗药物的敏感性不一,许多肿瘤经过手术和药物治疗,肿瘤已经几乎消失,但是,很快又复发了。根据干细胞学说[14],干细胞一般对化疗药物耐药,能够排除化疗药物的毒性,从而成功逃避化疗药物的作用,从而存活下来。虽然大部分肿瘤细胞被杀死了,但是只要肿瘤干细胞还存在,肿瘤就会很容易复发。因此探讨肿瘤细胞的耐药性,寻找肿瘤复发的原因,为肿瘤化疗提供新的靶点,具有重要的临床意义。由于在部分组织中SP细胞表型产生的主要因素是ABCG2/BCRP1的表达,而ABCG2/BCRP1又是主要的耐药蛋白[15],故我们推测,SP细胞可能和宫颈癌的化疗耐药相关。我们用MTT法检测化疗药物顺铂对SP和NSP细胞生长的作用,发现顺铂对NSP细胞的生长抑制明显,对SP细胞的生长抑制不明显,差异具有统计学意义(P<0.05)。这个结果支持SP细胞可能和宫颈癌化疗耐药相关的假设。
本研究应用流式细胞仪分选宫颈癌SP细胞,经各种体内、外鉴定实验证实,宫颈癌SP细胞具有肿瘤干细胞的生物学特性,生长速度快,自我更新和分化能力强,且具有强大的致瘤性和耐药性,可作为宫颈癌干细胞研究的切入点,为宫颈癌干细胞的靶向治疗深入研究提供了实验基础。
[1]丰有吉,沈铿.妇产科学[M].北京:人民卫生出版社,2010:316-322.
[2]Reya T,Morrison S J,Clarke M F,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
[3]Fong D,Yeh A,Naftalovich R,et al.Curcumin inhibits the side population(SP)phenotype of the rat C6 glioma cell line:towards targeting of cancer stem cells with phytochemicals[J].Cancer Lett,2010,293(1):65-72.
[4]Brown M D,Gilmore P E,Hart C A,et al.Characterization of benign and malignant prostate epithelial Hoechst 33342 side population[J].Prostate,2007,67(13):1384-1396.
[5]Wu C,Wei Q,Utomo V,et al.Side population cells isola-ted from mesenchymal neoplasms have tumor initiating potential[J].Cancer Res,2007,67(17):8216-8222.
[6]Xu J X,Morii E,Liu Y,et al.High tolerance to apoptotic stimuli induced by serum depletion and ceramide in sidepopulation cells:high expression of CD55 as a novel character for side-population[J].Exp Cell Res,2007,313(9):1877-1885.
[7]Kondo T,Setoguchi T,Taga T,et al.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line[J].Proc Natl Acad Sci USA,2004,101(3):781-786.
[8]Hirschmann-Jax C,Foster A E,Wufl G G,et al.A distinact“side population”of cells with high drug efflux capacity in human tumor cells[J].Proc Natl Acad Sci USA,2004,101(39):14228-14333.
[9]Wang J,Guo L P,Chen L Z,et al.Identifieation of Caneer stem cell-like side population cells in human nasopharyngeal carcinoma cell line[J].Semin Cancer Res,2007,67(8):3716-3724.
[10]Christgen M,Ballmarier M,Bruchhardt H,et al.Identification of a distinct side population of cancer cells in the Cal-51 human breast carcinoma cell line[J].Mol Cell Bioehem,2007,306(1):201-212.
[11]张毅,窦科峰,宋文杰,等.MHCC97中边缘群细胞的成瘤性及其侵袭性观察[J].第四军医大学学报,2008,29(3):252-254.
[12]Zheng X,Shen G,Yang X,et al.Most C6 cells are cancer stem cells:evidence from clonal and population analyses[J].Cancer Res,2007,67(8):3691-3697.
[13]Reders R P,Li A,Kaur P.Side population in adult murine epidermis exhibits phenotypic and functional characteristics of keratinocyte stem cells[J].Proc Natl Acad Sci U S A,2006,103(35):13168-13173.
[14]Shackleton M.Normal stem cells and cancer stem cells:similar and different[J].Semin Cancer Biol,2010,20(2):85-92.
[15]Zhou S,Morris J J,Barnes Y,et al.Bcrp1 gene expression is required for normal numbers of side population stem cells in mice,and confers relative protection to mitoxantrone in hematopoietic cells in vivo[J].Proc Natl Acad Sci USA,2002,99(19):12339-12344.

