白色念珠菌拮抗酵母菌的分离、筛选及其鉴定
李梦琳,王亚东,林 梦,毕福广,权春善
(大连民族学院生命科学学院,辽宁 大连 116600)
白色念珠菌(Candida albicans)又称白假丝酵母菌,广泛存在于自然界及正常人的口腔、上呼吸道、肠道及阴道中,为常见的条件致病性真菌[1]。机体在菌群失调、免疫力降低等情况下,转化为致病性念珠菌,引起鹅口疮、口角炎、阴道炎、肺炎、肠胃炎、心内膜炎、脑膜炎、脑炎、败血症等多种疾病。近年来,白色念珠菌已成为医院真菌感染最常见的致病菌之一,尤其是人体免疫缺陷导致的念珠酵母菌感染成为近年来恶性肿瘤患者死亡的主要原因之一[2]。因此,加强对白色念珠菌感染的治理已不容忽视。目前,治疗白念珠菌感染的最常用方法就是使用广谱抗生素,如制霉菌素、酮康唑、克霉唑等,但这些抗生素的使用造成了菌体的极大抗药性,致使药物对白色念珠菌的疗效降低或无效,影响恶性血液病患者的治疗效果,甚至可以导致患者死亡[3]。本研究通过对构树果实酵母菌的分离、筛选及初步鉴定,找到了1株能够有效抑制白色念珠菌生长繁殖的拮抗酵母菌,其拮抗效果稳定、持久,为治疗白色念珠菌感染的肿瘤患者等高危人群的新型药物开发研究提供了依据。
1 材料与方法
1.1 材料
1.1.1 供试材料 构树果实:采自大连民族学院。白色念珠菌:大连民族学院生命科学学院微生物保藏室提供。
1.1.2 培养基 ①YEPD液体培养基(质量体积比):葡萄糖 0.2%,蛋白胨 0.2%,酵母浸粉0.1%,pH 6.0;②马铃薯葡萄糖琼脂培养基:马铃薯 200 g,葡萄糖 20 g,琼脂 20 g,纯水 1.0 L,pH自然;③同化碳源基础培养基(质量体积比):(NH4)2SO40.5%,KH2PO40.1%,MgSO4·7H2O 0.05%,酵母浸粉0.02%;④同化氮源基础培养基(质量体积比):葡萄糖2.0%,KH2PO40.1%,MgSO4·7H2O 0.05%,酵母浸粉 0.02%,KNO30.78%,对照组不添加 KNO3而添加(NH4)2SO40.78%;⑤产生类淀粉化合物培养基(质量体积比):(NH4)2SO40.5%,KH2PO40.1%,MgSO4·7H2O 0.05%,CaCl2· 2H2O 0.01%,NaCl 0.01%,葡萄糖3.0%,酵母浸粉 0.1%;⑥糖发酵基础培养基:干酵母粉6 g,纯水1.0 L,pH自然;⑦高渗透压培养基和麦芽汁液体培养基组成参见文献[4]。
1.1.3 试剂巯基乙醇、EDTA、K2HPO4、KH2PO4、山梨醇、柠檬酸钠、蜗牛酶、卡那霉素、Trans8K DNA Marker、RNase A由北京全式金生物技术公司提供,其他试剂均使用分析纯。
1.2 方法
1.2.1 构树果实酵母菌的分离 采摘成熟构树果实3枚放入无菌锥形瓶中,常温保存3 d,加入200 mL已灭菌的0.85%氯化钠,振摇果实至溶液浑浊。然后取 1 mL 分别稀释 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8倍,从稀释倍数为10-4开始分别取100 μL涂于含卡那霉素的YEPD固体培养基中,28℃下培养3 d。将形成的不同的菌落进行移种,并挑取单菌落,镜检,通过其形态特征,确定其是酵母菌,进行平板划线纯化[5]。
1.2.2 拮抗酵母菌抗菌活性研究 取新培养的白色念珠菌液体培养液稀释1000倍后,吸取20 μL均匀涂于YEPD固体培养基上[6],使用打孔器在培养基中间位置打孔,并吸取200 μL新培养的酵母菌培养液于孔内,28℃温箱中培养3 d后观察是否出现抑菌圈。
1.2.3 抗白色念球菌酵母菌的鉴定 ①形态特征观察及培养特征[7-9]:a.细胞形态:将新培养的酵母菌接种于YEPD固体培养基上,置28℃温箱中培养3 d,用接种环以无菌操作法分别挑取菌落少许,制成水浸片,置显微镜下观察细胞的形态,并测量其大小;b.子囊孢子的形成和形态:在麦芽汁平板上培养3 d后,接种在麦氏培养基上培养1周,然后显微观察是否形成子囊孢子;c.培养特征(群体特征):取新培养酵母,移种于麦芽汁液体中,置28℃温箱中培养3 d后观察是否发酵,培养液清浊程度,是否形成浮膜、环或岛,沉淀物的疏松或紧密等。将酵母菌于YPD固体培养基上28℃培养2 d,用相机对生长出的酵母菌单菌落进行拍照;②生理生化测定:糖发酵测试、碳源同化测试、肌醇同化测试、耐高渗透压的测试和类淀粉化合物的形成试验均按照文献[10-11];③酵母菌基因组DNA的提取:将酵母菌接种于YEPD液体培养基中,28℃、140 r/min的恒温摇床过夜培养16~18 h,严格控制培养时间,使酵母菌达到对数生长期[12]。吸5 mL菌液分次加入到1.5 mL离心管中,室温10000 r/min离心1 min,收集菌体,弃上清。加无菌水500 μL洗涤菌体,10000 r/min离心1 min,弃上清后,重复洗涤2次。加500 μL巯基乙醇溶液重悬菌体,37℃水浴处理20 min,期间轻轻颠倒离心管2~3次,10000 r/min离心1 min,弃上清后加入500 μL SCPB缓冲液,悬浮菌体。加过滤除菌后的200 μL蜗牛酶溶液,37 ℃水浴60 min,13000 r/min 离心2 min,弃上清。加SE缓冲液500 μL洗涤沉淀,并吹打悬浮,10000 r/min离心1 min,弃上清,重复洗涤5~6次。加500 μL裂解液,65℃水浴30 min。加5 mol/L KAc溶液200 μL,冰浴60 min 后,4 ℃下12000 r/min离心15 min。将上清转移至新离心管中,加入等体积酚-氯仿-异戊醇,剧烈震荡,4℃,12000 r/min离心10 min,吸上清至新离心管中,重复上步一次。加等体积冷异丙醇,-20℃静置10 min,4 ℃,12000 r/min 离心10 min,弃上清;用70%冷乙醇洗涤沉淀2~3次,室温晾干沉淀。加TE缓冲液50 μL溶解沉淀后加入5 mg/mL RNase A 2 μL,37 ℃保温 30 min,自然冷却后4℃保存[13];④酵母菌DNA电泳检测:提取基因组采用琼脂糖凝胶电泳方法测定样品中DNA的浓度和纯度,提取基因组样品5 μL上样于1.0%的琼脂糖凝胶,Gel Red染色,100 V电压电泳约30 min,凝胶成像仪下观察其条带;⑤PCR扩增18S rDNA片段:采用酵母18S rDNA通用引物扩增目标片断。扩增正向引物P1序列为5'-ATCTGGTTGATCCTGCCAGT-3';反向引物 P2序列为5'-GATCCTTCCGCAGGTTCACC-3'。引物由上海生物工程公司合成,扩增目标产物约为2000 bp。PCR 反应体系(50 μL):10 ×PCR 缓冲液 5 μL,dNTP 4 μL,Taq DNA 聚合酶 0.25 μL,引物各 1 μL,模板 DNA 1 μL,其余用无菌水补足。PCR 反应条件:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸3 min,30个循环;72℃延伸10 min[14]。PCR扩增产物经纯化并电泳检测后,由上海英骏生物技术有限公司测序。
1.2.4 系统进化树的构建和分析 将测得的18S rDNA序列用BLAST软件在GenBank数据库中进行相似性搜索,选取同源性较高的序列,用Clustal X 1.81进行多序列比对,利用软件中的邻位相接法(Neighbor-Joining)进行聚类分析并构建系统进化树,重复次数设为1000。
2 结果与分析
2.1 拮抗酵母菌的筛选结果及形态特征
从腐败构树果实样品中进行酵母菌分离纯化,得到15株酵母菌,并从中筛选得到1株白色念珠菌的拮抗酵母菌LM-1,其在筛选培养基上能够产生明显的抑菌圈(图1a)。LM-1细胞呈卵圆形、多边芽殖,具有不同形态的芽细胞(图1b),并能进行有性生殖,每个子囊内含子囊孢子3~4个,子囊孢子呈帽形(图1c)。LM-1菌株在麦芽汁液体培养基中发酵,培养液混浊,不形成浮膜、环和岛,锥形瓶底部有较多沉淀,沉淀物紧密;而菌落呈圆形,乳白色,直径3~4 mm,表面光滑,湿润稍透明,边缘整齐,与培养基不结合,单个分散(图1d)。

图1 酵母菌LM-1对白色念珠菌的抑制作用和形态特征Fig.1 Antifungal activity and the morphology of the LM-1
2.2 生理和生化鉴定
2.2.1 糖发酵试验结果 菌株LM-1不能利用葡萄糖、麦芽糖、半乳糖、乳糖、蔗糖、棉子糖进行发酵,产生CO2,如表1所示。

表1 糖发酵试验结果Table 1 The result of sugar fermentation test
2.2.2 碳源、氮源同化及其他生理生化特性 菌株LM-1不能利用葡萄糖、麦芽糖、半乳糖等6种糖类进行发酵,但能同化这6种糖类和糖类以外的有机物,如乙醇、可溶性淀粉等。同时菌株LM-1能同化硝酸盐和肌醇,但不耐高渗透压,且可在37℃培养条件下正常生长、繁殖,如表2所示。
2.2.3 类淀粉化合物形成测定 通过向培养液中添加卢戈氏碘液发现,溶液没有颜色变化,表明该酵母菌没有合成类淀粉化合物。
2.3 LM-1酵母菌的细胞形态和生理生化鉴定结果
通过与已经鉴定的酵母菌标准菌株菌落和细胞形态相比[15],LM-1酵母菌与有孢汉逊酵母属(Hanseniaspora sp.)、拟 威 克 酵 母 属 (Wickerhamiella sp.)和油脂酵母属(Lipomyces sp.)亲缘关系最近。

表2 碳源、氮源同化及其他生理生化特性Table 2 Carbon and Nitrogen assimilation and other physiological and biochemical characteristics of the isolates
2.4 分子生物学鉴定
2.4.1 LM-1基因组DNA质量检测 LM-1基因组DNA样品的电泳结果见图2所示,提取的基因组条带整齐明亮,无拖尾现象,说明样品基因组所含杂质较少,其质量约为50 ng/μL。
2.4.2 LM-1菌株18S rDNA PCR扩增产物的电泳结果 PCR扩增完成后,使用1%的琼脂糖凝胶电泳检测PCR产物,结果见图3所示,其基因组扩增后所得的目的片段条带清晰且较亮,片段大小约为2000 bp 左右[16]。
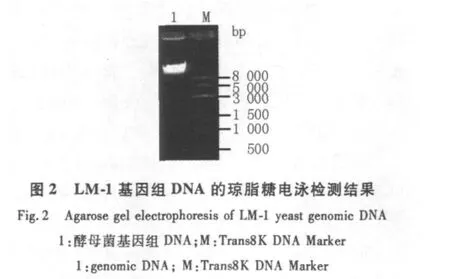
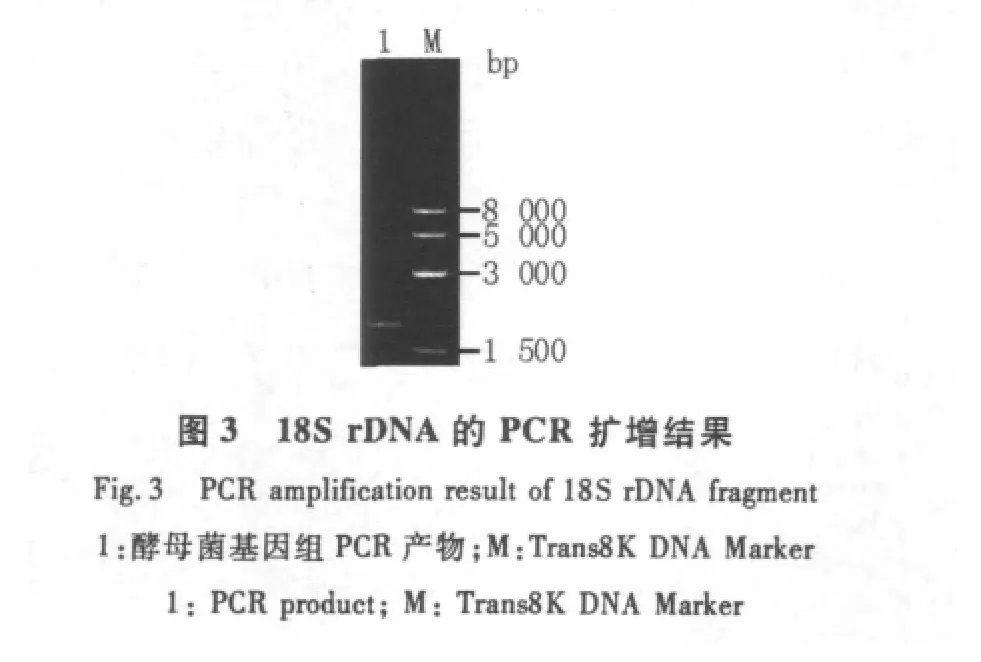
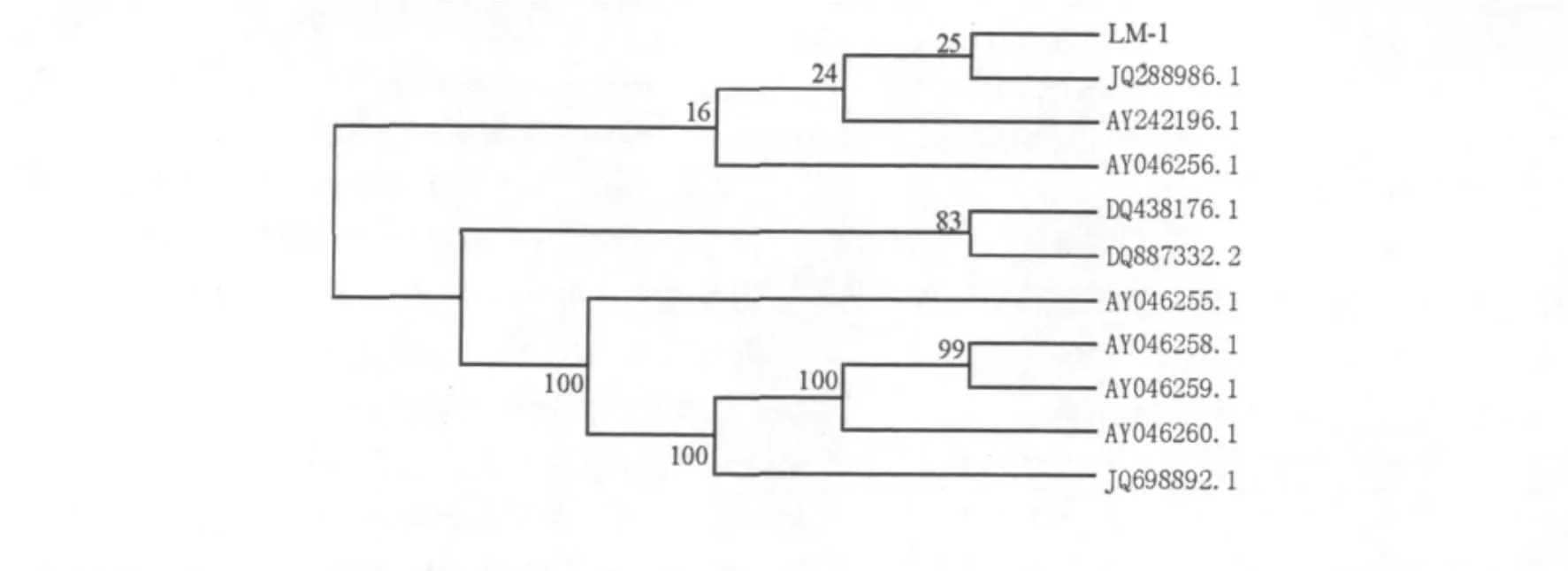
图4 菌株18S rDNA序列与其他酵母菌亲缘关系进化树Fig.4 Phylogenetic tree of LM-1 strain and theirs closest relatives based on 18S rDNA sequence
2.4.3 LM-1酵母菌18S rDNA序列与其他酵母菌亲缘关系进化树的构建 对PCR扩增得到的LM-1菌株18S rDNA的序列进行了测定,并将结果登录在NCBI GenBank中(登录号:JX455158)。同源性比对结果表明,LM-1菌与有孢汉逊酵母和假丝酵母的同源性都很高,18S rDNA序列相似程度均达99%。从图4可知,LM-1菌与Hanseniaspora uvarum的亲缘关系最近。综合分子生物学鉴定结果与上述的形态特征和生理生化鉴定结果,最终将LM-1菌鉴定为有孢汉逊酵母属[17]。
3 讨论
白色念珠菌是重要的人体条件致病性病原真菌,是引起很多疾病的主要原因之一,尤其是免疫力低下的病人,如艾滋病人以及某些进行过器官移植的患者,更易成为深度真菌感染的受害者。近年来,随着免疫缺陷患者的增多以及新的治疗技术的发展,临床上广谱抗生素、化疗药物和免疫抑制剂大量使用,真菌感染尤其是深部真菌病发病率逐年增加。自发现第一个抗真菌抗生素灰黄霉素以来,该领域取得了长足的进展,相继有很多抗真菌药物用于临床,但这些药物的抗菌作用程度、机制以及毒性等不尽相同。虽然已开发了众多的抗真菌药物对其进行防治,但由于药物产生的副作用以及近年出现的耐药性菌株,促使人们不得不寻找其他新型、有效的抗真菌药物及先导化合物。
本文从构树果实中分离拮抗白色念珠菌的酵母菌,通过形态观察、生理生化和分子生物学鉴定相结合的方法,初步鉴定为有孢汉逊酵母属。此菌株能够产生对白色念珠菌具有拮抗作用的物质,影响或限定了病原菌的生存和活动。有孢汉逊酵母属酵母菌大多用于酿酒和食品工业,还未曾报道具有抗菌活性的有孢汉逊酵母菌。通过LM-1菌株的产生的抗菌活性物质进一步分离纯化,并研究其抗菌机制,有助于发现新的抗菌靶点和开发新型真菌药物。
[1]王莹,李大鹏.壳聚糖对白色念珠菌的抑菌研究[J].农产品加工学刊,2012,(7):52-54.
[2]李庆华,郑桂仙,蔡木发,等.我院血液病房感染病原菌分布及耐药性分析[J].当代医学,2012,18(20):49-50.
[3]孙倩,李茵,李金陆,等.人工合成抗菌肽对白色念珠菌体外抑制作用的初步研究[J].北京口腔医学,2011,19(2):70-73.
[4]王晓红.产淀粉酶海洋酵母菌的筛选、鉴定及粗酶性质的研究[D].中国海洋大学,2007:1-50.
[5]王丽敏,李军,胡小松.苹果原料中酵母菌的分离鉴定[J].中国农业大学学报,2004,9(4):14-17.
[6]俞鲁,凌宁,张楠,等.香蕉枯萎病拮抗菌的筛选鉴定及其生防效果[J].南京农业大学学报,2012,35(4):81-86.
[7]Lakayf M,Botha A,Prior BA.Comparative analysis of environmental DNA extraction and purification methods from different humic acid-rich soils[J].J Appl Microbiol,2007,102(1):265-273.
[8]江欢欢,程凯,杨兴明,等.辣椒青枯病拮抗菌的筛选及其生物防治效应[J].土壤学报,2010,47(6):1226-1231.
[9]张刚,汪天虹.产低温淀粉酶的海洋真菌筛选及研究[J].海洋科学,2002,26(2):3-5.
[10]巴尼特 J A,佩恩 RW,亚罗 D.胡瑞卿,译.酵母菌的特征与鉴定手册[M].山东:青岛海洋大学出版社,1991:7-371.
[11]耿海峰,张丽珍,牛伟.冬枣采后病害拮抗菌的筛选和鉴定[J].食品科学,2010,9(31):150-155.
[12]綦成,孙静,元庆国.化疗患者口腔白假丝酵母菌的分布及基因分组研究[J].华西口腔医学杂志,2009,27(4):436-439.
[13]赵宏宇,李珺,赵玥,等.4种酵母基因组提取方法的比较[J].食品科学,2011,32(9):170-173.
[14]刘素玲,冉玉平,曾蔚,等.一种适用于PCR反应的酵母菌、无绿藻及丝状真菌DNA提取方法[J].中国真菌学杂志,2006,12(1):340-342.
[15]Romano P,Feore C,Parargim O,et al.Function of yeast species and strains in wine flavour[J].International Journal of Food Microbiology,2003,(1):69-80.
[16]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002:42-43.
[17]Zheng Y,Xue QY,Xu LL,et al.A screening strategy of fungal biocontrol agents towards Verticillium wilt of cotton[J].Biological Control,2011,56(3):209-216.

