硫化氢对大鼠肠缺血再灌注后回肠收缩活性的保护作用
张观坡 高 峻 李桂香 李兆申 邹多武*
第二军医大学长海医院消化内科(200433)
肠缺血再灌注(ischemia-reperfusion,I/R)损伤是临床上较为常见的基本病理生理过程,可在出血性休克、小肠移植、机械性肠梗阻和严重外伤等过程中发生[1],会引起严重的并发症甚至死亡,但目前仍缺乏有效的治疗药物。硫化氢(hydrogen sulfide,H2S)是一种继一氧化氮和一氧化碳之后的第三类气体信号分子,包括人在内的哺乳动物可代谢生成内源性H2S。Liu等[2]和Henderson等[3]均证实肠缺血后再灌注前给予H2S,可减轻I/R对肠黏膜上皮的损伤。目前尚未见H2S能否保护I/R后肠运动功能的报道。本研究通过探讨H2S对肠I/R后回肠收缩活性的影响及其机制,旨在为肠I/R的治疗提供一种潜在的药物。
材料与方法
一、实验动物、主要仪器、试剂
24只雄性Sprague-Dawley(SD)大鼠由第二军医大学实验动物中心提供,体质量180~250 g,适应性饲养1周。
BL-420S生物机能实验系统、HV-4离体组织器官恒温灌流系统、普通刺激银电极(成都泰盟软件有限公司),JH-2肌张力传感器(航天医学工程研究所),IX71 荧光倒置显微镜(Olympus公司)。KCl(上海凌峰化学试剂有限公司),乙酰胆碱(Ach)、硫氢化钠(NaHS)、河豚毒素(TTX)(Sigma 公司),驴封闭血清(Invitrogen公司),小鼠抗Hu单克隆抗体(Molecular Probes),山羊抗胆碱乙酰转移酶(ChAT)多克隆抗体(Millipore),488 标记的驴抗小鼠荧光二抗(Invitrogen公司),Cy3标记的驴抗山羊荧光二抗(Jackson ImmunoResearch)。
二、方法
1.肠I1h/R4h模型的制备:SD大鼠禁食不禁水18 h,7%水合氯醛腹腔内注射麻醉,开腹分离肠系膜上动脉并用无创动脉夹夹闭,可见肠系膜上动脉分支远端搏动消失,小肠由红色转变为白色渐而转变为深蓝色。1 h后开腹取下动脉夹,可见肠系膜上动脉恢复前向性血流,远端分支出现动脉搏动,小肠由深蓝色恢复为红色,合并充血、水肿。缝合腹腔,再灌注 4 h[4]。
2.动物分组和实验设计:将24只SD大鼠随机分为正常组、假手术组、I/R组、H2S组,每组各6只。正常组麻醉后直接取材;假手术组麻醉开腹后仅用器械翻动小肠;I/R组行肠I1h/R4h造模,再灌注前20 min予腹腔内注射0.9%NaCl溶液(0.5 mL/100 g);H2S组行肠I1h/R4h造模,再灌注前20 min予腹腔内注射2 mmol/L NaHS溶液(0.5 mL/100 g,终浓度为 10 μmol/kg)。
三、功能学实验
1.组织取材:SD大鼠以7%水合氯醛麻醉后开腹,距回盲部3 cm处取回肠2~3 cm,立刻置入冷的 KRB 液中(通 95%O2、5%CO2混合气体),修剪成1.0~1.5 cm的肠段。
2.离体回肠自发收缩实验:肠段垂直挂入装有KRB 液的恒温浴槽中(10 mL,37 ℃,通 95%O2、5%CO2混合气体),一端固定,另一端连接肌张力传感器,等长收缩模式,予1 g前负荷平衡60 min(每隔15 min更换KRB液)。记录离体回肠自发收缩频率,计算自发收缩的曲线下面积(area under curve,AUC)。
3.离体回肠药理学实验:离体肠段予1 g前负荷平衡60 min后,加入3 mol/L KCl溶液100 μL(终浓度为30 mmol/L)。洗脱药物3次,肠段收缩稳定回归基线后加入1 mmol/L Ach溶液100 μL(终浓度为10-5mol/L)。记录离体回肠对KCl和Ach的最大收缩张力。
4.离体回肠电场刺激(electrical field stimulation,EFS)实验:离体肠段予1 g前负荷平衡60 min后,将普通刺激银电极的两极平行置于肠段的浆肌层,待收缩稳定后,给予EFS实验(30 V,10 Hz,1.00 ms,10 s)。记录离体回肠对EFS的最大收缩张力。
5.数据采集和计算:自发收缩频率和AUC取自发收缩稳定后3 min的平均值。AUC和最大收缩张力通过肌条横截面积(cross section area,CSA)进行校正[5]:CSA(mm2)=组织湿重(mg)/[组织长度(mm)×组织密度(mg/mm3)]。 采用 Spike2 软件进行数据分析。
四、免疫荧光实验
SD大鼠麻醉开胸,经左心室至升主动脉插管,依次灌注0.9%NaCl溶液和4%多聚甲醛,取末端回肠约1 cm,剥离黏膜层和黏膜下层,保留浆肌层,继续剥离环形肌,得到纵行肌肠肌间神经丛标本。以0.01 mmol/L PBS漂洗5 min×3次,加入含0.2%Triton的10%驴封闭血清30 min封闭非特异性抗原,加入Hu抗体和ChAT抗体(工作浓度分别为 1∶200 和 1∶100),4 ℃孵育过夜; 以 0.01 mmol/L PBS漂洗5 min×3次,加入二抗(工作浓度分别为1∶400 和 1∶100), 室温下避光孵育 1 h;0.01 mmol/L PBS漂洗5 min×3次。荧光显微镜下观察,每只大鼠取 6张铺片,每张铺片随机取2个视野(×200),采用Image-Impro Plus 6.0图像分析系统计算Hu阳性神经元细胞数;计算ChAT阳性神经面积、累积光密度(IOD)值[6]。
五、统计学分析
结 果
一、大鼠离体回肠自发收缩频率和AUC
与假手术组相比,I/R组和H2S组的自发收缩频率无明显差异,而后两组之间亦无明显差异(P>0.05)(见图 1、表 1)。
与假手术组相比,I/R造模后离体回肠的自发收缩AUC显著降低(P=0.00);给予H2S干预后,离体回肠的自发收缩AUC显著提高(P=0.01),但仍显著低于假手术组(P=0.001)(见表 1)。
二、大鼠离体回肠对KCl和Ach的收缩反应
与假手术组相比,I/R组和H2S组离体回肠对KCl和ACh诱发的最大收缩张力均无明显差异(P>0.05),而后两组之间相比亦无明显差异(P>0.05)(见图 1、图 2)。

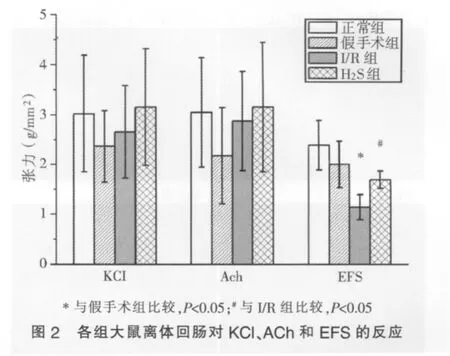
三、大鼠离体回肠对EFS的反应
与假手术组相比,I/R组对EFS诱发的最大收缩张力明显降低(P=0.00);而给予I/R模型H2S干预后,EFS诱发的最大收缩张力显著提高(P=0.02),与假手术组相比无明显差异(P>0.05)(见图 1、图 2)。
四、Hu免疫荧光染色
免疫荧光染色示Hu抗体阳性神经元位于肌间神经丛肠神经元,神经元胞体大小不等,形态多样,多数呈卵圆形、梭形(见图3)。与假手术组相比,I/R组肌间神经丛肠神经元数目明显下降(P=0.00);给予H2S干预后,肠神经元数目显著提高(P=0.00),但仍显著低于假手术组(P=0.00)(见表 1)。
五、ChAT免疫荧光染色
免疫荧光染色示,ChAT抗体可使胆碱能神经元和神经纤维染色,但神经元边界不甚清楚,辨认较为困难,而神经纤维纵横交错,清晰易辨别(见图4)。与假手术组相比,I/R组兴奋性胆碱能神经面积和IOD值明显降低(P=0.00);给予H2S干预后,这两项指标均显著提高(P=0.00),但仍显著低于假手术组(P=0.00)(见表 1)。
表1 各组大鼠离体回肠自发收缩频率和AUC、免疫荧光染色结果比较()
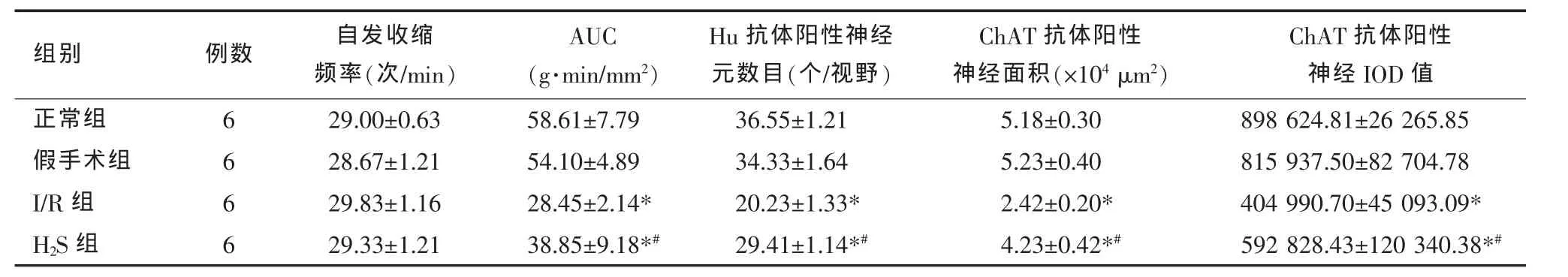
表1 各组大鼠离体回肠自发收缩频率和AUC、免疫荧光染色结果比较()
*与假手术组比较,P<0.05;#与I/R组比较,P<0.05
ChAT抗体阳性神经IOD值正常组 6 29.00±0.63 58.61±7.79 36.55±1.21 5.18±0.30 898624.81±26265.85假手术组 6 28.67±1.21 54.10±4.89 34.33±1.64 5.23±0.40 815937.50±82704.78 I/R 组 6 29.83±1.16 28.45±2.14* 20.23±1.33* 2.42±0.20* 404990.70±45093.09*H2S 组 6 29.33±1.21 38.85±9.18*# 29.41±1.14*# 4.23±0.42*# 592828.43±120340.38*#组别 例数 自发收缩频率(次/min)AUC(g·min/mm2)Hu抗体阳性神经元数目(个/视野)ChAT抗体阳性神经面积(×104μm2)


讨 论
胃肠道动力是由 Cajal间质细胞(interstitial cells of Cajal,ICC)、平滑肌和肠神经共同调控的,肠I/R可通过引起肠神经元、平滑肌细胞、ICC的凋亡而引起小肠运动功能障碍,尤其是肠神经系统中胆碱能肠神经受损从而引起兴奋性神经递质Ach减少是最重要的原因之一。肠I/R可引起小肠自发收缩活性降低,但其对KCl、Ach收缩反应的研究结果不相一致[4,7],且不同的I/R造模时间对其自发收缩频率的影响亦不相同[8]。这可能与I/R造模方法不同有关。本研究采用无创动脉夹夹闭肠系膜上动脉1 h后再灌注4 h以制备肠I/R模型(I1h/R4h),其自发收缩频率与假手术组相比无明显改变,提示ICC起搏功能无明显损伤;KCl诱发的最大收缩张力无明显改变,提示平滑肌收缩功能无明显损伤;Ach诱发的最大收缩张力无明显改变,提示M受体及其介导的平滑肌收缩功能无明显损伤。I/R组离体回肠自发收缩AUC以及对EFS收缩反应下降。本研究的预实验中,离体肠段接受EFS后再给予TTX(1 μmol/L)阻断神经传递,发现 EFS效应消失,证明EFS效应主要通过神经网络传递扩散,其刺激诱发的最大收缩张力明显下降提示肠神经尤其是兴奋性肠神经受到明显损伤。Hu蛋白是一组神经元特异性抗原,ChAT可催化合成Ach,可作为胆碱能神经元的标记物。进一步免疫荧光结果亦提示,I/R组肌间神经丛Hu抗体阳性神经元数目以及兴奋性胆碱能ChAT阳性神经面积和IOD值较假手术组均明显降低,表明I/R组肠神经尤其是兴奋性肠神经元受到损伤。
H2S是一种第三类气体信号分子,哺乳动物的内源性H2S主要以半胱氨酸为底物,由胱硫醚-β-合成酶(cystathionine beta-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine gamma-lyase,CSE)代谢生成,在生理浓度下发挥多种重要的生理功能,如在神经系统中可易化海马长时程增强,在心血管系统中可直接舒张肺、体循环血管等[9]。近来,多项研究证实缺血前给予H2S,可在多种脏器如心[10]、肺[11]、肝[12]、肾[13]的I/R模型中起保护作用。其机制可能是:H2S通过局部可逆抑制细胞色素c氧化酶而阻断氧化磷酸化;细胞氧化还原状态的改变诱导黄嘌呤介导的抗氧化和抗凋亡途径,继而使组织细胞和器官处于低代谢状态,提高对缺血的耐受性[3,14]。上述研究结果均提示预防性给予H2S可显著减轻I/R损伤,但在临床上多数I/R事件是无法预知的。因此,研究缺血发生后再给予H2S是否仍具有减轻脏器损伤的作用更具有临床意义。
本研究诱导大鼠肠缺血后,于再灌注前20 min腹腔注射2 mmol/L NaHS溶液作为干预手段,结果显示H2S组自发收缩AUC较I/R组明显提高,提示H2S对肠I/R后的运动功能有保护作用;同时发现,H2S组对EFS诱发的最大收缩张力较I/R组明显提高,提示H2S可减轻兴奋性肠神经的损伤。免疫荧光结果亦证实,与I/R组相比,H2S组肌间神经丛Hu阳性神经元数目以及兴奋性胆碱能肠神经面积和IOD值均明显提高,提示H2S对肠I/R后运动功能保护作用的主要机制为减轻神经元尤其是兴奋性神经元的损伤。有研究[2,3]证实,肠缺血后再灌注前给予H2S可减轻I/R对肠黏膜上皮的损伤作用,其机制可能与抗氧化物酶如超氧化物歧化酶(SOD)和过氧化物酶(GSH-Px)活性升高相关。闫兴军等[15]进一步证实H2S对肠I/R大鼠肠黏膜屏障功能障碍有保护作用,其部分机制是减少中性粒细胞浸润和激活,减轻肠上皮细胞氧化损伤水平,增加SOD清除氧自由基的活性,下调活化的caspase-3和多聚ADP核糖合成酶(PARP)蛋白表达。本研究初步证实肠缺血后再灌注前给予H2S具有保护离体回肠收缩活性的作用。由此可见,H2S不仅可以预防I/R损伤,而且在损伤发生后仍具有缓解损伤的作用。
总之,本研究证实了H2S对大鼠肠I/R后离体回肠的收缩功能有保护作用,其机制主要为减轻肠神经尤其是兴奋性肠神经元的损伤。然而,H2S在不同组织、不同浓度下表现出截然不同的多种生物学效应,其作为一种潜在治疗药物尚需行更广泛和深入的研究进一步证实。
1 Collard CD, Gelman S. Pathophysiology, clinical manifestations,and prevention of ischemia-reperfusion injury[J].Anesthesiology,2001,94(6):1133-1138.
2 Liu H,Bai XB,Shi S,et al.Hydrogen sulfide protects from intestinal ischaemia-reperfusion injury in rats.J Pharm Pharmacol,2009,61(2):207-212.
3 Henderson PW,Weinstein AL,Sohn AM,et al.Hydrogen sulfide attenuates intestinal ischemia-reperfusion injury when delivered in the post-ischemic period[J].J Gastroenterol Hepatol,2010,25(10):1642-1647.
4 Ballabeni V,Barocelli E,Bertoni S,et al.Alterations of intestinal motor responsiveness in a model of mild mesenteric ischemia/reperfusion in rats[J].Life Sci,2002,71(17):2025-2035.
5 Takahashi T,Nakamura K,Itoh H,et al.Impaired expression ofnitric oxide synthase in the gastric myenteric plexus of spontaneously diabetic rats[J].Gastroenterology,1997,113(5):1535-1544.
6 Soret R,Chevalier J,De Coppet P,et al.Short-chain fatty acids regulate the enteric neurons and control gastrointestinal motility in rats[J].Gastroenterology,2010,138(5):1772-1782.
7 Ozacmak VH,Sayan H,Arslan SO,et al.Protective effect of melatonin on contractile activity and oxidative injury induced by ischemia and reperfusion of rat ileum[J].Life Sci,2005,76(14):1575-1588.
8 Shimojima N,Nakaki T,Morikawa Y,et al.Interstitial cells of Cajal in dysmotility in intestinal ischemia and reperfusion injury in rats[J].J Surg Res,2006,135(2):255-261.
9 Gadalla MM,SnyderSH.Hydrogen sulfide asa gasotransmitter[J].J Neurochem,2010,113(1):14-26.
10 Johansen D,Ytrehus K,Baxter GF.Exogenous hydrogen sulfide (H2S)protects againstregionalmyocardial ischemia-reperfusion injury--Evidence for a role of K ATP channels[J].Basic Res Cardiol,2006,101(1):53-60.
11 Fu Z,Liu X,Geng B,et al.Hydrogen sulfide protects rat lung from ischemia-reperfusion injury[J].Life Sci,2008,82(23-24):1196-1202.
12 Kang K,Zhao M,Jiang H,et al.Role of hydrogen sulfide in hepatic ischemia-reperfusion-induced injury in rats[J].Liver Transpl,2009,15(10):1306-1314.
13 Tripatara P,Patel NS,Collino M,et al.Generation of endogenous hydrogen sulfide by cystathionine gammalyase limits renal ischemia/reperfusion injury and dysfunction[J].Lab Invest,2008,88(10):1038-1048.
14 Szabó C.Hydrogen sulphide and its therapeutic potential[J].Nat Rev Drug Discov,2007,6(11):917-935.
15 闫兴军,卢根林,邓勇.硫化氢在肠缺血-再灌注损伤大鼠肠黏膜屏障功能障碍中的作用[J].中华实验外科杂志,2010,27(1):71-74.

