脑源性神经营养因子在结肠炎后内脏高敏感小鼠中的调节作用*
杨 静 于岩波 于 卉 左秀丽 陈哲宇 李延青#
山东省千佛山医院消化内科1(250014) 山东大学齐鲁医院消化内科2 山东大学医学院神经生物学研究所3
腹部不适和疼痛是炎症性肠病(inflammatory bowel disease,IBD)和肠易激综合征(irritable bowel syndrome,IBS)患者的临床常见症状。目前认为内脏高敏感是IBD和IBS患者相关疼痛症状的主要病理生理机制,表现为对直肠扩张刺激的感觉阈值降低和(或)对刺激的反应强度增加[1]。IBD和IBS患者常伴有尿频、尿急、排尿痛等膀胱高敏感并发症,这些并发症加重了对患者生活质量的负面影响,但发病机制尚不清楚。内脏感觉通过胞体位于背根神经节(dorsal root ganglia,DRG)的脊髓内脏传入纤维传递至次级感觉神经元,进而投射至中枢神经系统[2]。DRG内关键分子的调控作用以及表达已成为近年内脏敏感性机制研究的热点。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养物质家族成员,在中枢和外周神经系统均有表达。近年研究发现BDNF参与调控痛觉的转导[3],然而系统应用BDNF基因敲除(BDNF+/-)小鼠研究BDNF在内脏敏感性中的调节作用尚未见报道。本研究以三硝基苯磺酸(TNBS)诱导建立BDNF+/-小鼠结肠炎后内脏高敏感模型,旨在探讨BDNF是否参与小鼠内脏敏感性的调节。
材料与方法
一、实验动物和主要试剂
杂合子BDNF+/-C57BL/6小鼠38只和同窝正常野生型(BDNF+/+)C57BL/6小鼠38只由山东大学神经生物学实验室馈赠。从鼠尾组织标本中提取DNA通过聚合酶链反应(PCR)行基因分型。小鼠于(21±1)℃温度、50%±5%空气湿度、避强光的环境中喂养,自由饮水、摄食。
TNBS、苯巴比妥钠(Sigma 公司),ELISA BDNF试剂盒(Promega公司)。BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),乙醇、多聚甲醛等购自天津市大茂化学试剂厂。
二、动物分组和模型建立
所有小鼠分为BDNF+/+对照组、BDNF+/+TNBS炎症组、BDNF+/-对照组和BDNF+/-TNBS炎症组,每组各19只。按照Engel等[4]的方法制备结肠炎后内脏高敏感小鼠模型。1.75 mg TNBS溶解于50%的乙醇中,终体积为0.1 mL。以注射器吸取配置好的TNBS,然后与一内径为1.2 mm的聚乙烯塑料管相连,导管末端用石蜡油充分润滑以避免操作对结肠黏膜的物理性损伤。小鼠灌肠前24 h禁食不禁水,乙醚吸入麻醉后,将导管缓慢插入降结肠直至导管末端距小鼠肛门约4 cm处,将TNBS缓缓推入降结肠。为避免TNBS外漏,保持小鼠倒立约30 s。对照组给予同等剂量的50%乙醇。
三、结肠和膀胱组织学检查
造模7 d后,每组随机取7只小鼠腹腔注射过量苯巴比妥钠(200 mg/kg)处死,取远端3 cm的降结肠和膀胱,于4%甲醛溶液中固定,石蜡包埋,冠状连续切片,片厚5 μm,行HE染色。由对实验设计和操作全盲的病理医师行结肠组织学半定量评分[5]:0 分,正常无炎症;1 分,低度炎症;2 分,中等炎性粒细胞浸润;3分,高度炎性粒细胞浸润,高度血管密度,肠壁增厚;4分,透壁炎症,杯状细胞缺失,高度血管密度,肠壁增厚。膀胱组织病理学半定量评分[6]:0分,正常无炎症;1分,低度炎症,无或低度水肿;2分,中度炎性浸润和水肿;3分,重度炎性浸润和水肿。
四、ELISA测定DRG内BDNF表达
上述行组织学检查的小鼠同时快速取支配结肠的脊髓胸腰部 T10-L1(TL)和腰骶部 L6-S1(LS)DRG,加入蛋白裂解缓冲液裂解30 min,行BCA蛋白定量。严格按照ELISA试剂盒说明书检测BDNF蛋白表达。
五、内脏敏感性
造模7 d后,每组选取6只小鼠行结直肠扩张(colorectal distension,CRD)并记录腹壁回撤反射(abdominal withdrawal reflex,AWR)评分[7]。 乙醚轻度麻醉小鼠后,将紧密连接于聚四氟乙烯导管上特制的 2 cm聚乙烯塑料球囊轻轻插入降结肠,球囊近端距肛门约0.5 cm,导管用胶布固定于鼠尾。导管另一端紧密连接水银血压计。待小鼠充分苏醒并适应后,分别在 0、15、30、45、60 和 80 mm Hg(1 mm Hg=0.133 kPa)压力下行结肠球囊扩张。每次扩张持续20 s,间隔4 min。由对实验设计全盲的观察者记录不同压力下AWR评分,所有测量均重复3次。AWR评分系统:0分:对球囊扩张无反应;1分:身体静止不动或头部运动减少;2分:腹部肌肉收缩;3分:腹部抬高;4分:骨盆抬起,身体呈弓形。
六、膀胱敏感性
造模7 d后,每组选取6只小鼠以1.2 g/kg氨基甲酸酯腹腔注射麻醉,中下腹部逐层剖开,暴露出膀胱,在膀胱顶部制一小切口,缓缓插入PE50导管,以氨基丙烯酸酯黏胶固定,15 min后膀胱排空。导管另一端通过三通管连接至灌流泵和压力换能器上。2 min后,0.9%NaCl溶液以20 μL/min的速度持续灌流2 h,建立稳定而可重复排尿的膀胱内压测量系统。记录三次排尿间隔时间[8],取均值。
七、统计学分析
结 果
一、结肠和膀胱组织学检查
对于两种不同基因型的小鼠,TNBS均可诱导明显的结肠炎症,组织学检查表现为节段性溃疡形成,肠黏膜中度充血水肿,大量炎性粒细胞浸润和部分上皮坏死脱落(见图1)。BDNF+/+TNBS炎症组结肠组织学评分显著高于BDNF+/+对照组(P<0.01),BDNF+/-TNBS炎症组评分亦显著高于BDNF+/-对照组(P<0.01),而两个炎症组之间相比无明显差异(见表 1)。
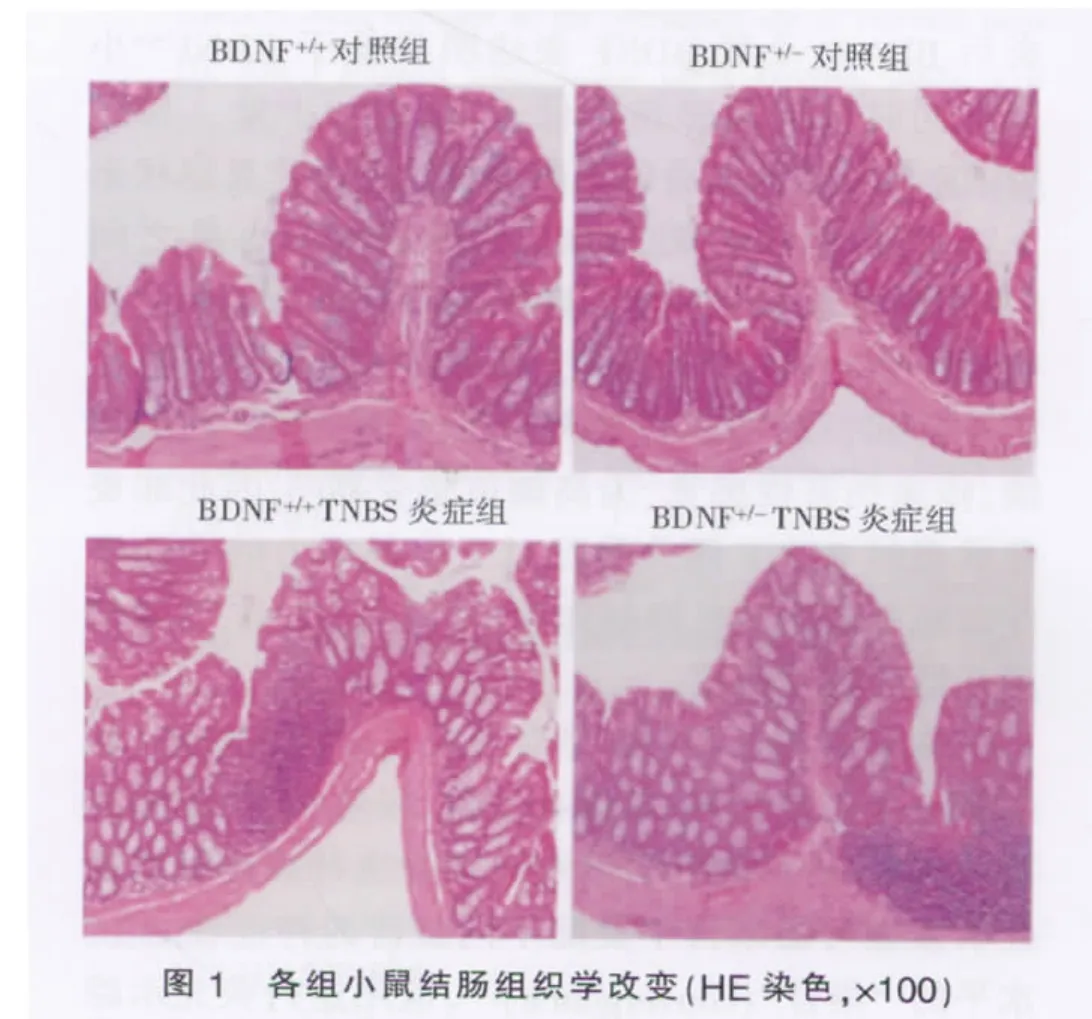
各组小鼠膀胱组织学切片均显示结构正常完整,无炎症指征(见图2),组织学评分均为0。
二、DRG内BDNF蛋白表达

非炎症状态下,BDNF+/-小鼠支配结肠的TL和LS DRG内BDNF蛋白表达均约为BDNF+/+小鼠的一半,组间相比差异有统计学意义(P<0.05)。两种不同基因型的TNBS炎症组TL和LS DRG内BDNF蛋白表达均显著高于相应对照组(P<0.01)。BDNF+/-TNBS炎症组TL和LS DRG内BDNF蛋白表达显著低于 BDNF+/+TNBS 炎症组(P<0.001)(见表 1)。
三、不同扩张压力下小鼠AWR评分
非炎症状态下,扩张压力<60 mm Hg时,BDNF+/-小鼠AWR评分与BDNF+/+小鼠相比无明显差异;而扩张压力为60、80 mm Hg时,BDNF+/+小鼠AWR评分显著高于BDNF+/-小鼠(P<0.05)。在BDNF+/+小鼠中,扩张压力≥30 mm Hg时,TNBS炎症组AWR评分显著高于对照组(P<0.01);扩张压力<30 mm Hg时两组无明显差异。在BDNF+/-小鼠中,扩张压力≥45 mm Hg时,TNBS炎症组AWR评分显著高于对照组(P<0.01);扩张压力<45 mm Hg时两组无明显差异。扩张压力≥30 mm Hg时,BDNF+/-TNBS炎症组AWR评分显著低于BDNF+/+TNBS 炎症组(P<0.05)(见表 1、图 3)。
表1 各组小鼠结肠组织学评分、BDNF蛋白表达、AWR评分和排尿间隔比较()
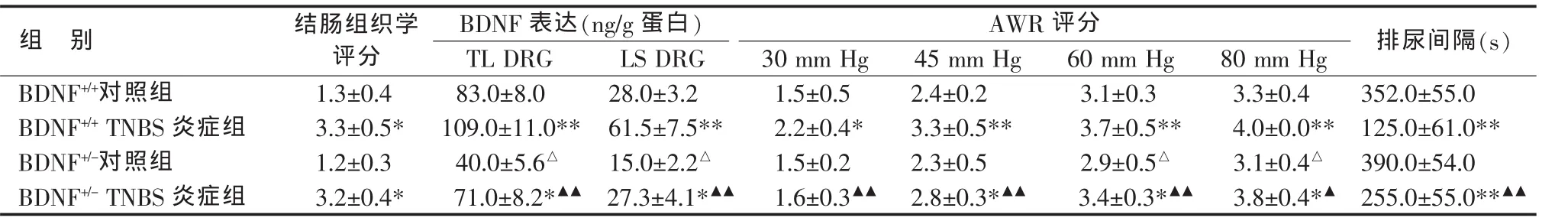
表1 各组小鼠结肠组织学评分、BDNF蛋白表达、AWR评分和排尿间隔比较()
与同基因型对照组比较,*P<0.01,**P<0.001;与 BDNF+/+TNBS 炎症组比较,▲P<0.05,▲▲P<0.01;△与 BDNF+/+对照组比较,P<0.05
四、膀胱敏感性
非炎症状态下,BDNF+/-小鼠与BDNF+/+小鼠的排尿间隔相比无明显差异。两种不同基因型TNBS炎症组排尿间隔均显著短于相应对照组(P<0.001)。BDNF+/-TNBS炎症组排尿间隔显著高于BDNF+/+TNBS 炎症组(P<0.01)(见表 1)。
讨 论
根据解剖学分布特点,支配结肠DRG的神经元纤维主要分为两类:一类为内脏神经,神经元胞体位于脊髓胸腰段T10-L1;另一类为盆神经,胞体位于脊髓腰骶段L6-S1[9]。这些神经纤维裸露的末梢分布于肠壁各层,分别沿着交感神经和副交感神经走行,穿过椎旁节和椎前节,到达脊髓后角。内脏敏感性的变化主要由外周和中枢机制引起[2]。各种原因引起的感觉神经末梢和初级传入神经元的致敏均可诱导中枢敏感化,探索DRG内参与结肠炎后致敏的关键分子对明确结肠高敏感的发生机制有重要意义。
BDNF广泛分布于中枢和周围神经系统,可维持胚胎期神经元的存活、分化,并参与调节成熟神经元的功能。既往研究认为,BDNF可调控突触可塑性,并参与学习、记忆等多项功能[10]。有研究发现BDNF亦参与痛觉的转导与调控[3]。在外周炎症诱导的疼痛模型中,DRG内BDNF表达明显上调。研究发现,鞘内注射BDNF抗体能抑制后足切割疼痛模型的痛觉过敏,表明BDNF参与神经源性躯体疼痛[11]。临床研究[12]亦发现慢性胰腺炎患者的胰腺组织内BDNF表达明显上调,并与胰腺炎性疼痛的发生密切相关。本研究中,非炎症状态下,BDNF+/-小鼠DRG内BDNF蛋白表达明显低于BDNF+/+小鼠,但两种基因型小鼠间结肠敏感性无明显差异。仅球囊扩张压力≥60 mm Hg时,相较于BDNF+/+小鼠,BDNF+/-小鼠表现为结肠低反应性。
本研究发现,对于BDNF+/-和BDNF+/+小鼠,TNBS均有显著的炎性致敏作用。TNBS模型是研究肠道传入神经外周致敏化机制的重要手段。大量研究发现TNBS诱导结肠炎后,局部可释放炎性介质如P物质、缓激肽、前列腺素E2、降钙素基因相关肽等[13~15]。分布于消化道壁的初级传入纤维末梢受到这些炎性介质的刺激活化,将感觉信号放大传递至中枢神经系统[16]。BDNF可能与上述炎性介质共同协作参与炎性内脏高敏感的调控。本研究结果证实,TNBS诱导炎症后两种不同基因型小鼠DRG内BDNF表达均增加,同时伴有结肠高敏感。结肠炎后BDNF+/-小鼠BDNF表达明显低于BDNF+/+小鼠,同时结肠敏感性亦低于BDNF+/+小鼠。提示BDNF参与结肠炎后的内脏致敏。而在非炎症状态下,低压力 CRD时,BDNF+/+和 BDNF+/-小鼠之间AWR评分无明显差异,这可能源自于BDNF的生物学特性。BDNF在DRG中主要分布于中小直径的神经元,而中小直径神经元发出Aδ和C类纤维,传递伤害性感觉,为高阈值感受器[17],因此非炎症状态时BDNF部分敲除对于较低压力的非伤害性结肠刺激无明显抑制作用,可能由BDNF高阈值感受器的特性所致。
临床上IBD和IBS患者除反复发作的腹痛、腹泻等消化道症状外,常伴有尿频、尿急、尿痛等膀胱高反应性的并发症。目前观点认为这种腹腔脏器的症状重叠可能来自于支配不同脏器的神经在DRG水平的 “集合”(convergence)[18]。应用逆行荧光示踪技术,标记小鼠DRG内来自膀胱和结肠的神经元,证实两者在 TL DRG(T13-L1)和 LS DRG(L5-S1)内存在一定比例的重合[19]。作为感觉信息转导的“门控”,研究参与DRG水平神经元“集合”的关键分子对揭示牵涉性膀胱高敏感具有重要意义。
Qin等[20]的研究发现,大鼠结肠炎模型膀胱壁无组织病理学改变。本研究中,以TNBS建立小鼠结肠炎模型,亦发现膀胱无炎症表现,组织结构正常完整;BDNF+/-炎症小鼠的膀胱敏感性显著低于BDNF+/+炎症小鼠,而在非炎症状态下,BDNF部分敲除对膀胱敏感性无明显影响。提示BDNF可能在DRG水平参与牵涉性膀胱高敏感的发生,其作用趋向于调控者而非始发因子,且调控作用可能亦需在结肠炎症状态下由多种炎性介质的刺激和协同作用而实现。
综上所述,本研究通过应用BDNF基因敲除小鼠,证实BDNF参与结肠炎后结肠高敏感和牵涉性膀胱高敏感的发生,为研制针对腹痛症状的药物提供了一定的理论依据。
1 Agrawal A,Houghton LA,Lea R,et al.Bloating and distention in irritable bowel syndrome:the role of visceral sensation[J].Gastroenterology,2008,134(7):1882-1889.
2 Gebhart GF.Pathobiology of visceral pain:molecular mechanisms and therapeutic implicationsⅣ.Visceral afferent contributions to the pathobiology of visceral pain[J].Am J Physiol Gastrointest Liver Physiol,2000,278(6):G834-G838.
3 Obata K,Noguchi K.BDNF in sensory neurons and chronic pain[J].Neurosci Res,2006,55(1):1-10.
4 Engel MA,Kellermann CA,Burnat G,et al.Mice lacking cannabinoid CB1-,CB2-receptors or both receptors show increased susceptibility to trinitrobenzene sulfonic acid(TNBS)-induced colitis[J].J Physiol Pharmacol,2010,61(1):89-97.
5 Elliott DE,Li J,Blum A,et al.Exposure to schistosome eggs protects mice from TNBS-induced colitis[J].Am J Physiol Gastrointest Liver Physiol,2003,284 (3):G385-G391.
6 Liu W,Evanoff DP,Chen X,et al.Urinary bladder epithelium antigen induces CD8+ T cell tolerance,activation,and autoimmune response[J].J Immunol,2007,178(1):539-546.
7 Long Y,Liu Y,Tong J,et al.Effectiveness of trimebutine maleate on modulating intestinal hypercontractility in a mouse model of postinfectious irritable bowel syndrome[J].Eur J Pharmacol,2010,636(1-3):159-165.
8 Lamb K,Zhong F,Gebhart GF,et al.Experimental colitis in mice and sensitization of converging visceral and somatic afferent pathways[J].Am J Physiol Gastrointest Liver Physiol,2006,290(3):G451-G457.
9 Brierley SM,Castro J,Harrington AM,et al.TRPA1 contributes to specific mechanically activated currents and sensory neuron mechanical hypersensitivity[J].J Physiol,2011,589(Pt 14):3575-3593.
10 Chen ZY,Jing D,Bath KG,et al.Genetic variant BDNF(Val66Met)polymorphism alters anxiety-related behavior[J].Science,2006,314(5796):140-143.
11 Li CQ,Xu JM,Liu D,et al.Brain derived neurotrophic factor (BDNF)contributes to the pain hypersensitivity following surgical incision in the rats[J].Mol Pain,2008,4:27.
12 ZhuZW,FriessH,WangL,etal.Brain-derived neurotrophic factor(BDNF)is upregulated and associated with pain in chronic pancreatitis[J].Dig Dis Sci,2001,46(8):1633-1639.
13 张峰,袁川评,柳巨雄,等.SP和CGRP在炎症性肠病大鼠结肠中的表达规律[J].中国比较医学,2011,21(12):26-30.
14 Hara DB,Leite DF,Fernandes ES,et al.The relevance of kinin B1 receptor upregulation in a mouse model of colitis[J].Br J Pharmacol,2008,154(6):1276-1286.
15 Ancha HR,Kurella RR,McKimmey CC,et al.Effects of N-acetylcysteine plus mesalamine on prostaglandin synthesis and nitric oxide generation in TNBS-induced colitis in rats[J].Dig Dis Sci,2009,54(4):758-766.
16 Peiris M,Bulmer DC,Baker MD,et al.Human visceral afferent recordings:preliminary report[J].Gut,2011,60(2):204-208.
17 Zhou XF, Rush RA. Endogenous brain-derived neurotrophic factor is anterogradely transported in primary sensory neurons[J].Neuroscience,1996,74(4):945-953.
18 Bielefeldt K,Lamb K,Gebhart GF.Convergence of sensory pathways in the development of somatic and visceral hypersensitivity[J].Am J Physiol Gastrointest Liver Physiol,2006,291(4):G658-G665.
19 Christianson JA, Liang R, Ustinova EE, et al.Convergence of bladder and colon sensory innervation occurs at the primary afferent level[J].Pain,2007,128(3):235-243.
20 Qin C,Malykhina AP,Akbarali HI,et al.Cross-organ sensitization of lumbosacral spinal neurons receiving urinary bladder input in rats with inflamed colon[J].Gastroenterology,2005,129(6):1967-1978.

