一氧化氮在四磨汤诱导大鼠胃窦平滑肌收缩中的作用*
戴迟兵 刘 娜 钱 伟 侯晓华
华中科技大学同济医学院附属协和医院消化内科(430022)
四磨汤属中医理气剂,主要成分为木香、枳壳、槟榔、乌药,功能破滞降逆,补气扶正,主治七情气逆,上气喘急,妨闷不食。临床实践显示该制剂具有良好的全胃肠促动力效应,但关于其促动力机制的研究目前尚未完善。本课题组的前期研究显示四磨汤主要通过胆碱能毒蕈碱性受体(M受体)[1]以及部分通过烟碱性受体(N受体)[2]促进胃窦平滑肌收缩。然而,作为一种含有多种组分的中药方剂,四磨汤促胃肠动力的作用机制较为复杂,其对胃窦平滑肌收缩活动的兴奋效应可能尚有其他机制参与。有研究[3]发现四磨汤的主要组分槟榔提取物能显著抑制诱生型一氧化氮合酶(iNOS)。鉴于一氧化氮(NO)在胃肠神经介导胃肠平滑肌松弛中起重要中介作用,推测NO可能亦参与了四磨汤对胃窦平滑肌收缩的调节。本研究以NO供体左旋精氨酸(L-Arg)预处理大鼠离体胃窦平滑肌条,探讨NO在四磨汤诱导胃窦平滑肌收缩中的作用。
材料与方法
一、实验动物、主要试剂和仪器
雄性Sprague-Dawley大鼠8只,体质量300~350 g,由华中科技大学同济医学院实验动物学部提供。
四磨汤口服液(生产批号091245-010,国药准字Z20025044,湖南汉森制药股份有限公司);L-Arg(Sigma-Aldrich Co.LLC.);Krebs 液:NaCl 119 mmol/L,KCl 4.7 mmol/L,NaH2PO41.2 mmol/L,MgSO4·7H2O 1.2 mmol/L,NaHCO325 mmol/L,CaCl22.5 mmol/L,C6H12OH611 mmol/L。
25 mL Myobath 4通道组织浴槽、Haake DC10-P5/U恒温水浴箱、FORT1010 g力传感器、SYSTBM4M Transbridge 换能放大器(WPI Inc.);MP100数据采集系统和AcqKnowledge 3.7.1软件(BIOPAC Systems,Inc.)。
二、实验方法
1.大鼠胃窦平滑肌条的获取和处理:大鼠适应性喂养一周,禁食不禁水24 h,脱颈椎处死后迅速取出鼠胃,沿大弯剪开,以4℃Krebs液漂洗干净,置于硅胶平皿中,大头针固定,分离胃窦,小心去除胃黏膜,以自制双刀(间距2 mm)切取胃窦纵肌条和环肌条(8 mm×2 mm),肌条两端以5-0号丝线结扎。
将肌条悬挂于盛有25 mL Krebs液的组织浴槽中,37℃恒温持续通入含5%CO2、95%O2的混合气体;给予1.0 g前负荷,每20 min更换一次Krebs液,平衡1 h,待肌条收缩活动平衡后开始实验。
2.实验流程:①记录基础状态(给药前)肌条收缩活动5 min,然后依次由低至高累积量加入四磨汤 1、5、25、50、100、150、200 μL,每次加入后记录肌条收缩活动5 min;②以Krebs液洗涤肌条3次,待收缩活动平衡后记录基础状态(给药前)肌条收缩活动 5 min,加入 L-Arg(终浓度 10-4mol/L)后记录肌条收缩活动5 min,然后依次由低至高累积量加入四磨汤(剂量梯度同步骤①),每次加入后记录肌条收缩活动5 min。
3.数据处理:通过AcqKnowledge 3.7.1软件获得不同状态下的5 min肌条收缩曲线下面积(AUC),给药后肌条收缩活性的变化以AUC变化率表示。AUC变化率=(效应值-对照值)/对照值×100%,其中对照值为基础状态5 min肌条收缩AUC,效应值为给药后(加入L-Arg、四磨汤或 LArg+四磨汤后)5 min肌条收缩AUC。
三、统计学分析
结 果
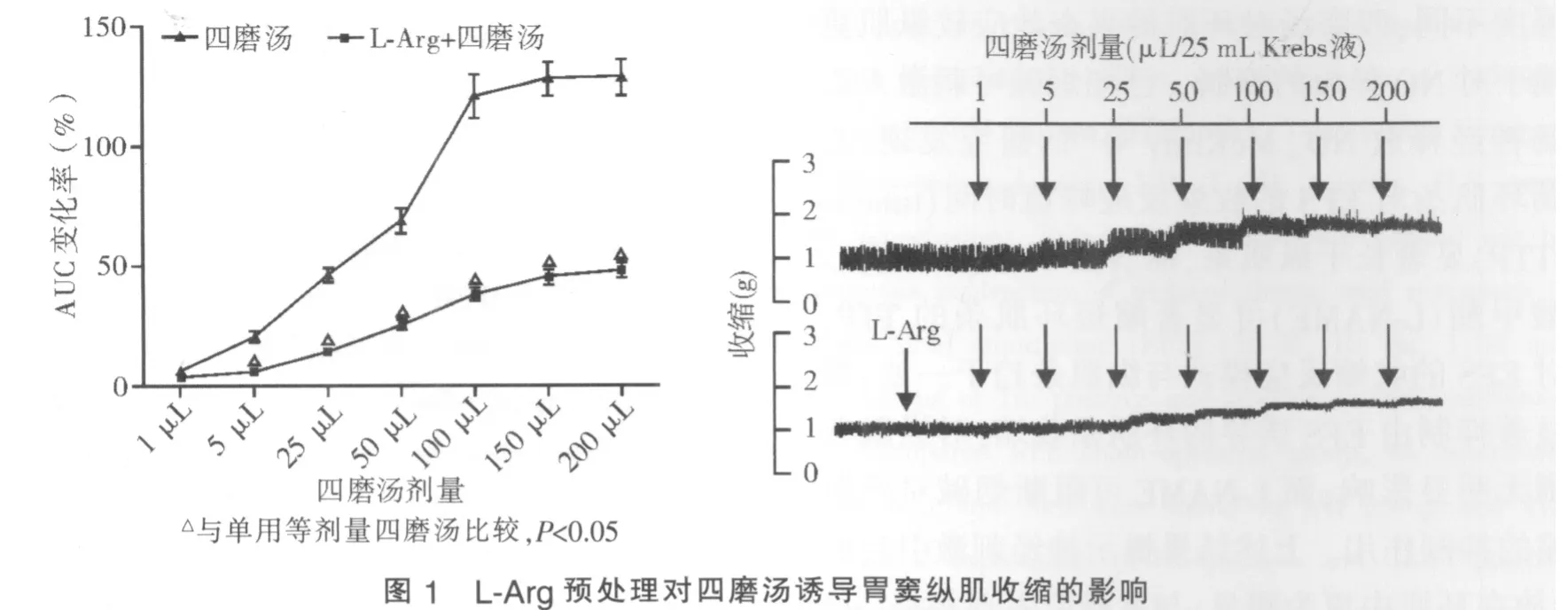
一、L-Arg预处理对四磨汤诱导胃窦纵肌收缩的影响
单用四磨汤能剂量依赖性地促进胃窦纵肌条收缩(F=80.62,P=0.000)。加入 10-4mol/L L-Arg 后,纵肌条收缩活性与基础状态相比无明显变化;继续加入梯度剂量四磨汤,纵肌条收缩活性虽然仍呈剂量依赖性增强(F=66.363,P=0.000),但量效曲线较单用四磨汤显著下移(见图1),表明NO可部分阻断四磨汤对胃窦纵肌的兴奋效应。其中加入LArg+1 μL四磨汤后的纵肌条收缩活性较基础值增加3.43%±0.78%,与单用等剂量四磨汤(增幅6.24%±0.64%)相比差异无统计学意义;四磨汤剂量增至5~200 μL,加入L-Arg+四磨汤后的纵肌条收缩活性增幅均显著低于单用等剂量四磨汤,LArg+200 μL四磨汤的纵肌条收缩活性增幅为组内最高,但仍显著低于单用等剂量四磨汤(48.02%±3.38%对 128.84%±7.47%,P<0.05)。
二、L-Arg预处理对四磨汤诱导胃窦环肌收缩的影响
单用四磨汤能剂量依赖性地促进胃窦环肌条收缩(F=94.01,P=0.000)。加入 10-4mol/L L-Arg 后,环肌条收缩活性与基础状态相比无明显变化;继续加入梯度剂量四磨汤,环肌条收缩活性虽然仍呈剂量依赖性增强(F=73.375,P=0.000),但量效曲线较单用四磨汤显著下移(见图2),表明NO可部分阻断四磨汤对胃窦环肌的兴奋效应。其中加入LArg+1 μL四磨汤后的环肌条收缩活性增幅即已显著低于单用等剂量四磨汤(-2.53%±0.31%对4.56%±0.84%,P<0.05);L-Arg+150 μL 四磨汤的环肌条收缩活性增幅为组内最高,但仍显著低于单用等剂量四磨汤(39.40%±2.73%对 141.47%±9.05%,P<0.05)。
三、L-Arg预处理后四磨汤诱导的胃窦纵肌、环肌收缩活动的差异

经L-Arg预处理的胃窦平滑肌条,加入低中剂量(1~50 μL)四磨汤后,纵肌条收缩活性增幅显著高于环肌条(1 μL:3.43%±0.78%对-2.53%±0.31%,5 μL:6.02%±0.90%对 1.80%±0.59%,25 μL:14.38%±1.13%对 9.34%±1.01%,50 μL:25.58%±2.16%对 17.66%±1.37%,P均<0.05);加入高剂量(100~200 μL)四磨汤后,纵肌条与环肌条收缩活性增幅无明显差异(见图3)。单用1~200 μL四磨汤,对纵肌条与环肌条收缩活性的影响无明显差异。

讨 论
NO是肠神经系统中重要的非肾上腺素能非胆碱能抑制性神经递质,可由其前体L-Arg在NOS的作用下转化生成,对胃肠运动具有负向调控作用。本课题组的前期研究[1,2]显示四磨汤主要通过兴奋胆碱能受体对胃窦平滑肌产生促收缩作用。有研究发现抑制内源性NO可增强电场刺激(electrical field stimulation,EFS)诱导的胆碱能反应[4],并使平滑肌对EFS显现出非胆碱能兴奋效应[5]。鉴于四磨汤的主要组分槟榔提取物能显著抑制iNOS[3],本研究对四磨汤是否还可通过抑制NO释放调节胃窦平滑肌收缩进行了探讨。
作为NO的前体,L-Arg对静息状态的胃窦平滑肌收缩并无调节作用[6],本研究结果与之相符。通过本研究数据可发现,以L-Arg预处理大鼠胃窦平滑肌条,外源性NO对经四磨汤作用后处于兴奋状态的平滑肌条产生了明显的抑制效应,但尚不能完全阻断平滑肌条收缩活性增强的趋势,表明抑制NO释放可能是四磨汤促进胃窦平滑肌收缩的机制之一,但并非主要机制。后续研究拟检测四磨汤作用后胃窦平滑肌NO含量的变化,以进一步明确该作用机制。
本研究还发现,在外源性NO的作用下,四磨汤对胃窦纵肌条与环肌条的促收缩作用存在差异。经L-Arg+低中剂量四磨汤作用的环肌条,收缩活性增幅显著低于纵肌条,而单用四磨汤对纵、环肌条收缩活性的影响无明显差异,提示NO在纵、环肌中的作用程度不同,四磨汤对环肌的兴奋效应较纵肌更多依赖于对NO释放的抑制。已知烟碱可刺激人乙状结肠神经释放NO。McKirdy等[7]的研究发现,乙状结肠环肌条对EFS的收缩反应峰值时间(time to peak,TTP)显著长于纵肌条,而NOS抑制剂硝基-L-精氨酸甲酯(L-NAME)可显著缩短环肌条的TTP,使之对EFS的收缩反应模式与纵肌条趋于一致;烟碱可显著抑制由EFS诱导的环肌条收缩,对纵肌条收缩则无明显影响,而L-NAME可阻断烟碱对环肌条收缩的抑制作用。上述结果提示神经刺激引起的NO释放在环肌中更为明显,与本研究发现相符。目前虽无直接证据表明NO对胃窦纵、环肌具有不同影响,但关于NO合成相关酶类分布的研究发现,参与从L-瓜氨酸再合成NO前体L-Arg的精氨酸琥珀酸合成酶和裂解酶分布于犬类全消化道环肌神经束,但仅分布于回结肠纵肌[8];直接参与NO合成的NOS主要分布于鸽全消化道肌间、环肌和黏膜下神经丛[9]。这些发现为本研究推论,即四磨汤对大鼠胃窦环肌的促收缩作用较纵肌更多依赖于抑制NO释放提供了理论上的支持。
综上所述,四磨汤对大鼠胃窦平滑肌具有明显促收缩作用,该作用部分是通过抑制NO释放实现的;四磨汤对胃窦环肌的兴奋效应较纵肌更多依赖于抑制NO释放。关于四磨汤调节胃窦平滑肌收缩的其他机制,尚待进一步研究。
1 戴迟兵,刘娜,陈文妹,等.四磨汤对大鼠胃窦平滑肌影响及其机制的研究[J].胃肠病学,2011,16(10):605-608.
2 钱伟,戴迟兵,陈文妹,等.N受体在四磨汤对胃窦平滑肌影响中的作用[J].胃肠病学和肝病学杂志,2011,20(11):1029-1032.
3 Bhandare A,KshirsagarA,Vyawahare N,etal.Evaluation of anti-migraine potential of Areca catechu to prevent nitroglycerin-induced delayed inflammation in rat meninges:possible involvement of NOS inhibition.J Ethnopharmacol,2011,136(1):267-270.
4 Garella R,Baccari MC.Contribution of endogenous nitrergic and peptidergic influences to the altered neurally-induced gastric contractile responses in strips from dystrophic(mdx)mice[J].Regul Pept,2010,160(1-3):57-63.
5 Shuttleworth CW,Sanders KM,Keef KD.Inhibition of nitric oxide synthesis reveals non-cholinergic excitatory neurotransmission in the canine proximal colon[J].Br J Pharmacol,1993,109(3):739-747.
6 Okuno Y,Kondo T,Saeki A,et al.Colon-specific contractile responses to tetrodotoxin in the isolated mouse gastrointestinal tract[J].Auton Autacoid Pharmacol,2011,31(1-2):21-30.
7 McKirdy HC,Richardson CE,Green JT,etal.Differential effect of nitric oxide synthase inhibition on sigmoid colon longitudinal and circular muscle responses to nicotine and nerve stimulation in vitro[J].Br J Surg,2004,91(2):229-234.
8 Daniel EE, Wang YF, Salapatek AM, et al.Arginosuccinate synthetase,arginosuccinate lyase and NOS in canine gastrointestinal tract:immunocytochemical studies[J].Neurogastroenterol Motil,2000,12(4):317-334.
9 Mirabella N,Lamanna C,AssisiL,etal.The relationships of nicotinamide adenine dinucleotide phosphate-d to nitric oxide synthase,vasoactive intestinal polypeptide,galanin and pituitary adenylate activating polypeptide in pigeon gut neurons[J].Neurosci Lett,2000,293(2):147-151.

