卷枝毛霉发酵产壳聚糖酶的条件优化
何灏彦
(湖南化工职业技术学院化工系,湖南 株洲412004)
壳聚糖是甲壳素脱乙酰基后的产物,是一种天然的阳离子型直链氨基生物多糖。壳聚糖具有生物相容性,无毒,无过敏反应,但通常分子量很大、只能溶于某些酸性溶液中,使得它的应用受到很大的限制,甚至其某些特殊功能只有在降解成壳寡糖后才能表现出来。壳聚糖的降解方法主要包括化学法、物理法、酶解法[1],其中,酶解法具有能耗低、原料价廉、环境污染小、反应条件温和、易控制、设备简单、产品生物活性高等优点,具有广阔的应用前景[2]。
壳聚糖酶是一种对线性壳聚糖具有分解作用的专一性酶,可以选择性地、特异性地切断壳聚糖的β-1,4-糖苷键,得到特定分子量范围的壳寡糖[3]。作者在此以壳聚糖为诱导物,诱导卷枝毛霉产生壳聚糖酶,并对产酶条件进行了优化。
1 实验
1.1 试剂
pH 值为7.2的 Tris-HCl缓冲溶液:50.0mL 0.1mol·L-1Tris+44.7mL 0.1mol·L-1HCl。
DNS(3,5-二硝基水杨酸)试剂:3,5-二硝基水杨酸1%、苯酚0.2%、亚硫酸钠0.05%、氢氧化钠1%、酒石酸钾钠20%,贮存于棕色瓶中,一周后稳定。
1.2 培养基
PDA斜面培养基:称取马铃薯200g,去皮,切块,煮沸0.5h后用纱布过滤,加20g葡萄糖、20g琼脂,溶化后补水至1000mL,121℃灭菌20min。
葡萄糖-硫酸铵培养基:葡萄糖2%,KH2PO40.1%,(NH4)2SO40.5%,不同质量(0.0g,0.2g,0.4g,0.6g,0.8g,1.0g)的脱乙酰度为99%的壳聚糖,自来水1000mL。分装后,121℃灭菌20min。
1.3 卷枝毛霉的培养及壳聚糖酶的分离纯化
在含一定浓度壳聚糖的葡萄糖-硫酸铵液体培养基中,将卷枝毛霉于一定温度、一定pH值、一定转速下摇床培养一定时间;将10L培养基通过砂芯漏斗过滤,得到菌丝体;将其置于研钵中,用玻璃粉研磨1h,然后用pH 值为7.2的20mmol·L-1Tris-HCl缓冲溶液稀释;最后于2500×g离心20min,取上清,即得含有壳聚糖酶的粗酶液。
纯化:将粗酶液离心(20 000×g),取200mL上清液,加入固体硫酸铵达到60%至饱和;再离心(20 000×g)15min,取上清液,加入固体硫酸铵达到80%至饱和;再离心,取沉淀溶解于5mmol·L-1醋酸钠缓冲溶液(pH值5.3)中,并透析1次;然后上20mL二乙胺乙基纤维素柱,用pH值为5.5的醋酸钠缓冲溶液以5~100mmol·L-1梯度洗脱,流速60mL·h-1,得到的酶稀释液大约是50mmol·L-1的醋酸钠,通过胶棉过滤浓缩到1mL;再用pH值为7.2的20mmol·L-1氯化三羟甲基甲烷缓冲溶液透析;然后上3mL二乙胺乙基纤维素柱,先用上述相同浓度的醋酸钠缓冲溶液洗脱(流速12mL·h-1),再依次用40 mL氯化钠溶液(0~0.3mol·L-1)、15mL 0.3mol·L-1氯化钠溶液、30mL 0.45mol·L-1氯化钠溶液梯度洗脱(洗脱剂均配有pH值为7.2的20 mmol·L-1Tris-HCl缓冲溶液),即得到纯化的壳聚糖酶液。
1.4 产酶条件的优化
在不同的壳聚糖浓度、培养温度、培养基pH值、培养时间和摇床转速下对卷枝毛霉的产酶能力进行比较,以确定卷枝毛霉发酵产壳聚糖酶的最佳条件[4]。
1.5 壳聚糖酶活力的测定方法
首先,按DNS比色法,以葡萄糖浓度(x)为横坐标、吸光度(y)为纵坐标绘制标准曲线,然后用最小二乘法进行线性回归,得拟合回归方程:y=0.2604x-0.0441,相关系数R=0.9953,表明葡萄糖浓度与吸光度线性关系良好。
然后,用DNS法进行酶活力测定(以蒸馏水的DNS反应液为参照):取壳聚糖酶液2mL,与2mL质量分数为1%的壳聚糖溶液混合,50℃下保温30min;再用质量分数为1%的NaOH溶液调pH值大于8.0,将未被降解的壳聚糖沉淀出来,于3000r·min-1离心10min;取上清液1mL,用DNS法测定吸光度,再根据回归方程计算还原糖浓度,表征培养液中酶的活力[5]。
2 结果与讨论
2.1 壳聚糖浓度对卷枝毛霉产酶能力的影响
固定培养温度为35℃、培养基pH值为5、培养时间为80h、摇床转速为180r·min-1,考察壳聚糖浓度对卷枝毛霉产酶能力的影响,结果见图1。

图1 壳聚糖浓度对产酶能力的影响Fig.1 Effect of chitosan concentration on enzyme production capacity
由图1可知,卷枝毛霉的产酶能力随壳聚糖浓度的增大先升高后降低,在壳聚糖浓度为0.8g·L-1时,产酶能力最高。这是因为,壳聚糖浓度增大,对卷枝毛霉产酶的诱导作用相应增强,起到了对卷枝毛霉的驯化作用,从而提高了卷枝毛霉的产酶能力;当壳聚糖浓度增大到一定程度后,由于溶液的粘度增大影响到培养液的溶氧效果,微生物代谢率降低,卷枝毛霉的产酶能力相应下降;而且壳聚糖是一种抑菌物质,浓度越高,对微生物的抑制作用越强,这也会影响微生物的生长和产酶[6]。因此,选择最佳壳聚糖浓度为0.8g·L-1。
2.2 培养温度对卷枝毛霉产酶能力的影响
培养温度对产酶能力有着双重影响,一方面,升高温度可以提高卷枝毛霉的产酶速率,但随着温度的升高,酶会逐渐地变性失活。固定壳聚糖浓度为0.8g·L-1、培养基pH值为5、培养时间为80h、摇床转速为180r·min-1,考察培养温度对卷枝毛霉产酶能力的影响,结果见图2。

图2 培养温度对产酶能力的影响Fig.2 Effect of culture temperature on enzyme production capacity
由图2可知,卷枝毛霉的产酶能力随着培养温度的升高先升高后降低,在培养温度为40℃时,产酶能力最高。因此,选择最佳培养温度为40℃。
2.3 培养基pH值对卷枝毛霉产酶能力的影响
固定壳聚糖浓度为0.8g·L-1、培养温度为40℃、培养时间为80h、摇床转速为180r·min-1,考察培养基pH值对卷枝毛霉产酶能力的影响,结果见图3。
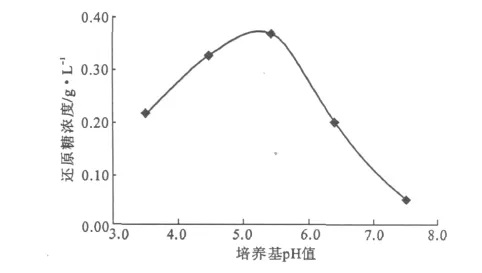
图3 培养基pH值对产酶能力的影响Fig.3 Effect of pH value of culture medium on enzyme production capacity
由图3可知,卷枝毛霉的产酶能力随培养基pH值的增大先升高后降低,在培养基pH值为5.5时,产酶能力最高。这是因为,壳聚糖的溶解度与pH值有很大关系,壳聚糖只能在酸性溶液中溶解,在pH值为7.5时则完全不溶,即pH值过高时,卷枝毛霉很难利用沉淀的壳聚糖,其生长及产酶都受到抑制;但pH值过低对卷枝毛霉的生长不利,培养液的生物量低,导致酶活降低[7]。因此,选择最佳培养基pH值为5.5。
2.4 培养时间对卷枝毛霉产酶能力的影响
固定壳聚糖浓度为0.8g·L-1、培养温度为40℃、培养基pH值为5.5、摇床转速为180r·min-1,考察培养时间对卷枝毛霉产酶能力的影响,结果见图4。

图4 培养时间对产酶能力的影响Fig.4 Effect of culture time on enzyme production capacity
由图4可知,培养时间为84h时,卷枝毛霉的产酶能力最高。因此,选择最佳培养时间为84h。
2.5 摇床转速对卷枝毛霉产酶能力的影响
固定壳聚糖浓度为0.8g·L-1、培养温度为40℃、培养基pH值为5.5、培养时间为84h,考察摇床转速对卷枝毛霉产酶能力的影响,结果见图5。
由图5可知,卷枝毛霉的产酶能力随摇床转速的加快先升高后降低,在摇床转速为180r·min-1时,产酶能力最高。这是因为,摇床转速能影响培养液的溶氧效果,从而影响卷枝毛霉的产酶能力,但过量的溶氧对菌株合成酶不利[8]。因此,选择最佳摇床转速为180r·min-1。

图5 摇床转速对产酶能力的影响Fig.5 Effect of rotation speed on enzyme production capacity
3 结论
以壳聚糖为诱导物,诱导卷枝毛霉产壳聚糖酶的最佳条件为:诱导物壳聚糖浓度0.8g·L-1、培养温度40℃、培养基pH值5.5、培养时间84h、摇床转速180r·min-1。
[1]夏文水.酶法改性壳聚糖的研究进展[J].无锡轻工大学学报(食品与生物技术),2001,20(5):550-554.
[2]张立彦,曾庆孝.酶法在低聚壳聚糖制备上的研究现状及展望[J].湛江海洋大学学报,2000,20(4):72-78.
[3]吴小勇,曾庆孝,朱志伟,等.酶在壳聚糖制备中的应用[J].广州食品工业科技,2004,20(1):95-99.
[4]王凤琴.甲壳低聚糖生产工艺研究[J].食品工业科技,2003,24(3):69-71.
[5]Kittur S,Kumar A B V,Gowda L R,et al.Chitosanolysis by a pectinase isozyme of Aspergillus niger——A non-specific activity[J].Carbohydrate Polymers,2003,53(2):191-196.
[6]刘羿君,蒋英,封云芳,等.特种纤维素酶催化水解壳聚糖及壳寡糖的制备研究[J].功能高分子学报,2005,18(2):325-328.
[7]陈小娥,夏文水,余晓斌.壳聚糖酶高产菌株的筛选及酶解产物的定性[J].食品与发酵工业,2004,(2):57-61.
[8]段杉,彭喜春,彭志英.无花果沙雷氏菌(Serratia ficaria)CH-0203产壳聚糖酶发酵条件的研究[J].食品工业科技,2003,24(6):20-22.

