骨形态发生蛋白-2基因工程菌的构建及可溶性研究
赵 瑾,陈 洪,林陈水
(浙江工业大学 药学院,浙江 杭州310032)
骨形态发生蛋白-2(Bone Morphogenetic Protein-2,BMP-2)属于转化生长因子超家族成员[1],BMP-2因其诱导成骨活性最强而成为骨科研究的热点[2].天然的 BMP-2含有114个氨基酸,其成熟肽中含有7个高度保守的半胱氨酸,活性形成多为其同源二聚体.骨组织中骨形态发生蛋白含量低,提取工艺复杂,产物纯度有限,难以适应科学研究和临床应用的需要;真核表达系统制备产物活性相对较高,但表达量低、生产成本高、周期长[3];大肠杆菌是目前基因工程中应用最为广泛的宿主细胞,具有操作简单,成本低,周期短,产量大等特点,但外源蛋白往往错误折叠以没有生物活性的包涵体形式表达[4].麦芽糖结合蛋白(MBP)是一种融合伴侣,分子量约为42kD,可增加与之结合的目的蛋白的可溶性[5-6].T载体是近年来发展起来的一种用于直接克隆PCR产物的新型载体,pMT-L是由本实验室构建的去除信号肽序列的MBP胞内融合表达型T载体,可直接用XcmⅠ酶切该载体,插入PCR产物,一步法构建融合表达基因工程菌[7].本研究通过将目的基因BMP-2用TA克隆法重组到无信号肽MBP基因的下游,在胞内可溶性表达目的蛋白,避免沉淀或聚合成为多聚体.因融合伴侣与BMP-2之间连有“连接肽-6His-Eksite”序列,有利于目的蛋白的分离纯化,降低生产成本.
1 材料和方法
1.1 材 料
1)质粒载体及菌株:pMT-L(胞内融合表达型T载体),含BMP-2编码基因的Fsx重组菌株均由实验室构建保存;E.coliDH5α菌株,E.coliBL21(DE3)菌株均由实验室保存.
2)酶及主要试剂:T4噬菌体DNA连接酶购自Fermentas,XcmⅠ限制性内切酶购自NEB,pfuDNA聚合酶,TaqplusDNA聚合酶均购自上海Sangon.
1.2 方 法
1.2.1 目的基因的扩增
Fsx菌株含有编码“6His-Eksite-BMP-2”基因序列,根据其序列设计正反两条引物,并委托南京金斯瑞公司合成 P15′-CTGATGACGATGACAAACAAGCAAAG-3′,P2:5′-AGTTAGCGACAGCCACAACCTTCCACC-3′.以Fsx菌为模板,以P1,P2为引物,在TaqPlus DNA聚合酶的作用下,通过30个循环扩增合成目的基因片段[8].PCR体系与程序为:总体积50μL,94℃预变性3min,94℃变性30s,63℃退火30s,72℃延伸60s,进行30个循环;72℃终期延伸10min,4℃保温10min[9].PCR产物经2.5%琼脂糖凝胶电泳鉴定.
1.2.2 重组质粒的构建
将上述1.2.1得到的PCR产物用TA克隆法重组到质粒载体pMT-L上,具体方法为:取8μL pMT-L质粒载体,加1.5μLXcmⅠ限制性内切酶,总体系为50μL,37℃酶切2h,用0.8%琼脂糖凝胶电泳和3SDNA Gel Purification Kit试剂盒纯化回收大片段,并在回收过柱时加入10μL PCR产物,回收后的产物用1μL T4DNA连接酶,4℃连接过夜,转化E.coliDH5α,用含氨苄青霉素和 X-gal的平板培养筛选含有外源基因克隆[10].
1.2.3 正向连接克隆的鉴定
用菌落PCR法鉴定正向连接的克隆[11-12],具体方法为:用无菌牙签挑取上述步骤培养得到的白色单菌落悬浮于50μL双蒸水中制成PCR模板,以BMP-2正向引物和T7反向引物(T7终止子处设计的一条引物),在pfuDNA聚合酶作用下,经过30个循环,PCR产物用2.5%琼脂糖凝胶电泳检测.
1.2.4 工程菌的构建
用质粒抽提试剂盒抽提步骤1.2.3鉴定阳性克隆的质粒,转化E.coliBL21(DE3),用含氨苄抗生素的LB琼脂平板培养过夜.
1.2.5 重组蛋白的表达
挑取上述步骤的单菌落于3mL LB培养基(含Amp终质量浓度为50μg/mL),33 ℃,200r/min振荡培养至OD600=0.5,加入终浓度为0.1mmol/L IPTG,诱导3h,离心收集菌体沉淀,全菌SDSPAGE鉴定重组蛋白的表达.表达结果符合预期的重组菌送金斯特公司进行DNA测序,进一步鉴定证实.
1.2.6 BMP-2的可溶性分析
取测序正确的甘油菌分别接种于初始pH为6.0和7.0的3mL LB培养基中(含Amp终质量浓度为50μg/mL),33℃振荡培养过夜后按0.5%的接种量转接到200mL含Amp终质量浓度为50μg/mL的LB培养基中,培养至OD600约0.5时加入终浓度为0.1mmol/L IPTG,28 ℃诱导培养16h,收集菌体沉淀,破菌后,再次离心收集上清和沉淀,分别跑SDS-PAGE凝胶电泳,分析鉴定融合蛋白的可溶性.
2 结果与分析
2.1 含“6His-Eksite-BMP-2”PCR产物电泳结果分析
人成骨蛋白BMP-2含有114个氨基酸,含“Eksite-BMP-2”DNA片段的PCR扩增产物长度约为359bp,以100bp Marker为标准,从凝胶电泳结果看出,其PCR产物片段大小与预期值相符(图1).
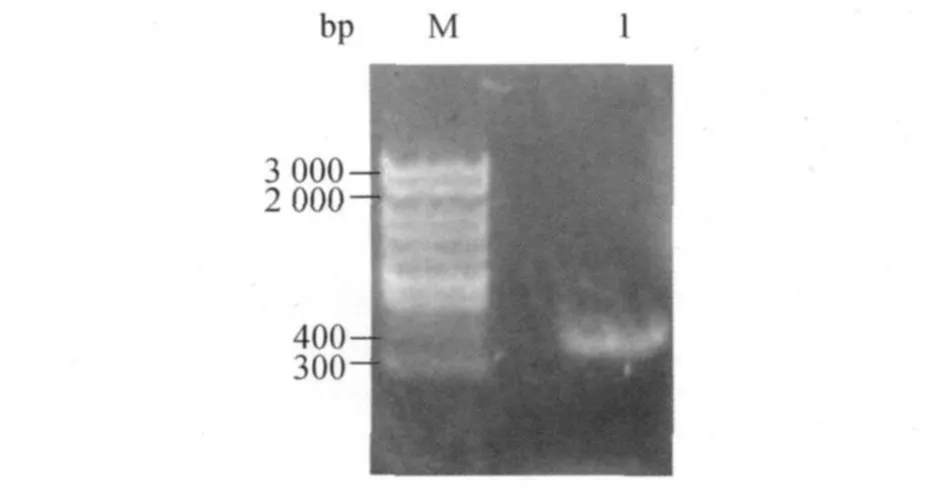
图1 PCR产物电泳结果分析Fig.1 Analysis of the electrophoresis results of PCR product
2.2 PCR鉴定阳性克隆及表达载体pMBP-BMP-2
质粒载体pMT-L的MBP的下游含有LacZ序列,其经XcmⅠ酶切后,目的基因替代了原有的LacZ序列直接插入到此载体上,构建含MBP-连接肽-6His-Eksite-BMP-2的基因序列的表达载体,可利用蓝白斑筛选法筛选含有目的片段的重组子,但是PCR产物重组于载体中没有方向性,菌落PCR法筛选正向连接的克隆,以P1和T7反向为正反向引物.鉴定产物经琼脂糖凝胶电泳结果显示,在400bp附近出现一条特异性条带,与理论的DNA片段大小相符(图2),初步证实目的基因已成功插入到载体上,构建出带有MBP融合伴侣,能在胞内表达融合蛋白 MBP-BMP-2的表达载体pMBPBMP-2.
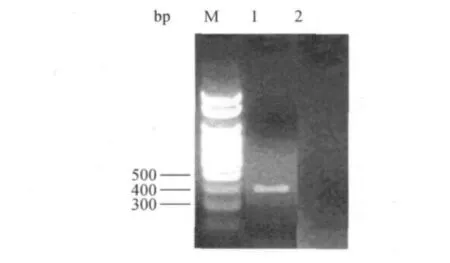
图2 菌落PCR鉴定结果Fig.2 Appraisal results of the colonies PCR
2.3 融合蛋白的表达
MBP的分子量大小约为42kD,融合蛋白MBP-BMP-2的分子量大小约为55kD.BMP-2基因工程菌,在0.1mmol/L IPTG 的诱导下,融合蛋白表达情况如图3.SDS-PAGE结果显示,在42.0~66.7kD之间有明显的目的蛋白条带.初步证实构建的工程菌能稳定地大量表达MBP-BMP-2融合蛋白,且分子量大小与理论值相符.
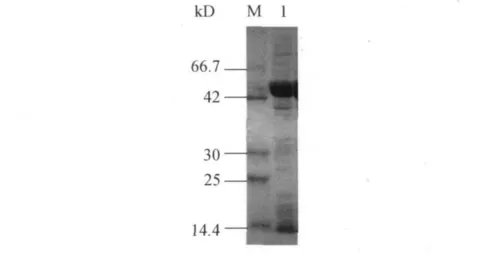
图3 融合蛋白的表达结果分析Fig.3 Analysis of the results of fusion protein expression
2.4 BMP-2的可溶性分析
有文献[13-15]报道 BMP-2在E.Coli中以包涵体形式表达,而本研究设计的是 MBP融合伴侣与BMP-2共同表达的融合蛋白,MBP融合伴侣具有很好的溶解性.因此,必需对BMP-2融合蛋白的可溶性进行分析,以便更好指导分离纯化工作.
有文献报道,BMP-2与DsbA形成的融合蛋白诱导表达后,在pH为6.0时融合蛋白以沉淀形式为主,而在pH 7.0时可溶性较好.所以本研究选取了在培养基pH为6.0和7.0两种条件下,分别诱导MBP-BMP-2融合蛋白的表达,经破菌离心,SDS-PAGE检测,上清和沉淀中BMP-2融合蛋白含量如图4.
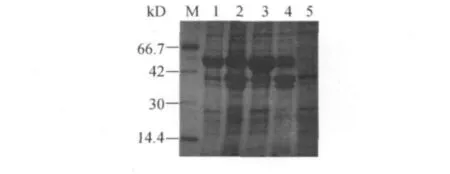
图4 MBP-BMP-2融合蛋白的可溶性表达Fig.4 Soluble expression of MBP-BMP-2fusion protein
由图4可知:两种pH环境下都能使融合蛋白以可溶形式表达,且量较大,约占总BMP-2融合蛋白总量的一半以上,上清中存在较为明显的融合蛋白目的条带,一方面证明BMP-2的可溶性较好,不容易受环境pH的影响,另一方面说明MBP作为融合伴侣增溶作用较好;沉淀中出现目的蛋白条带,分析其原因可能是少量融合蛋白以包涵体形式进行了表达.
3 结 论
T载体是直接克隆或表达PCR产物的新型载体,广泛应用于目标蛋白的融合表达,且操作简便、方法快捷、连接效率高.本研究用PCR方法扩增得到编码BMP-2成熟肽基因的DNA序列,用XcmⅠ酶切法一步构建胞内融合表达型T载体pMBPBMP-2,经转化诱导表达得到BMP-2融合蛋白,可溶性分析表明,融合蛋白大量存在于上清中,且条带明显,表达量较大,经测序鉴定,BMP-2正确插入,成功构建能在E.coli胞内主要以可溶性表达的BMP-2工程菌.MBP既是融合伴侣,在增加目标蛋白溶解性的同时又可作为亲和标签,通过交联淀粉亲和层析一步纯化目标蛋白[16].另一方面,MBP与BMP-2之间带有6His-tag和肠激酶酶切位点,融合蛋白还可以用Ni2+亲和层析一步纯化得到,用蛋白酶酶切分离得到与天然的BMP-2成熟肽氨基酸序列完全一致的BMP-2成熟肽[1].骨形态发生蛋白基因工程菌的构建实现了BMP-2在胞内的可溶性表达,避免了蛋白质在大肠杆菌体内表达形成沉淀二聚体的可能,为大规模生产提供技术支持.也初步验证了融合伴侣MBP的增溶作用,同时它的亲和标签作用,可为后续研究探讨融合蛋白表达条件的优化和分离纯化奠定实验基础.
[1]林陈水,付水星.一种制备骨形态发生蛋白BMP-2成熟肽的方法:中国,CN101235084A[P].2008-08-06.
[2]林陈水,黎小军,王平,梅建凤.人胸腺素α1基因工程菌的构建与表达[J].浙江工业大学学报,2005,33(3):306-309.
[3]方针强,叶钢,欧阳一辛,等.人BMP-7基因重组腺病毒的构建与鉴定[J].第三军医大学学报,2008,30(2):153-156.
[4]孙传秀,赵文志,何盛为,等.重组人骨形态发生蛋白2在大肠杆菌中的可溶性表达和纯化[J].中国组织工程研究与临床康复,2009,13(7):1267-1270.
[5]ROSEMOND J C,SHARON MN M S,PAUL H R,et al.A-bility of MBP or RBP signal peptides to influence folding and in vitro translocation of wild-type and hybrid precursors[J].FEBS Letters,1994,349(2):281-285.
[6]EUGENE D D,VINCENT A V,ROBERT S F,et al.MBPSF,aprominent serum factor in suckling lewis rats that additively inhibits the primary binding of Myelin Basic Protein(MBP)to syngeneic anti-MBP antibodies[J].Immunochemistry,1978,15(1):1-9.
[7]林陈水,于真真,杨丹燕.一种胞内融合表达型前T载体及其制备与应用:中国,CN101381738A[P].2009-03-11.
[8]付水星.重组人骨形态发生蛋白BMP-2工程菌构建及其表达产物的复性研究[D].杭州:浙江工业大学,2007.
[9]J萨姆布鲁克,DW拉塞尔.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002:1217-1265.
[10]张维铭.现代分子生物学实验手册[M].北京:科学出版社,2003:254-258.
[11]毕美霞,韩玲,杨渝珍.一种快速筛选和鉴定重组体的方法-改良菌落PCR[J].同济医科大学学报,1998,27(1):78-79.
[12]李华,刘延琳,夏惠,等.菌落PCR技术在重组质粒筛选与鉴定中的应用[J].西北农林科技大学学报:自然科学版,2004,32(9):35-37.
[13]赵明,王会信,周廷冲.重组人骨形态发生蛋白-2成熟肽在大肠杆菌中表达及其诱导成骨活性[J].生物化学杂志,1994,10(3):319-324.
[14]RUPPERT R,HOFMANN E,SEBALD W.Human bone morphogenetic protein-2contains a heparin-binding site which modifies its biological activity[J].Eur J Biochem,1996,237:295-302.
[15]KUBLE N R,REUTHER J F,FALLER G,et al.Inductive of recombinant human BMP-2produced in a bacterial expression system[J].Int J Oral Maxillofac Surg,1998,27:305.
[16]TERPE K.标签蛋白融合技术概述:从分子生物学基础和生化基础到商用系统[EB/OL].[2011-03-30].http://www.docin.com/p-7734684.html.
——一道江苏高考题的奥秘解读和拓展

