四种拟除虫菊酯的超临界色谱手性分离
高伟亮,金丽霞,傅贤伟,林春绵
(浙江工业大学 生物与环境工程学院,浙江 杭州310032)
根据天然除虫菊花中提取的杀虫组分经结构改造而发展起来的拟除虫菊酯是一类高效、安全、杀虫谱广的化学农药,广泛应用于农林、园艺和家庭卫生等方面的害虫防治.所有拟除虫菊酯农药都具有手性[1],其分子结构中含1~3个手性中心,存在多个对映异构体和非对映异构体,同时三碳环结构的拟除虫菊酯还具有顺反几何异构体[2].但各异构体间生物活性和毒性差异很大[3],如联苯菊酯,对日本青鳉鱼1S-cis-BF比1R-cis-BF的毒性强123倍[4],而对生物菜青虫1R-cis-BF比1S-cis-BF的毒性强300倍以上[5].因此发展拟除虫菊酯农药的对映体分离、获得单一光学纯异构体显得尤为重要,使用单一高效异构体也是未来农药发展的方向.塔娜等[6]以正己烷/异丙醇为流动相在高效液相色谱上实现了甲氰菊酯、高效氯氰菊酯、氰戊菊酯和氯菊酯的对映体分离;LIU等[7]在气相色谱上成功分离了氯氰菊酯和氟氯氰菊酯的顺式异构体.李朝阳等[8]对拟除虫菊酯的手性分离做了较为全面的综述,未见超临界流体色谱应用于拟除虫菊酯农药手性分离的报道.超临界流体色谱(SFC)具有快速、高效、分离时间短等显著特点,它广泛应用于手性对映体的分离[9-10].本研究以Chiralcel OD-H色谱柱为手性固定相,使用超临界色谱法对四种拟除虫菊酯进行对映体分离研究,考察不同改性剂及体积分数对其拆分的影响,并对其分离机理进行了分析探讨.
1 实验部分
1.1 实验仪器
超临界色谱仪:Thar SD-ASFC-2色谱系统(Thar Technologies,Pittsburgh,PA,USA),配有Gilson UV/VIS-151紫外检测器和 Rheodyne 7410手动进样阀.手性色谱柱:Chiralcel OD-H(250mm×4.6mm,i.d.5μm,日本大赛璐化学工业公司),化学结构式为

1.2 材料和溶剂
氯菊酯、联苯菊酯、高效氯氟氰菊酯、氯氰菊酯原药纯度大于95%,由河北保定市星火技术研究所生产,分子结构式分别为
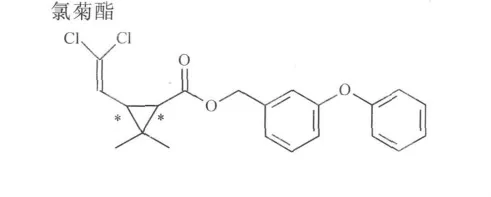

实验所用甲醇、乙醇和异丙醇均为色谱纯,由天津四友精细化学品有限公司生产.实验用CO2纯度为99.9%,由杭州今工特种气体有限公司生产.
1.3 实验方案和色谱参数
拟除虫菊酯农药原药溶于色谱纯乙醇溶液中,浓度为500mg/L.以超临界CO2为流动相,添加甲醇、乙醇或异丙醇为改性剂,通过色谱系统自带Supercritical Chromatography软件调节流动相中改性剂比例(1%,3%,5%,10%,体积比,下同).SFC系统温度36℃,系统背压160bar,流动相流速2.0mL/min,拟除虫菊酯紫外检测波长为220nm.
容量因子k=(t1-t0)/t0;分离因子α=k2/k1;分离度R=1.18(t2-t1)/(w1+w2).其中:t0为系统死时间;t1为相邻两峰中前一峰的保留时间;t2为相邻两峰中后一峰的保留时间;w1和w2为相邻两峰的半高峰宽.通常认为R>1.5时,相邻组分已实现完全分离.
2 结果与讨论
2.1 拟除虫菊酯的对映体分离
氯菊酯和联苯菊酯两个手性中心均位于它们的三碳环上,共有四个手性对映体.氯菊酯在3%异丙醇改性条件下取得最优分离,得到4个色谱峰中的3个,此时它们的分离度分别为:R1-2=1.62,R2-3=1.01,如图1(a)所示.而联苯菊酯在实验条件下始终未能得到有效分离,只有一个色谱峰,图1(b)所示为联苯菊酯在纯CO2条件下的色谱分离图.其他色谱条件:T=36℃,P=160bar,v=2mL/min.

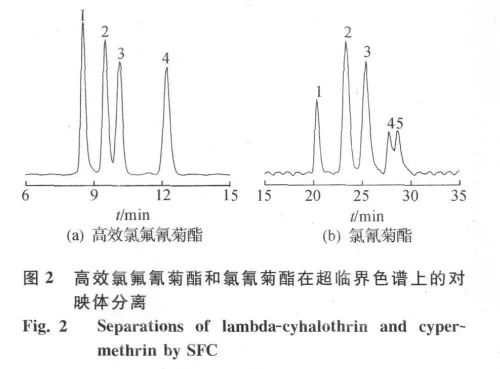
高效氯氟氰菊酯和氯氰菊酯均有三个手性中心.高效氯氟氰菊酯是氯氟氰菊酯的高效体,包括1S-3R-αR,1R-3S-αS,1S-3R-αS,1R-3S-αR四 个 对映体,其在3种醇作为改性剂时都实现了分离,在1%甲醇改性时取得完全分离,此时其分离度分别为R1-2=2.74,R2-3=1.56,R3-4=4.74,如图2(a)所示.氯氰菊酯在1%乙醇改性条件下,得到8个对映体中的5个色谱峰,此时的分离度分别为:R1-2=3.30,R2-3=1.84,R3-4=2.57,R4-5=0.93,如 图 2(b)所示.其他色谱条件:T=36℃,P=160bar,v=2mL/min.
2.2 改性剂对手性分离的影响
在超临界色谱条件下,保持系统温度和压力不变,添加不同的改性剂及改变它们在流动相中的的体积分数,考察不同改性剂及体积分数对手性分离的影响,以高效氯氟氰菊酯为例进行说明,结果如表1所示,色谱条件:T=36 ℃,P=160bar,v=2mL/min.
由表1可知:随着改性剂体积分数的增加,拟除虫菊酯的容量因子逐渐减小,但是分离度却显示出比较复杂的变化.异丙醇和甲醇作为改性剂时,R1-2和R3-4随着改性剂体积分数的增加也逐渐减小;而R2-3先增大后减小,在3%或5%时取得较大值.乙醇作为改性剂时,R1-2在1%和5%时取得较大值,R2-3依然是先增大后减小,而R3-4逐渐减小.当三种改性剂体积分数同为1%时,随着异丙醇—乙醇—甲醇的变化,R1-2逐渐减小,R2-3逐渐增大,而R3-4先增大后减小;当三种改性剂体积分数同为3%时,R1-2先减小后增大,R2-3逐渐增大,而R3-4逐渐减小.可见,随着改性剂及其体积分数的变化,分离度变化较为复杂,在1%甲醇改性时,取得4个对映体的完全分离.

表1 高效氯氟氰菊酯在超临界流体色谱的分离Table 1 Separation of Lambda-cyhalothrin by SFC
2.3 拟除虫菊酯对映体分离机理
手性化合物在手性固定相上的拆分机理尚未被完全解释清楚,“三点作用”原理[11]常被用来解释推理对映体的分离行为.手性对映体与手性固定相之间存在着诸如偶极-偶极、氢键-氢键、π-π作用和非手性作用(如空间位阻作用)等作用力.这些作用力相互作用,导致对映体与手性固定相之间形成的非对映体络合物的稳定相有差异而得到分离.
纤维素衍生物手性Chiralcel OD-H柱,其结构包含C ==O,—NH和苯甲基.文中四种拟除虫菊酯农药分子都含有C ==O,它们可与手性固定相的C ==O产生偶极-偶极作用;同时菊酯酸组成结构上的卤素取代基可与手性固定相的—NH产生氢键作用;而菊酯醇组成结构上的二苯醚或联苯基团可与手性固定相的二甲基苯产生π-π作用.高效氯氟氰菊酯和氯氰菊酯的醇组成结构上含有—CN,可与固定相的—CH3产生π-π作用,但是两者的分离效果差别较大,高效氯氟氰菊酯取得良好的分离而氯氰菊酯只能分离得到5个色谱峰.联苯菊酯的酸组成结构含有3-(2-氯-3,3,3-三氟丙烯基)-2,2-二甲基环丙烷羧酸,基团较大,在手性识别过程中可能产生空间位阻作用而导致其不能得到分离,而拥有同样大基团的高效氯氟氰菊酯似乎不受其影响依然得到较好的分离.如上所述,拟除虫菊酯拥有较多的官能团,在手性识别过程中可与手性固定相产生多种多样的作用力,在拆分过程中的各种作用力的作用机理有待于进一步研究.
3 结 论
使用超临界流体色谱,以Chiralcel OD-H柱为手性固定相,对4种拟除虫菊酯进行手性分离.高效氯氟氰菊酯在1%甲醇改性条件下实现了四个对映体的完全分离(R1-2=2.74,R2-3=1.56,R3-4=4.74),氯菊酯在3%异丙醇改性条件下分离得到了3个色谱出峰(R1-2=1.62,R2-3=1.01),联苯菊酯未能实现对映体分离,氯氰菊酯在1%乙醇改性条件下分离得到5个色谱出峰(R1-2=3.30,R2-3=1.84,R3-4=2.57,R4-5=0.93).改性剂种类和体积分数对拟除虫菊酯的对映体分离有较为重要的影响.拟除虫菊酯类农药官能团较多结构复杂,在手性拆分过程中与手性固定相可产生较多的氢键、偶极-偶极、π-π作用和空间位阻作用等,不同程度的影响手性分离.
[1]WONG C S.Environmental fate processes and biochemical transformations of chiral emerging organic pollutants[J].A-nal Bioanal Chem,2006,386(3):544-558.
[2]任露露,颜冬云,徐绍辉.拟除虫菊酯异构体差异降解与转化[J].农药,2009,48(8):555-558.
[3]LIU Wei-ping,GAN Jian-ying,QIN Su-jie.Seperation and aquatic toxicity of enantiomers of synthetic pyrethroid insecticides[J].Chirality,2005,17:127-133.
[4]WANG Lu-mei,LIU Wei-ping,YANG Cai-xia,et al.Enantioselectivity in estrogenic potential and uptake of bifenthrin[J].Environ Sci Technol,2007,41(17):6124-6128.
[5]张聪,刘慧刚,章晓风.联苯菊酯对靶标生物及非靶标生物毒性的对映体差异[J].浙江工业大学学报,2009,37(4):366-371.
[6]塔娜,李想,冯建芳,等.拟除虫菊之类农药的非对映和对映异构体分离[J].中国环境科学,2006,26(1):87-90.
[7]LIU Wei-ping,GAN jian-ying.Separation and analysis of diastereomers and enantiomers of cypermethrin and cyfluthrin by gas chromatography[J].J Agric Food Chem,2004,52:755-761.
[8]李朝阳,张智超,张玲,等.拟除虫菊酯农药手性分离的研究进展[J].现代农药,2006,5(5):1-5.
[9]DEBBY M,YVAN V H.Chiral separation in sub-and supercritical fluid chromatography[J].Journal of Separation Science,2008,31:1252-1273.
[10]SU Bao-gen,BAO Zong-bi,XING Hua-bin,et al.Enantioseparation of paroxetine intermediate on an amylase-derived chiral stationary phase by supercritical fluid chromatography[J].Journal of Chromatography A,2009,1216:5140-5146.
[11]DALGLIESH C E.The optical resolution of aromatic aminoacids on paper chromatograms[J].Journal of Chemical Society,1952,137:3940-3942.

