右丙亚胺对接受含蒽环类药物女性乳腺癌患者的心脏保护作用前瞻性研究
李 峻,肖祥胜
(1.解放军第458医院乳腺科,广东 广州 510602 ;2.中山大学肿瘤防治中心乳腺科,广东 广州 510060)
蒽环类药物是高效且被广泛应用的细胞毒性药物,但临床应用价值受到其心脏毒性限制。心肌损伤是其主要特点,有些心肌损伤的特征性指标在首次使用蒽环类药物时就能检测到,即使非常低剂量的蒽环类药物即可引起心肌损伤[1]。随着医疗水平的提高,晚期乳腺癌患者经过手术治疗及术后放化疗等辅助治疗后,生存期明显延长,10年存活率可以达到80%以上[2]。因此有必要重视这类人群的心脏毒性,然而,患者接受蒽环类药物的能力随着累积剂量的增加而伴随的心脏毒性问题又成为医务人员及患者面临的另一个重大问题,所以如何有效减少、预防接受蒽环类药物治疗后心脏毒性成为临床工作者重点研究的方向。我科从2008年开始,以女性乳腺癌患者术后辅助化疗阶段为研究对象,观察右丙亚胺对这类人群的心脏毒性反应的早期预防作用。
1 材料与方法
1.1 一般资料
1.1.1 病例选择 自2008年10月至2009年5月,解放军第458医院乳腺科与中山大学肿瘤防治中心乳腺科行乳腺癌改良或标准根治术后行辅助化疗患者中,选择符合所有下述标准的病例入组。
1.1.2 入组标准 (1)18~60岁,均为首次确诊且均无恶性肿瘤病史。(2)病理证实为浸润性导管癌。(3)其TNM分期为Ⅱa期及IIb期。(4)行辅助化疗术前患者签署知情同意书。
1.1.3 排除标准 相关药物过敏史者;合并其他肿瘤者、心脏病病史者、严重感染者;器官移植史者;加用曲妥珠单抗等具有心脏毒性药物者;同时接受放疗及既往接受过化疗者;其它可能影响患者入组和评估结果的因素。
1.1.4 脱离标准 任何须要停止该方案的副作用或合并症;患者要求停止该方案。停止该方案后,仍应随访患者。
本研究共纳入117例患者,两组患者背景资料和疾病状态统计学上均无差异(P=0.57,秩和检验),见表1。
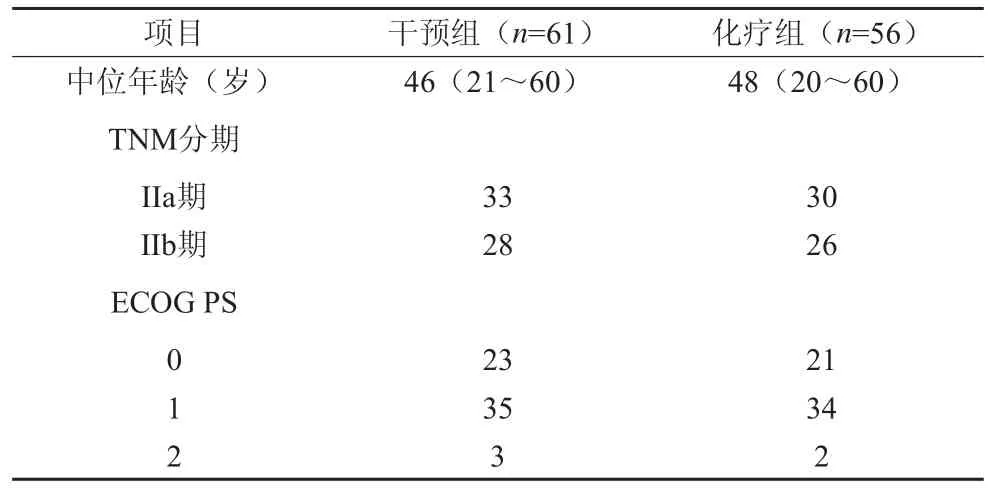
表1 117例乳腺癌术后化疗患者背景资料(n)
1.2 治疗方法
所有患者均接受选择使用TE方案(多西他赛75 mg/m2,d1;表阿霉素75 mg/m2,d1),所有患者都要常规给予6个周期的辅助化疗。其中加用右丙亚胺组(干预组)61例,单纯化疗组 56例,中位年龄47岁。干预组在给予表阿霉素(75 mg/m2)30 min 之前给予右丙亚胺(江苏奥赛康医药公司,商品名奥诺先)静滴(30 min 内滴完,右丙亚胺∶表阿霉素=10∶1)。右丙亚胺由江苏奥赛康公司提供,规格250 mg/瓶,配有1瓶25 mL 0.167 mmol/L乳酸钠专有溶剂,按照制造商说明书应用。
1.3 监测指标
心脏事件的评估:诊断时(治疗前)、治疗后每个周期、治疗完成检查心肌钙蛋白T(cTnt)、血清肌酸激酶同工酶、超声心动图, 根据超声心动图计算左心室射血分数(LVEF)。心脏事件定义为:LVEF 减少≥10%或降低到≤45%;或出现临床心功能不全。
不良事件监护:不良事件按照通用毒性标准(CTC)2.0 版进行评估,于每个周期治疗前进行。
1.4 随访和后继治疗
本组患者无治疗死亡,出院后均保持密切随访,至2011年5月止。后继治疗均按照乳腺癌综合诊疗程序进行。未能继续治疗的患者需记录原因。
1.5 统计学分析
采用SPSS 15.0统计软件进行计数资料的卡方检验(不符合卡方检验时采用Fisher确切概率法)和计量资料的t检验。
2 结果
无失访病例本文。117例患者各项指标变化如表2、3、4所示。
2.1 心脏功能状态的评估
应用左室射血分数、心肌钙蛋白T(cTnt)和肌酸激酶同工酶(CK-MB)为检测指标进行心脏毒性状态评估分别见表2、表3、表4。经t检验,两组患者治疗前左室射血分数差异均无统计学意义;干预组治疗前后左室射血分数均无明显差异(P>0.05),而化疗组治疗后左室射血分数有明显差异(P<0.05);两组患者治疗后的左室射血分数均有显著差异(P<0.05)。干预组治疗前后CK-MB及cTnT浓度变化不明显(F=1.02、2.69,P>0.05)。化疗组患者治疗前后CK-MB浓度变化不明显(F=0.24,P>0.05),而cTnT的浓度变化则显著(F=44.20,P<0.05)。

表2 两组不同时间左室射血分数变化(%)
表3 两组不同时间cTnT检测结果(μg·L-1,±s)

表3 两组不同时间cTnT检测结果(μg·L-1,±s)
组别 n 治疗前 治疗1周期 治疗3周期 治疗完成 治疗半年 治疗1年 治疗2年干预组 61 3.2±1.7 4.1±1.2 4.5±1.3 5.8±1.5 6.1±1.1 5.9±1.3 6.4±1.5化疗组 56 5.2±1.1 7.5±2.2 11.3±3.4 17.6±4.5 22.2±4.8 24.9±2.7 28.4±8.5
表4 两组不同时间CK-MB检测结果(IU·L-1,±s)

表4 两组不同时间CK-MB检测结果(IU·L-1,±s)
组别 n 治疗前 治疗1周期 治疗3周期 治疗完成 治疗半年 治疗1年 治疗2年干预组 61 77.9±10.7 71.6±11.0 78.3±8.7 73.4±12.2 80.1±11.9 82.8±12.7 80.1±10.6化疗组 56 79.4±20.1 83.5±17.3 84.3±13.4 80.6±14.7 89.2±15.5 86.9±12.4 88.4±18.7
2.2 毒副反应的比较
两组患者在非心脏毒性的比较上可以看出,在总的毒性和3/4级毒性上没有统计学差异(Fisher精确检验),这说明应用 右丙亚胺不增加表阿霉素的非心脏毒性反应。见表5。
3 讨论
肿瘤病人化疗过程中,心脏毒性是潜在的非常严重的并发症,直接关系到病人的化疗效果及预后。蒽环类药物是一类对造血系统肿瘤和实体肿瘤具有高效作用的、疗效确切的抗癌药物,在临床化疗方案中呈现出明显的剂量-效应线性关系。但存在剂量累积性心脏毒性,限制了其在临床上的长期应用[3]。蒽环类药物对心脏的损伤是不可逆的、进展性的,降低心脏功能,从而导致临床明显的心功能不全的发生,通常在用药后1周至3月内出现[4],这种心功能不全的进展最终导致患者严重不可逆的活动能力的丧失,从而增加死亡率。
由于蒽环类药物的推广及恶性肿瘤患者生存期的显著延长,该类药物的使用越来越广泛,因此其相关的心脏毒性将来会显得尤为重要。同时,蒽环类药物现在作为生物制剂(如曲妥珠单抗)的序贯用药,而这些药物本身即具有心脏毒性。本试验采用化疗之前给与右丙亚胺对女性乳腺癌患者进行术后辅助化疗,并未发生严重的心脏事件,这说明配伍应用表阿霉素的同时给予右丙亚胺可以降低两药合用带来的心脏毒性的风险。
右丙亚胺是美国FDA批准的惟一蒽环类药物的心脏保护剂, 已进入美国肿瘤化疗及放疗保护剂临床操作指南。蒽环类药物的早期心脏毒性作用表现为心肌细胞水肿、变性,此时仍为可逆性改变,进一步则出现心肌细胞溶解、肌纤维溶解,肌浆网畸变,或为纤维组织取代,甚至坏死,心肌细胞损伤可致心力衰竭,长期心力衰竭也会引起心肌损伤,二者互为因果。此即蒽环类药物的迟发性心脏毒性,严重的可发展为扩张型心肌病甚至出现心力衰竭,此为不可逆性心肌病变[5]。右丙亚胺被认为是通过铁螯合从而起心脏保护作用,防止蒽环类药物-铁离子螯合物的形成及由此产生的自由基,自由基可导致周围心肌组织的氧化损伤。心脏不像其它大多数器官,缺乏足够的清除机制,导致它特别容易受自由基的攻击[6]。在每次给予蒽环类药物的同时使用右丙亚胺已在几项随机对照研究中被证实可以显著降低心脏毒性[2]。
本文在女性乳腺癌患者术后辅助化疗阶段加用右丙亚胺,观察其心脏功能的变化,不仅观察心脏超声波检测下的心功能变化,同时检测相关血清生化指标了解其损伤程度。检测心脏毒性最有效的手段为心内膜活检,属有创性检查且临床上难以大规模开展。目前,监测心脏毒性的手段主要靠心脏超声、心电图、临床症状或心肌酶谱检测。干预组治疗结束, LVEF未见明显改变,而化疗组LVEF则明显降低。表明右丙亚胺与表阿霉素联合应用治疗乳腺癌由阿霉素对左心室射血分数基本没有影响,右丙亚胺能显著降低由表阿霉素引起的充血性心力衰竭发生率。本研究中干预组有1例患者发生2级充血性心衰,但与化疗组中4例3至4级心衰比较,其程度仍较轻。
cTnT是心肌组织特有的—种调节蛋白,在心肌中以游离型(约5%)和结合形式(约95%)存在。两组患者治疗前后CK-MB浓度变化不明显,干预组治疗前后cTnT浓度变化不明显而化疗组治疗前后cTnT的浓度变化则显著,提示在判断蒽环类药物引起的心肌毒性方面,cTnT较我们常规的心肌酶谱更敏感。当心肌受损时游离型cTnT首先逸出细胞外进入血循环而被检出,并随心肌损伤加重,两种类型cTnT血清浓度升高,可作为反映心肌损伤的一种高敏感性、高特异性的标志物[7]。我们的研究发现在即使CK-MB没有明显变化,而 cTnt 则发生了明显的变化。这说明由于心脏的强大代偿能力,常规使用的CK-MB在发生严重心肌损伤前变化不明显,作为检测蒽环类药物引起的心脏毒性的指标敏感性较差。
研究显示右丙亚胺基本不产生新的毒性或增加蒽环类药物的毒性程度。但血液毒性的发生率则有所增加。本研究中干预组中3/4级血液毒性略高于化疗组,但经统计学处理后两组没有差异,分析原因可能是我们的样本量比较少的缘故。充血性心力衰竭患者的生活质量与普通人群及其他慢性并患者(如关节炎)相比,生活质量明显较差,社会功能与精神健康的损害也较严重[8]。因此,右丙亚胺能有效改善接受蒽环类药物治疗的患者生活质量,有较好的风险/效益比率。
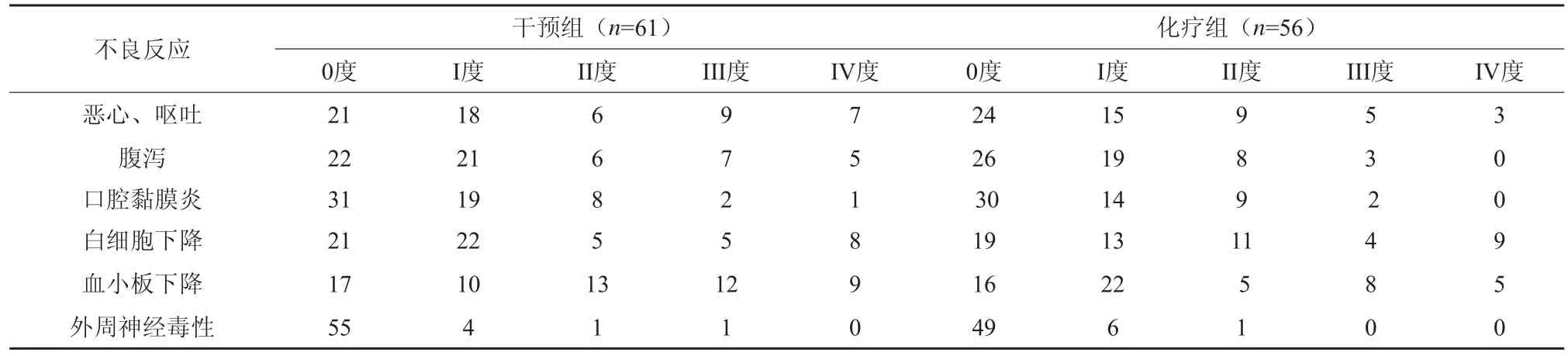
表5 两组副反应的比较(n=117)
本研究通过对使用表阿霉素化疗方案的乳腺癌患者在化疗前使用右丙亚胺的前瞻性对照研究,提示合用右丙亚胺组的心脏毒性明显降低,且不增加其毒性反应,使化疗更加安全,故建议对乳腺癌患者术后采用含蒽环类药物辅助化疗时联用右丙亚胺。但本研究经过入选标准排除了部分病例,对使用赫赛汀、曲妥珠单抗的病例未涉及,值得进一步研究。
[1]Marty M, Espie M,Llombart A,et al.Multicenter randomized phase III study of the cardioprotective effect of dexrazoxane (Cardioxane)in advanced/metastatic breast cancer patients treated with anthracyclinebased chemotherapy[J].Annals of Oncology,2006,17(2):614-622.
[2]Swain SM,Vici P.The current and future role of dexrazoxane as a cardioprotectant in anthracycline treatment:expert panel review[J].Journal of Experimental clinical cancer research,2004,130(1):1-7.
[3]董建红,张 燕,苏喜改,等.参麦注射液联合香丹注射液预防蒽环类化疗药物所致心脏毒性的临床观察[J].现代中西医结合杂志,2007,16(2):177-178.
[4]于亚平.抗肿瘤药物的心脏毒性.当代医学杂志[J].2006,12(5):1 628-1 629.
[5]张小花,姜志荣,李大海,等.蒽环类药物对肿瘤患者左心功能影响的组织多普勒评价[J].临床超声杂志,2007,9(3):151-153.
[6]Lipshultz SE,Rifai N,Dalton VM,et al,The effect of dexrazoxane on myocardial injury in doxorubicin-treated children with acute lymphoblastic leukemia [J].New England Journal of Medicine,2004,351(2):145-153.
[7]赵承俊,李守霞.心力衰竭心肌肌钙蛋白T动态变化及预后价值[J].中国误诊学杂志,2009,9(16):3 837-3 838.
[8]Juenger J,Schellberg D,Kraemer S,et al.Health related quality of life in patients with congestive heart failure:comparison with other chronic diseases and relation to functional variables[J].Heart,2002,87(3):235-241.

