全氟辛烷磺酸(PFOS)对大鼠的肾毒性研究
杨双波,刘清国,旷亦乐,贺栋梁
(1.长沙医学院,湖南 长沙 410219;2.南华大学公共卫生学院,湖南 衡阳 421001)
对全氟辛烷磺酸 (perfluorooctane sulfonate,PFOS)的研究,最近引起了国内外学者的广泛关注[1]。PFOS是一种具有难溶和耐高温、耐强氧化特性的有机化合物,被广泛应用到泡沫灭火剂、杀虫剂、生产润滑剂等多种工业及民用产品中[2]。生物体内的PFOS主要通过食物、饮水和空气进入,并具有较强的生物富集作用,沿食物链逐级转移,最后到人体内聚集[3]。其对机体肝、心脏、免疫系统、生殖及神经系统产生毒作用[4-6]。本文用不同剂量的PFOS对SD大鼠进行染毒,观察其对肾脏的损害作用,研究结果可为全面评价PFOS的毒作用提供实验依据。
1 材料与方法
1.1 试剂与仪器
PFOS-K由武汉市德孚经济发展有限公司提供,普通饲料中加入不同量的PFOS-K制得含PFOS 0mg/kg、5mg/kg、25 mg/kg、125mg/kg 的 PFOS饲料。AB204-N型电子分析天平 (METTLER公司),5810型低温高速离心机和7170A全自动生化分析仪(Eppendorff公司)。
1.2 实验动物及染毒
清洁级3月龄SD大鼠24只,雌雄各半,体重180.0±10.0克,由南华大学实验动物中心提供(合格证号:SCXK(湘)2004-0009),置于专用动物饲养房单笼喂养,室温220C左右,相对湿度60%~70%,预养观察5天后,随机等分为4组,分别用含PFOS 0mg/kg、5mg/kg、25 mg/kg、125mg/kg PFOS 的 饲 料喂养,每天记录进食量,每周称重一次;喂养60d后摘取眼球采血制备血清,备用;然后颈椎脱臼处死大鼠迅速取出肾脏,测定肾脏器系数;然后一侧肾作常规病理学观察,另一侧肾组织匀浆分离上清液,测定丙二醛(MDA)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)。
1.3 观察指标及检测方法
1.3.1 脏器系数测定 迅速取出肾脏,去除附着的脂肪和筋膜,生理盐水漂洗,滤纸吸干,准确称取脏器重量,计算脏器系数。脏器系数(%)=[脏器重量(g)/大鼠体重(g)]×100%。
1.3.2 肾组织病理形态学观察 一侧肾用10%甲醛固定,常规病理学制片,HE染色,光镜下观察形态学变化。
1.3.3 肾功能的测定 经眼眶静脉丛取血,分离血清,用全自动生化仪检测血清UREA、CRE、UA的含量。1.3.4肾组织匀浆液中氧化指标测定 采用硫代巴比妥酸比色法测定MDA含量,DTNB法[7]测定GSH含量,DTNB直接显色法[8]测定GSH-Px活力,Nitrite-kit法[9]测定SOD活力。
1.4 数据统计方法
计量数据以 mean±SD表示,数据采用SPSS 16.0统计软件进行ANOVA,多重比较采用LSD法;以P<0.05为差异有统计学意义。
2 结果
2.1 PFOS对大鼠肾脏器系数的影响
中、高剂量PFOS染毒组大鼠的肾脏脏器系数均高于对照组 (P<0.05),并有一定的剂量-效应关系,见表1。
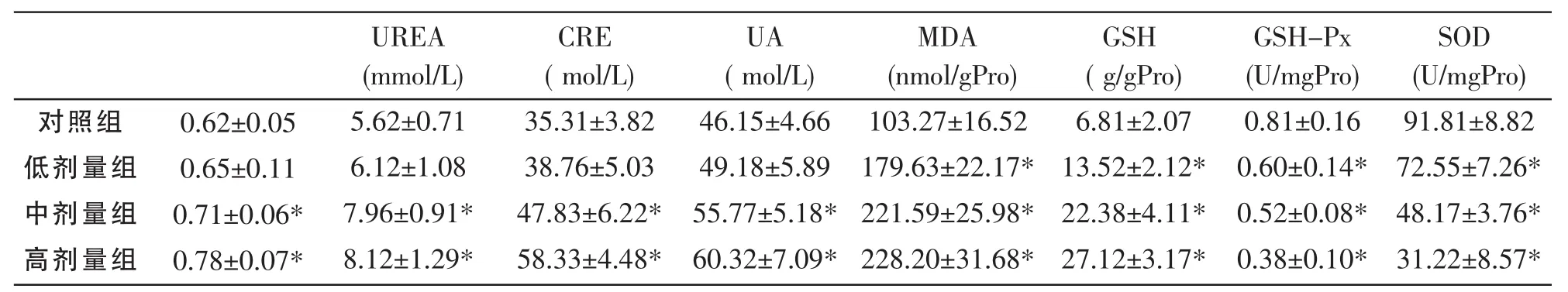
表1 PFOS对大鼠肾脏器系数、肾功能及氧化指标的影响(n=6)
2.2 PFOS对大鼠肾脏病理形态学的影响
肾组织切片显示,与溶剂对照组比较,低剂量PFOS染毒组无明显变化,而中、高剂量PFOS组出现明显的管型和蛋白物质渗出(图1)。
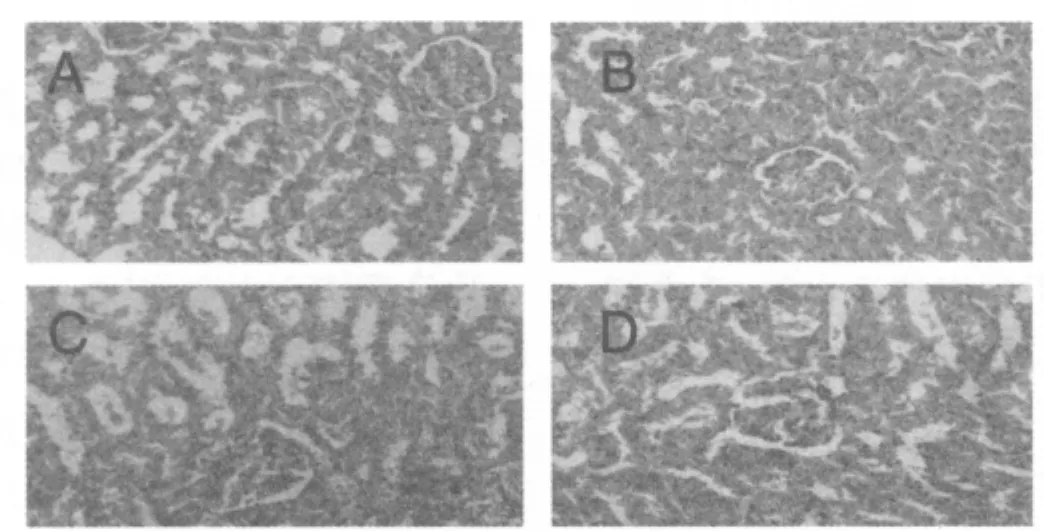
图1:PFOS对大鼠肾组织的损伤作用(400X)
2.3 PFOS对大鼠肾功能的影响
由表1可见,与对照组比较,中、高剂量PFOS染毒组大鼠血清尿素(UREA)、肌酐(CRE)、尿酸(UA)含量均有升高 (P<0.05),但低剂量组与对照组比较差异无统计学意义(P>0.05)。
2.4 PFOS 对肾组织 MDA、GSH、SOD、GSH-Px的影响
从表1见,低、中、高剂量PFOS染毒组大鼠肾组织中MDA、GSH含量较对照组升高 (P<0.05),并有剂量-效应关系;低、中、高剂量PFOS染毒组大鼠肾组织GSH-Px、SOD活力降低,与对照组比较,差异均有统计学意义(P<0.05)。
3 讨论
全氟辛烷磺酸可通过各种途径进入体内,然后通过血液循环被大量运输到肾,尤其是肾皮质,同时肾对其还有浓缩功能,致使肾内具有高浓度的全氟辛烷磺酸[10],它可能对肾产生直接或间接的毒效应。
脏器系数是毒理学亚慢性毒性试验观察指标中一个灵敏的指标,在机体成熟之后,实验动物脏器重量及器官重/体重比率均保持在一定正常范围内,可较好地反映化学毒物对该脏器的综合毒损害作用,也是寻找毒物作用靶器官的重要线索,若外来化合物使某个脏器受到损害,则此比值就会发生改变。本实验结果显示:染毒大鼠的肾脏脏器系数增加,说明PFOS可导致大鼠肾脏肿大。
血 UREA、CRE、UA主要通过肾脏排出,血UREA、CRE、UA的高低与肾脏损伤的严重程度成正比,检测血UREA、CRE、UA等指标是目前评价肾功能损害最简单、有效的方法。本研究结果显示:PFOS喂养组大鼠后,大鼠血UREA、CRE、UA含量升高,肾小管间质中有明显炎性细胞浸润,肾小管上皮变性、管腔狭窄甚至消失,出现明显的管型和蛋白物质渗出,肾皮质结构不清,说明PFOS对肾脏的功能及结构均可产生有一定程度的损伤作用。有研究表明:脂质过氧化所产生的MDA可以与蛋白质、核酸及某些磷脂交联形成Schiff碱,为无活性的大分子复合物,与细胞内某些残余物质累积,又反过来影响线粒体的功能,使活性氧的生成进一步增加,从而形成恶性循环[11]。机体中的酶性抗氧化系统主要有SOD、过氧化氢酶、GSH-Px、谷胱甘肽还原酶等,SOD是清除氧自由基的关键酶,并有终止自由基链锁反应的作用,可使超氧自由基的歧化清除速度提高1010倍,歧化超氧阴离子自由基反应生成毒性较低的H2O2。因此,SOD活性与性质的变化成为一个重要的氧化损伤定量指标。GSHPx是机体内广泛存在的一种含硒抗氧化酶,它将H2O2和许多有机过氧化物转化为水或相应的醇类,从而阻止H2O2与铁反应生成毒性更强的羟自由基,因此可作为评价组织氧化应激水平的重要依据。本实验结果在中、高剂量PFOS染毒组肾织匀浆中MDA、GSH含量明显增高,说明氧化应激在PFOS致肾损伤中具有重要作用;PFOS组肾组织中SOD、GSH-Px活力下降,而MDA含量增高,反映PFOS已导致肾组织清除自由基能力明显下降,脂质过氧化产物大量堆积,将造成肾功能的损伤。
[1]孙冬冬,孙玲.全氟辛烷磺酸的毒理学研究进展[J].环境与职业医学,2011,28(3):2445~2454.
[2]Prevedouros K,Cousins I T,Buck R C,et al.Sources,fate and transport of perfluorocarboxylates[J].Environ Sci Technol,2006,40:32-44.
[3]Ericson I,Martí-Cid R,Nadal M,et al.Human exposure to perfluorinated chemicals through the diet:intake of perfluorinated compounds in foods from the catalan(Spain)market[J].J Agric Food Chem,2008,56(5):1787-1794.
[4]崔歆,杨琳,刘爽,等.持久性环境污染物全氟辛烷磺酸和全副辛酸的污染现状研究进展 [J].环境与职业医学,2010,27(8):74.
[5]曾怀才.全氟辛烷磺酸盐的神经发育毒性研究 [D].华中科技大学,2010,3.
[6]郑丽,董光辉,于一凡,等.全氟辛烷磺酸对小鼠脾细胞NO分泌水平影响[J].中国公共卫生,2010,26(4):32.
[7]张平,孟宪均.分光光度法测定大鼠不同组织还原型GSH含量[J].中华实用外科杂志,1989,6(3):141-14.
[8]夏奕明.改良红细胞还原型谷肤甘肤氧化酶活力的测定方法LDTNB直接法[J].卫生研究,1987,16(4):29.
[9]Qyanangni Y.Revaluation of assay methods and establishment of lcit for super-oxide dismutase activity[J].Analytical biochemistry.1984,142:290-296.
[10]曹培,田金凤,杨新军,等.全副辛烷和全氟辛烷磺酸经大鼠离体皮肤吸收实验 [J].环境与职业医学,2010,27(3):61-63.
[11]Wiland P,Szechcinski J.Proximal tubule damage in patients treated with gentamicin or amikacin[J].Pol J Pharmacol,2003,55(4):631-637.

