非酒精性脂肪肝患者血清同型半胱氨酸水平的研究
姚少芳,刘 琳
(1.陕西能源职业技术学院临床医学系,陕西 咸阳 712000;2.甘肃省中医院白银分院内科,甘肃 白银 730900)
非酒精性脂肪肝(NAFLD)是一种与胰岛素拮抗IR和遗传易感密切相关的代谢应激性肝脏损伤,其疾病谱包括单纯性非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、脂肪性肝纤维化和脂肪性肝硬化4个从轻到重的病理阶段[1]。普通人NAFLD的患病率为20%~33%,其中NASH和肝硬化分别占 10%~20%和2%~3%[2]。 近年来由于生活方式、饮食结构等的改变,NAFLD亦随着肥胖、2型糖尿病、血脂异常等代谢相关疾病的增加而越来越引起人们的重视。
同型半胱氨酸(HCY)是人体内的一种含硫氨基酸,为甲硫氨酸和半胱氨酸代谢过程中的重要中间产物。已经证明:高同型半胱氨酸血症是心血管疾病(CVD)的独立预测因子[3]。 目前 NAFLD 血清HCY的变化仍有争议[4],本研究的主要目的在于进一步探索NAFLD患者血清HCY水平的变化及其临床意义。
1 对象与方法
1.1 研究对象
本试验采用单中心横断面研究方法。选取2009—2011年在甘肃省中医院白银分院经过肝脏穿刺活检确诊为NAFLD的患者31例(试验组),同时选取同期22例健康体检者作为对照组,记录2组性别、年龄、体质量指数(BMI)等基本资料,分别测定2组对象血清中HCY、叶酸、维生素B12、胰岛素水平,并计算稳态模型HOMA-IR。
1)试验组入组标准:①年龄大于18周岁;②超声检查表现为“明亮肝”;③至少在肝脏活检前6个月进行肝功能检测;④按照NAFLD活动度评分标准(NAS)[5]对患者进行肝脏穿刺活检。
2)对照组入组标准:①年龄大于18周岁;②超声检查和肝功能检查均正常。对照组与试验组按照年龄、性别及BMI变量进行匹配,鉴于伦理因素,对照组患者不予以肝脏穿刺术。
3)病例排除标准:①饮酒量大于 20 g·d-1;②肝硬化患者;③其他肝脏疾病患者(如病毒性肝炎、自身免疫性肝炎、药物性肝炎、原发性胆汁性肝硬化、血色素沉着症、肝豆状核变性以及α-1抗胰蛋白酶缺乏症等);④1型糖尿病患者;⑤胰腺炎患者;⑥未控制的甲状腺功能低下和甲状腺功能亢进患者;⑦肾上腺功能不全患者;⑧肾功能衰竭患者;⑨凝血功能障碍者;⑩肿瘤患者;11○妊娠;12○有药物依赖史者;13○在试验开始前12个月内有如下药物服用者:叶酸和任何B族维生素制剂、雌孕激素、糖皮质激素、噻唑烷二酮类药物、胰岛素、干扰素、他莫昔芬以及任何影响肝脏功能和凝血系统的药物。
对所有研究对象均进行体格检查,隔夜禁食后于第2日8:00至9:00在肝脏穿刺前获取血液标本。肝脏穿刺术在超声引导下进行,病理学检查由1名有经验的病理科医生进行,且该医生对患者的病史及实验室检查结果未知。
1.2 观察指标与检测方法
血清天冬氨酸转移酶(AST)、丙氨酸转移酶(ALT)、谷氨酰转移酶(G-GT)、甘油三酯、高密度脂蛋白胆固醇(HDL-C)以及血糖检测在血液标本获取后的1 h内完成,设备采用Olympus AU2700自动分析仪。另一部分血清迅速在-30℃下进行冷冻,检测其中胰岛素、HCY、叶酸、维生素B12及血清铁蛋白的含量;胰岛素的检测采用双位点免疫化学发光法,设备采用Immulite 2500 immunoassay系统;叶酸、维生素B12、HCY的检测采用免疫化学发光法,设备采用ADVIACentaur immunoassay系统。
1.3 统计学方法
2 结果
1)试验组与对照组各观察指标比较见表1。结果显示2组血清HCY、叶酸、维生素B12水平差异无统计学意义(P>0.05),试验组收缩压(SBP)、舒张压(DBP)、AST、ALT、G-GT、血清铁蛋白、甘油三酯、HDL-C、血糖、胰岛素、HOMA-IR均高于对照组,差异具有统计学意义(P<0.05 或 P<0.01)。
表1 2组各观察指标比较
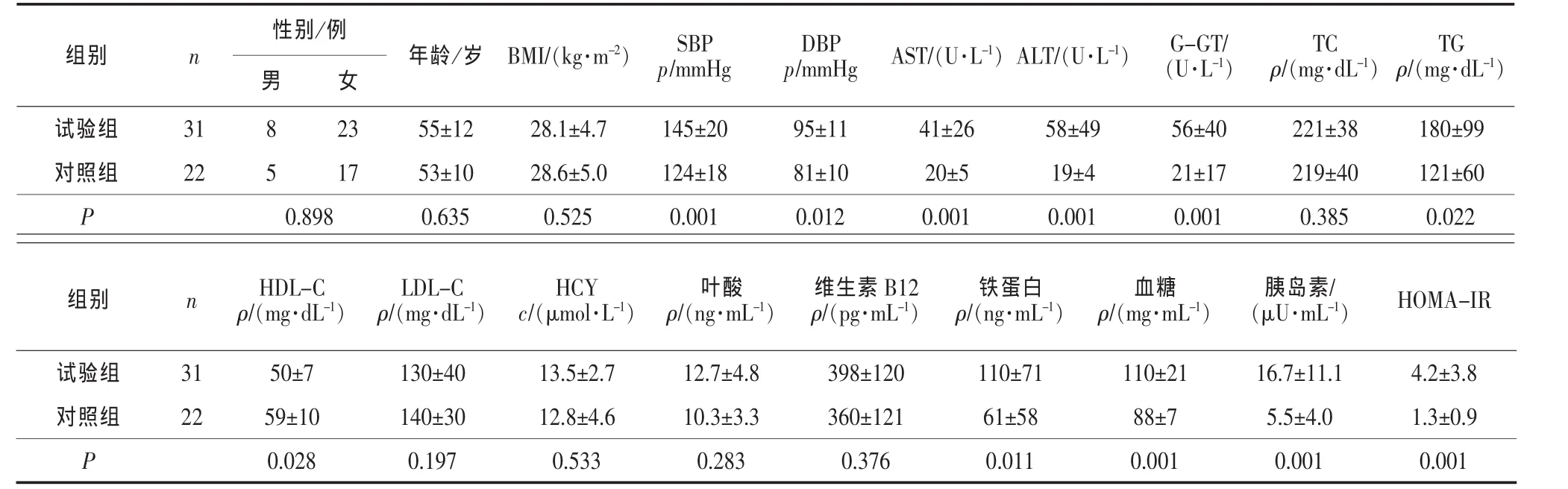
表1 2组各观察指标比较
组别 n 性别/例DBP TG ρ/(mg·dL-1)男 女年龄 /岁 BMI/(kg·m-2) SBP p/mmHg p/mmHgAST/(U·L-1)ALT/(U·L-1)G-GT/(U·L-1)TC ρ/(mg·dL-1)试验组 31 8 23 55±12 28.1±4.7 145±20 95±11 41±26 58±49 56±40 221±38 180±99对照组 22 5 17 53±10 28.6±5.0 124±18 81±10 20±5 19±4 21±17 219±40 121±60 P 0.898 0.635 0.525 0.001 0.012 0.001 0.001 0.001 0.385 0.022组别 n HDL-C ρ/(mg·dL-1)LDL-C ρ/(mg·dL-1)c/(μmol·L-1)叶酸ρ/(ng·mL-1)维生素B12ρ/(pg·mL-1)铁蛋白ρ/(ng·mL-1)血糖ρ/(mg·mL-1)胰岛素/(μU·mL-1)HOMA-IR HCY试验组 31 50±7 130±40 13.5±2.7 12.7±4.8 398±120 110±71 110±21 16.7±11.1 4.2±3.8对照组 22 59±10 140±30 12.8±4.6 10.3±3.3 360±121 61±58 88±7 5.5±4.0 1.3±0.9 P 0.028 0.197 0.533 0.283 0.376 0.011 0.001 0.001 0.001
2)试验组31例NAFLD患者中NAFL 15例,NASH 16例。将NAFL组和NASH组按照年龄、性别和BMI进行匹配,比较后发现NASH组血清HCY水平较NAFL组低(P<0.05),而2组血清叶酸及维生素 B12 水平相当(P>0.05);与此同时,NASH 组HOMA-IR、NAFLD活动度评分(NAS)和血清 AST水平均较 NAFL 组高(P<0.05 或 P<0.01),其余指标,2组水平基本相当(P>0.05)。 见表 2。
表2 NAFL组和NASH组各观察指标比较

表2 NAFL组和NASH组各观察指标比较
组别 n TG ρ/(mg·dL-1)男 女性别/例DBP年龄 /岁 BMI/(kg·m-2) SBP p/mmHg p/mmHgAST/(U·L-1)ALT/(U·L-1)G-GT/(U·L-1)TC ρ/(mg·dL-1)NAFL 组 15 5 10 53±11 27.1±3.7 142±19 95±11 29±6 48±40 46±39 211±48 168±89 NASH 组 16 3 13 54±9 28.1±5.1 145±21 91±12 50±35 49±41 49±27 229±39 188±62 P 0.428 0.935 0.351 0.301 0.912 0.001 0.261 0.631 0.233 0.324组别 n HDL-C ρ/(mg·dL-1)LDL-C ρ/(mg·dL-1)c/(μmol·L-1)叶酸ρ/(ng·mL-1)维生素B12ρ/(pg·mL-1)铁蛋白ρ/(ng·mL-1)血糖ρ/(mg·mL-1)胰岛素/(μU·mL-1)HCY HOMA-IR NAS NAFL 组 15 51±8 113±34 15.7±3.1 12.2±3.8 388±110 99±46 100±19 10.1±9.9 NASH 组 16 49±10 143±10 11.3±2.6 10.1±3.7 379±121 93±48 98±11 15.5±7.0 P 0.808 0.291 0.013 0.273 0.876 0.731 0.091 0.1714.2±3.81.3±0.90.0312.6±1.55.9±4.30.001
3)根据肝脏组织学损伤的程度将NAFLD患者再次进行分组,并统计血清HCY水平,结果显示:随着肝硬化程度、汇管区炎症程度以及肝脂肪变区域的增加,血清HCY水平呈下降趋势,P值分别为0.005、0.029和0.021;但与脂肪变程度、肝小叶炎症或气球样变无明显关联;血清叶酸和维生素B12与组织类型无关。见表3。
4)在Logistic回归分析中,将NAFLD的组织学诊断,即NAFL和NASH作为因变量,将NAFL和NASH 2组中具有统计学差异的因素,如HCY、AST、血糖和HOMA-IR作为自变量,同时将年龄、BMI以及性别等因素也纳入分析之中。在统计分析中,由于HOMAIR的分布并非正态性,因此先将其进行对数转换。结果显示:χ2=20.4(P=0.005),拟合系数R2=0.642。 HCY(P=0.045)、AST(P=0.023),以上 2 项指标均可作为NASH的独立预测因素,但将HOMA-IR的对数进行回归分析后得出P=0.852,无统计学意义。见表4。

表3 HCY与不同肝脏组织学损伤的关系

表4 NAFLD患者的Logistic回归分析
3 讨论
在本试验中,虽然NAFLD患者与对照组相比血清HCY水平无明显差异,但NASH患者血清HCY水平较NAFL患者低,而且,随着肝硬化、汇管区炎症以及脂肪变区域的扩大,血清HCY水平有降低的趋势,并且可以独立预测NASH的存在。起初笔者认为,随着NAFLD严重程度的增加,IR的程度和血清HCY水平也会随之升高,但试验结果却与之相悖。但较低的HCY水平可减少谷胱甘肽的合成,进而造成肝细胞对过氧化事件的敏感性增加,这或许是对以上试验结果的解释之一。
HCY是甲硫氨酸代谢的中间产物,其代谢途径主要有2种:一种为甲基化过程,即通过叶酸循环途径,由甲基四氢叶酸作为甲基供体,维生素B12作为辅因子,在甲硫氨酸合成酶的催化下形成L-甲硫氨酸,其中叶酸循环中的限速酶为5,10-甲基四氢叶酸还原酶;另一种为转硫过程,由维生素B6依赖的胱硫醚β合成酶催化完成,代谢产物进入三羧酸循环或由尿排出。在甲基化过程中,甲硫氨酸是腺苷甲硫氨酸的前体,后者是磷脂酰胆碱合成过程中重要的甲基供体,如果可用的甲基含量过低,磷脂酰胆碱的合成就会减少,从而影响极低密度脂蛋白(VLDL)从肝脏的转运,结果使脂肪在肝脏蓄积而引起脂肪肝。在硫化途径中,胱硫醚水解生成半胱氨酸,从而进一步形成还原剂谷胱甘肽(GSH),低GSH在NAFLD的发病过程中扮演重要角色。
还有2项研究比较了NASH与NAFL患者血清HCY的水平[6-7],结果与本次试验基本一致,但不同的是,此2项研究未将NAFLD患者按照BMI与对照组进行匹配,而且没有显示血清叶酸及维生素B12的水平。目前,NAFLD患者血清HCY的水平仍存在争议,也有研究显示NAFLD患者HCY水平比对照组高[8]。
众所周知,治疗NASH的甘氨酸三甲内盐是人类重要的营养元素之一,它通过食物源性胆碱氧化而来,是HCY转化为甲硫氨酸唯一的甲基供体。NASH患者与健康对照组相比,血清甲硫氨酸和HCY水平无显著性差异。对NASH用甘氨酸三甲内盐进行为期1年的治疗后,肝脂肪变程度较之前有了明显改善,而且血清甲硫氨酸含量得到提高,但对于肝硬化、血清HCY水平和血清总抗氧化剂含量则无影响[9]。从此可以推测,甘氨酸三甲内盐使得HCY向甲硫氨酸的转化成为可能,从而增加了VLDL的装配与转运,因此该药只可减轻脂肪肝的程度,而对肝硬化无效。
在慢性酒精中毒的患者中,高同型半胱氨酸血症与脂肪肝常常伴随出现,HCY的代谢与叶酸、维生素B6、B12密切相关,而在慢性酒精中毒中,以上这些物质往往较为缺乏。除此之外,血清HCY与病毒性肝炎、自身免疫性肝炎等其他肝脏疾病的关系还未明确,也有研究指出,其他肝病的患者中,血清HCY 水平较正常组升高[10]。
关于IR综合征患者体内低HCY的报道还不多见,需要指出的是,在血糖处于正常值上限的健康人中,其BMI、血压、甘油三酯以及纤溶酶原激活物-1的水平均较高,但HCY水平较无IR的人群低。
本试验第1次比较了NASH患者和NAFL患者血清HCY的水平,并发现前者HCY水平更低,通过分析发现HCY可以作为NASH存在及其严重程度的独立预测指标,但结果仍需大规模临床试验证实。与此同时,本试验尚存在局限性,比如:1)由于技术原因,作为评估IR金标准的正常高血糖胰岛素钳夹技术在本试验中未被使用,这在一定程度上影响了实验的精确程度,但本试验采用了被广泛使用的HOMA-IR,其准确度相对较为可靠;2)实验中未测定血清GSH和甲硫氨酸水平,因为在笔者看来,GSH和甲硫氨酸对实验结果的影响较小,因为这2种物质在血清中的浓度同时取决于它们的产生和降解;3)笔者假设了在HCY甲基化过程和转硫过程中酶的充分性,但未经过试验证实;4)实验中尚存在未考虑到的影响因素,比如膳食、生活习惯等。
鉴于以上局限性,要进一步明确血清HCY与NAFLD的关系,还需开展更大规模、包含更多调查变量的随机试验。
[1]敬晓琴.非酒精性脂肪肝的研究进展[J].胃肠病学和肝病学杂志,2008,6(16):509-516.
[2]Farrell G C,Larter C Z.Nonalcoholic fatty liver disease:from steatosis to cirrhosis[J].Hepatology,2006,43(S1):S99-S112.
[3]de Ruijter W,Westendorp R G,Assendelft W J.Use of Framingham risk score and new biomarkers to predict cardiovascular mortality in older people:population based observational cohort study[J].BMJ,2009,338:a3083.
[4]Vaya A,Carmona P,Badia N.Homocysteine levels and the metabolic syndrome in a Mediterranean population:a case-controlstudy[J].Clin Hemorheol Microcirc, 2011,47:59-66.
[5]Kleiner D E,Brunt E M,Van N M.Design and validation of a histology scoring system for nonalcoholic fatty liver disease[J].Hepatology,2005,41:1313-1321.
[6]Kalhan S C,Guo L,Edmison J,et al.Plasma metabolomic profile in nonalcoholic fatty liver disease[J].Metabolism,2011,60:404-413.
[7]Kasumov T,Edmison J M,Dasarathy S,et al.Plasma levels of asymmetric dimethylarginine in patients with biopsy-proven nonalcoholic fatty liver disease[J].Metabolism,2011,60:776-781.
[8]Gulsen M,Yesilova Z,Bagci S,et al.Elevated plasma homocysteine concentrations as a predictor of steatohepatitis in patients with nonalcoholic fatty liver disease[J].J Gastroenterol Hepatol,2005,20:1448-1455.
[9]Abdelmalek M F,Sanderson S O,Angulo P,et al.Betaine for nonalcoholic fatty liver disease:Results of randomized placebo-controlled trial[J].Hepatology,2009,50:1818-1826.
[10]Bosy Westphal A,Ruschmeyer M,Czech N,et al.Determinants of hyperhomocysteinemia in patients with chronic liver disease and after orthotopic liver transplantation[J].Am J Clin Nutr,2003,77:1269-1277.

