TLR3在poly(I:C)-LMW预处理后缺糖缺氧诱导的原代皮质神经元的表达意义
宋 璞 崔桂云 陈 伟 赵秋宸 花 放 沈 霞
1)徐州医学院神经病学教研室(徐州医学院附属医院神经科)徐州 221000 2)徐州医学院临床医学系 徐州 221000
脑组织缺血再灌注损伤(ischemia/reperfusion,I/R)一直是人们研究的热点,近年来,已经证实缺血部位的炎症反应参与I/R损伤[1]。而作为自身免疫炎症相关性蛋白重要的一员,属于IL-1R/TIR超家族的Toll样受体家族(Toll like receptors,TLRs),可以识别特异性配体并激活相应通路启动免疫反应[2]。Hua等[3-4]已通过研究证实,TLR2和 TLR4可以通过调节炎性因子的水平参与I/R损伤过程。且在本实验的前期实验中,Wan等通过动物实验证实,大鼠经全脑缺血再灌注后,其脑组织TLR3表达上调且存在时间依赖性。Préhaud等[5]在体外研究了人的神经元细胞对病毒感染起天然免疫反应,利用狂犬病病毒感染人类神经元系细胞NT2-N发现TLR3mRNA及IFN-βmRNA表达均上调,提示TLR通过调节炎性因子的水平参与I/R损伤过程,而且炎症反应有可能与神经元细胞本身存在的TLR表达有关,同时,在一定条件干预下,如缺血再灌注、病毒感染等可影响其表达。poly(I:C)-LMW 为一人工合成的dsRNA片段,可特异性激活细胞上的TLR3。故本实验以离体大鼠皮质神经元为研究对象,通过缺糖缺氧方法,在离体水平模拟缺血再灌注的病理生理过程,并通过poly(I:C)-LMW预处理等方法,检验神经元本身是否存在TLR3的表达,并观察其表达在缺糖缺氧过程中的意义。
1 材料与方法
1.1实验动物孕18dSprague-Dawley(SD)大鼠,由徐州医学院实验动物中心提供。
1.2主要试剂兔抗TLR3多克隆抗体(英国abcom公司),激动剂poly(I:C)-LMW(美国InvivoGen公司),neuro-basal培养基及B27(美国GIBICO公司),无糖培养基(美国GIBICO公司),RT-PCR试剂盒(北京天根生化科技有限公司),Western blot所需二抗均由徐州医学院神经生物实验室提供。
1.3原代皮质神经元培养及缺糖缺氧、激动剂预处理方法原代皮质神经元培养:孕18dSD大鼠,乙醚麻醉断头后,取胎鼠大脑皮质,剪碎,胰酶37℃消化15min,胎牛血清终止消化。加入无血清培养基(neurobasal medium 100mL含有2mL B27,200mmol/L谷氨酰胺250μL,25μmol/Lβ-巯基乙醇45.5μL)反复吹打数次,200目滤网过滤后,细胞计数,以1.2×10×5个/mL的密度接种于用多聚赖氨酸预处理的培养瓶内,置于37℃,5%CO2培养箱中培养。第4天换神经元生长培养基(neurobasal medium 100mL含有2mL B27,200mmol/L谷氨酰胺250μL),每周半换液2~3次。缺糖缺氧:取培养7d神经元细胞,换无糖培养基后,放入缺氧培养箱(37℃,5%CO2,1%O2)培养2h后,更换新鲜神经元生长培养基后,放回37℃,5%CO2培养箱中培养24h后用于实验。激动剂预处理:取培养7d神经元细胞,更换新鲜神经元生长培养基后,加入50μL 0.1mg/mL poly(I:C)-LMW,(若使用24孔板,则每孔加5μL 0.1mg/mL poly(I:C)-LMW)使工作液浓度达1μg/mL左右,预处理12h后,用于后续操作。
1.4实验分组将以上述方法培养7d的同批神经元细胞随机分为4组:正常组;OGD组(缺糖缺氧);poly(I:C)组,予1μg/mL poly(I:C)预处理12h,不缺糖缺氧;OGD+poly(I:C)组,予1μg/mL poly(I:C)预处理12h,缺氧复氧。
1.5 Western blot检测TLR3表达各组细胞(n=2),加入细胞裂解液约50μL加蛋白酶抑制剂2μL,冰上孵育30 min,细胞刮刀刮离,离心。用Lowry法测定蛋白浓度。取总蛋白80μg经120g/L SDS-聚丙烯酰胺凝胶电泳分离。转印,杂交,暗室内扫描蛋白印迹条带。
1.6 RT-PCR检测TLR3mRNA表达
1.6.1 引物准备:根据Genebank资料,利用primer premiers5.0引物设计软件确定最优引物,然后经Blast匹对,同时选取β-actin作为内参对照,引物由上海生工生物有限公司合成。见表1。
1.6.2 组织总RNA提取:取离体培养神经元细胞,经相应预处理后,加入1mL TRNzol试剂,其后按照试剂说明书进行,提取的RNA测定D260/OD280比值,读数1.7~1.9认为RNA纯度达标。

图1 TLR3蛋白在不同组大鼠离体皮质神经元表达情况
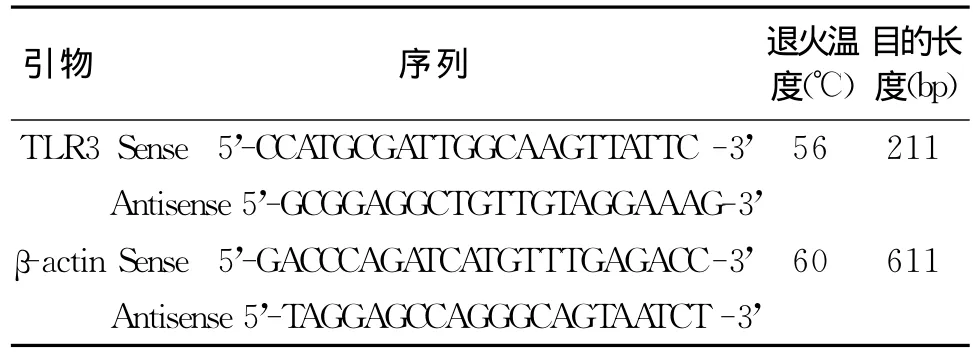
表1 PCR各引物序列及相关参数
1.6.3 逆转录:应用cDNA第一链合成试剂盒将提取的总RNA逆转录为cDNA进行PCR反应。
1.6.4 PCR扩增及结果分析:按照试剂说明书配制PCR反应体系,TLR3PCR反应条件:预变性:94℃3min;循环30次:94℃30s、56℃30s、72℃1min;终末延伸:72℃5 min。β-actin PCR反应条件:预变性:94℃3min;循环30次:94℃30s、60℃30s、72℃1min;终末延伸:72℃5min。
1.7免疫荧光各组细胞(以24孔板培养)移去培养基,PBS洗1次,4%多聚甲醛固定,PBS洗3次,0.5%Trioton-100透膜处理,PBS洗3次后封闭液封闭,0.1%tween-20洗3次后一抗孵育过夜,加二抗,0.1%tween-20后电镜下观察。
1.8图像处理及统计学分析蛋白及电泳条带均采用ImageJ软件进行图像分析,结果采用灰度比值表示,数据采用SPSS16.0统计分析软件进行统计学处理,数据以均数±标准差(s)表示,2组间比较用t检验,P<0.05为差异有统计学意义。柱状图采用Graph Pad Prism 5作图软件对于灰度值进行统计学处理后生成。
2 结果
2.1 Western blot和RT-PCR结果及分析Western blot分析显示缺糖缺氧组TLR3蛋白表达水平明显高于空白对照组与激动剂预处理组,激动剂预处理组TLR3蛋白表达水平比空白对照组高(P<0.05),而缺糖缺氧组与激动剂预处理后缺糖缺氧组比较差异无统计学意义(P>0.05)。RTPCR分析显示缺糖缺氧组TLR3蛋白表达水平明显高于空白对照组与激动剂预处理组,激动剂预处理组TLR3蛋白表达水平比空白对照组高(P<0.05),而缺糖缺氧组与激动剂预处理后缺糖缺氧组比较差异无统计学意义(P>0.05)。见图1~4。

图2 TLR3mRNA在不同组大鼠离体皮质神经元表达情况

图3 TLR3蛋白在不同组大鼠离体皮质神经元表达的灰度比值(TLR3/β-actin)

图4 TLR3mRNA在不同组大鼠离体皮质神经元表达的灰度比值(TLR3mRNA/β-actin)
2.2免疫荧光结果免疫荧光显示对照组及激动剂组细胞状态良好,呈类圆形、多边形,周围有较多突起,连接成蛛网状,视野下细胞数目较多,OGD组、激动剂+OGD组视野下细胞数目较少,且细胞形态不规则并可见较多细胞碎片,其中OGD组细胞损伤更为明显。见图5~9。

图5 对照组神经元细胞免疫荧光情况

图6 缺糖缺氧组神经元细胞免疫荧光情况

图7 激动剂poly(I:C)-LMW预处理组神经元细胞免疫荧光情况

图8 激动 剂 poly(I:C)-LMW预处理后缺糖缺氧组神经元细胞免疫荧光情况

图9 各组细胞数目比值(400倍)
3 讨论
近年来,缺血再灌注损伤一直是人们研究的热点,而本实验正是通过对离体神经元缺糖缺氧的方法,体外模拟缺血再灌注损伤的病理生理过程,从而在离体神经元细胞水平上,探究神经元本身是否存在TLR3的表达,并观察其表达在缺氧/复氧过程中的意义。
基于人们此前的研究,虽然现已提出包括钙超载[6]、自由基损伤[7]、NO作用[8]等数种可能机制,但具体病理生理过程仍不明确。最近几年,研究热点转向了缺血区域的炎症反应,通过研究,人们发现免疫细胞的活化与募集[9]、各种炎性因子的释放[10-11]都可以加重组织损伤,且Toll样受体家族成员可以被死亡细胞释放的热休克蛋白、纤维蛋白原及DNA和RNA片段激活[12],这提示Toll样受体可以参与体内的无菌性炎症。针对于此,Hua等[3]通过研究证实TLR4在脑缺血再灌注损伤中被激活,而将TLR4基因敲除后可减轻脑损伤,这一作用可能通过调控TLR4信号通路实现。然而,在对TLR4和TLR2的对比试验中提示两者可能在脑缺血再灌注损伤中起到截然相反的作用,TLR2敲除小鼠在脑缺血后出现更为严重的症状,而TLR4敲除小鼠神经系统损伤程度则明显减轻[13]。Wan等通过动物实验也证实大鼠经全脑缺血再灌注后,其脑组织TLR3表达上调且存在时间依赖性。Préhaud等[5]利用狂犬病病毒感染人类神经元系细胞NT2-N发现TLR3mRNA及IFN-βmRNA表达均上调,基于以上研究成果,我实验小组大胆提出了TLR通过调节炎性因子的水平参与I/R损伤过程,而且炎症反应有可能与神经元细胞本身存在的TLR的表达有关,同时,在一定的条件干预下(如缺血再灌注、病毒感染等)可影响其表达。
TLR3可以识别病毒复制过程中产生的dsRNA而启动抗病毒反应[14],死亡细胞产生的mRNA也可以成为TLR3的配体[15],而 poly(I:C)-LMW 为一人工合成的 dsRNA 片段,可特异性激活细胞上的TLR3。缺氧/复氧实验是在离体水平模拟脑组织缺血再灌注损伤,以便更为直观地研究某一种或几种类型的细胞在缺血再灌注损伤中病理生理过程的改变及作用。
我们在实验中观察到,离体大鼠皮质神经元存在TLR3的表达,且缺氧/复氧及激动剂poly(I:C)-LMW 均可使其表达上调,并观察到,经过poly(I:C)-LMW 预处理后的神经元行缺氧/复氧实验,通过免疫荧光观察到其损伤水平轻于未行预处理的缺氧/复氧组,但重于仅经预处理未行缺氧/复氧组及对照组,由此说明,poly(I:C)-LMW 预处理可使神经元细胞TLR3表达上调,并可在缺氧/复氧这一不利条件下,通过某些因素减轻细胞损伤。
再结合近年的研究进展,炎症反应参与脑缺血/再灌注损伤机制,免疫炎症在脑缺血/再灌注损伤中的作用已被大量研究证实,而Toll样受体家族与免疫炎症的紧密联系使其获得了人们的关注。TLR4是最早引起人们注意的家族成员,人们最先在肺脏、心脏、肝脏以及肾脏的缺血性损伤中认识到了TLR4的存在[16-19],随后在脑缺血/再灌注损伤中也观察到了TLR4的活化,随后的研究中人们认识到TLR4作为损伤因素参与I/R损伤。在体内各脏器的缺血性损伤中TLR4作为损伤因素参与其病理生理过程,Hua等[3-4]的研究将Toll样受体家族引入了缺血性脑损伤的研究范围,当下TLR4、TLR2、TLR9已先后被证实参与脑缺血/再灌注损伤。随后对于TLR2的研究却出现了与TLR4相反的现象。
而TLR3被激活后主要通过 MyD88-非依赖性通路即TRIF通路而发挥作用,最终激活干扰素调节因子3(interferon regulator factor 3,IRF3)使其磷酸化后转位入核诱导干扰素β(interferonβ,IFN-β)基因表达[20-21],从而使细胞出现自身免疫炎症反应,造成细胞损伤,而根据本实验可推断,预先使用TLR3激动剂poly(I:C)-LMW 处理,提高了神经元细胞对缺血再灌注损伤的耐受性,且Ziegler、Hua等在早先进行的关于TLR2的实验中亦得出了相似结果[22-23]。我们推测这可能是由于预处理组的神经元在缺氧发生前TLR3表达升高,并通过某些横向的通路联系反馈抑制了下游的某些损伤性因子表达,或上调了某些保护性因子的表达,从而减轻了缺氧复氧后神经元细胞自身免疫反应,进而减轻了细胞损伤。换言之,通过TLR3激动剂poly(I:C)-LMW 对原代皮质神经元预处理,提高了细胞对于缺氧环境的耐受力,从而减轻了细胞损伤。
综上所述,原代皮质神经元细胞本身存在TLR3的表达,且激动剂预处理后,减轻原代皮质神经元在缺氧环境下的损伤,但造成此现象的纵向、横向通路联系及机制并不十分清楚,因而,TLR3及MyD88非依赖通路的激活对脑缺血再灌注损伤的作用机制仍有待于进一步研究。
[1]Stoll G.Inflammatory cytokines in the nervous system:multifunctional mediators in autoimmunity and cerebral ischemia[J].Rev Neurol(Paris),2002,158(10Pt 1):887-891.
[2]Aderem A,Ulevitch RJ.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-787.
[3]Hua F,Ma J,Ha T,et al.Activation of Toll-like receptor 4 signaling contributes to hippocampal neuronal death following global cerebral ischemia/reperfusion[J].J Neuroimmunol,2007,190(1/2):101-111.
[4]Hua F,Ma J,Ha TZ,et al.Differential Roles of TLR2and TLR4in acute focal cerebral ischemia/reperfusion injury in mice[J].Brain Res,2009,1262:100-108.
[5]Préhaud C,Mégret F,Lafage M,et al.Virus infection switches TLR-3-positive human neurons to become strong producers of beta interferon[J].J Virol,2005,79(20):12 893-12 904.
[6]Dirnagl U,Iadecola C,Moskowitz MA.Pathobiology of ischaemic stroke:an integrated view[J].Trends Neurosci,1999,22:391-397.
[7]Loh KP,Huang SH,De Silva R,et al.Oxidative stress:apoptosis in neuronal injury[J].Curr Alzheimer Res,2006,3:327-337.
[8]Kilic E,Kilic U,Matter CM,et al.Aggravation of focal cerebral ischemia by tissue plasminogen activator is reversed by 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor but does not depend on endothelial NO synthase[J].Stroke,2005,36(2):332-336.
[9]David Brea Tomás,Sobrino Pedro,Ramos-Cabrer.Inflammatory and neuroimmunomodulatory changes in acute cerebral ischemia[J].Cerebrovasc Dis,2009,27(suppl 1):48-64.
[10]Mabuchi T,Kitagawa K,Ohtsuki T,et al.Contribution of microglia/macrophages to expansion of infarction and response of oligodendrocytes after focal cerebral ischemia in rats[J].Stroke,2000,31(7):1 735-1 743.
[11]Zhu Y,Yang GY,Hlemeyer B,et al.Transforming growth factor-beta 1increases bad phosphorylation and protects neurons against damage[J].J Neurosci,2002,22:3 898-3 909.
[12]Marshak-Rothstein A.Toll-like rece ptors in systemic autoimmune disease[J].Nat Rev Immunol,2006,6(11):823-835.
[13]Aderem A,Ulevitch RJ.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-787.
[14]Katherine AF,Sarah MM,Kerrie LF,et al.IKK epsilon and TBK1are essential components of the IRF-3signaling pathway[J].Nat Immunol,2003,4(5):491-496.
[15]Kariko K,Ni H,Capodici J,et al.mRNA is an endogenous ligand for Toll-like receptor 3[J].J Biol Chem,2004,279:12 542-12 550.
[16]Kim BS,Lim SW,Li C,et al.Ischemia-reperfusion injury activates innate immunity in rat kidneys[J].Transplantation,2005,79:1 370-1 377.
[17]Ha T,Hua F,Li Y,et al.Blockade of MyD88attenuates cardiac hypertrophy and decreases cardiac myocyte apoptosis in pressure overload induced cardiac hypertrophy in vivo[J].Am J Physiol Heart Circ Physiol,2006,290:H985-H994.
[18]Zhai Y,Shen X,O'Connell R,et al.Edge:TLR4activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway[J].J Immunol,2004,173:7 115-7 119.
[19]Kim BS,Lim SW,Li C,et al.Ischemia-reperfusion injury activates innate immunity in rat kidneys[J].Transplantation,2005,79:1 370-1 377.
[20]Sharma S,Tenoexer BR,Grandvaux N,et al.Triggering the interferon antiviral response through an ikk-related pathway[J].Science,2003,30(12):1 148-1 151.
[21]Farina C,Aloisi F,Meinl E.Astrocytes are active plays in cerebral innate immunity [J].Trends Immunol,2007,28(3):138 214.
[22]Ziegler G,Harhausen D,Schepers C,et al.Tlr2has a detrimental role in mouse transient focal cerebral ischemia[J].Biochem Biophys Res Commun,2007,359:574-579.
[23]Hua F,Ma J,Ha TZ,et al.Preconditioning with a TLR2 specific ligand increases resistance to cerebral ischemia/reperfusion injury[J].J Neuroimmunol,2008,199(1/2):75-82.

